工艺原理
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第1663页(1014字)
生产氯化镁的原料一般用制溴后的废液(用浓厚卤提溴后的母液)。其密度为1.3g/cm3(33~34°Bé),化学组成见表6-5-1。由表可见,制溴废液中MgCl2的浓度已相当高,只需蒸发部分水分和分离掉杂质盐类,就可制得产品。因原料液中杂质盐很少,基本可以看成是MgCl2-H2O体系,生产工艺原理可用MgCl2-H2O体的相图进行分析,见图6-5-1。
表6-5-1 制溴废液组成

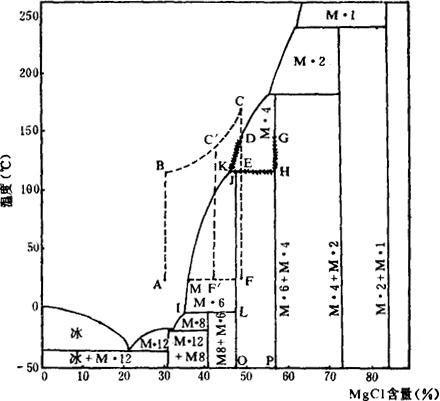
图6-5-1 氯化镁生产工艺原理分析图
M·l2-MgCl2·12H2O M·8--MgCl2·8H2O M·6-MgCI2·6H2O
M·4-MgCl2·4H2O M·2-MgCl2·2H2O M·1-MgCl2·H2O
图6-5-1中的A点为原料液的组成点(约含MgCl2,30%,25℃),因高浓度MgCl2溶液的饱和蒸汽压很低,在常温下自然蒸发速度很慢,生产上多采用高温沸腾蒸发。控制终止沸点在163~180℃时,冷却后得到含MgCl245~50%的产品。在MgCl2-H2O体系的相图上,其具体过程是:体系点A→B点是卤水的升温过程,到B点卤水开始沸腾并蒸发水分。随着浓度的提高卤水的沸点也不断升高,体系点由B点沿BC曲线向C点移动,到达C点时(沸点约为170℃),停止蒸发,并将清液进行冷却。当温度降到D点(约为152℃左右)时,开始有MgCl2·4H2O结晶析出。继续冷却降温,体系点沿DE线向E点移动,此时液相点沿DK线向K点移动,固相点沿GH线向H点移动,在此过程中只有MgCl2·4H2O析出。当体系点到达E点时(液相点为K点,固相点为H点),MgCl2·6H2O饱和。继续冷却,体系点E和液相点K不动,固相点沿HE线向E点运动,此时原析出的部分MgCl2·4H2O转溶成MgCl2·6H2O晶体析出。当固相点到达E点时,液相消失,MgCl2·4H2O未转溶完就全部凝固,此时固相为MgCl2·4H2O和MgCl2·6H2O的混合晶体。继续冷却,固相组成不变,只是温度不断降低,直至冷却到常温。体系点由E点降到F点,全部过程结束。