霉形体的血清学鉴定
出处:按学科分类—农业科学 中国农业出版社《兽医微生物实验诊断手册》第463页(3572字)
一、制备抗原和抗血清
制备抗血清用的霉形体培养物,需先经过纯化(第三节)以保证是单一的血清型。液体培养基分装成每瓶80ml,一般约需500~1000ml总量。免疫用健康兔体重2~3kg,免疫方法如下。
1.抗原制备
(1)生长于肉汤中的霉形体在培养基中性或微碱的情况下收获,以免抗原性受到破坏。
(2)离心30min,弃上清液,沉淀物用100~200mlpH7.5的PBS液洗2次。将沉淀物悬浮于4~8mlPBS中,置于旋涡混合器上处理,使霉形体细胞均匀悬浮。
(3)将4ml抗原与等量的弗氏完全佐剂充分混合使之乳化。随即注射家兔。暂时不用的抗原仍以水相状态贮存在-70℃供以后应用。
2.免疫 用2只家兔,每只事先采血约5ml,为免疫前血清样品。家兔免疫程序为,第1天,每兔作4点肌肉注射,每点各0.5ml,再作4点皮下注射,每点0.2ml;第21天,每兔采血5ml作为试血,同时作4点肌肉注射,每点0.5ml;第28、35和42天时采血测抗体,常可产生满意的抗体效价。
3.各次采集的血清用生长抑制试验(本节之二)或琼脂扩散试验用于测定抗体水平。生长抑制圈宽度达5~15mm或琼扩效价达1∶64的抗血清,用于免疫荧光试验或代谢抑制试验时,将获得满意的结果。家兔达到上述的抗体水平时即可放血,分离血清,贮于-20℃备用。
4.免疫扩散试验 用于测定每份血清的特异性,如存在交叉反应抗体,则用相应的抗原吸收掉。
二、生长抑制试验(GI)
用已知抗血清对霉形体分离物进行菌落生长抑制试验,是国际霉形体分类委员会推荐的法定血清学方法之一,其方法如下。
1.新鲜制备的琼脂平皿,厚度不少于4mm,在37℃中,底与盖分开放置30min,使挥发水蒸气。
2.将对数期霉形体肉汤培养物稀释100倍,其浓度应约为103~106CFU/ml。(能在琼脂平皿上产生一个菌落的霉形体悬液的最高稀释度即一个CFU)。
3.接种100μl至琼脂平皿上,用“L”型玻棒涂布均匀后,略置室温中使接种物吸入。
4.用灭菌镊子将选定的预先准备好的抗血清滤纸片(直径6mm无菌滤纸片已吸收一滴约20μl抗血清,并已干燥了的)。小心地放至接种后的平皿上,纸片间保持1.5~2cm距离,并编号。
5.按所测定霉形体的生长需要,选择培养条件和时间。
6.在低倍镜下,测量抗血清纸片抑菌圈的宽度。判定标准圈的宽度大于1mm者阳性;小于0.5mm者阴性;介于二者之间时,可采取减少培养基中血清或酵母浸液浓度。
三、代谢抑制试验(MI)
霉形体在含有特殊基质的液体培养基中生长时,其代谢使培养基发生pH变化,用指示剂可显示;有的霉形体如生殖道霉形体,生长时不发生pH变化,而将无色透明的四氮唑还原成红色甲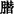 。特异性抗血清抑制霉形体增殖而阻止这种颜色变化。可用已知抗体鉴定种,或已知的种测抗体。
。特异性抗血清抑制霉形体增殖而阻止这种颜色变化。可用已知抗体鉴定种,或已知的种测抗体。
1.材料 葡萄糖发酵、精氨酸分解、尿素分解等培养基见表19-2。四氮唑还原的培养基,可用氯化三苯四氮唑代替培养基中的葡萄糖或精氨酸,最终的氯化三苯四氮唑浓度为0.008~ 0.5%,培养基pH为7.6。
所用被测菌株,应活性强,处于对数生长期(可在生长后置-30℃保存备用)。测抗体效价应用同一批量的培养物,每一批培养物应测定它所含有的变色单位(CCU,即colour changing unit的缩写)。
所用抗血清与生长抑制试验同。
2.方法
(1)先滴定抗原 取被测菌株,以培养基作10管连续10倍稀释,将每一稀释度加至塑料板孔,每孔100μl,自左至右浓度递增。再在每孔中加100μl培养基,用灭菌滤纸吸干可能溅落于孔外的液滴,用涤纶胶带封板,于37℃中培养。产生颜色变化的最高稀释度即含一个CCU。如10-1~10-7稀释度发生变色变化,而10-8以上不变色,表明该批菌株每100μl中含107CCU。
(2)进行试验方法 在塑料板的每孔中加入100μl的试验培养基,再加灭活抗血清100μl至第一孔中,作一系列2倍稀释直至第10孔(1∶1024),再在每孔中加入含1000个CCU的贮藏菌液100μ1。如上例,效价为10-7,则作10-4的稀释。每批试验设不加抗血清的抗原对照孔。然后用灭菌滤纸吸去孔外液滴,加盖后在37℃放置10min后用涤纶胶带封板,在37℃培养。但如生长迅速的霉形体如丝状霉形体丝状亚种,宜将培养温度降至25~30℃,逐日观察,最后判定结果。当与抗原对照孔色变约相差pH0.5时作首次判定,而四氮唑还原试验首次判定则是在抗原对照孔出现红色时进行。抑制出现色变的最高血清稀释度即血清效价。当延长培养时间至不再继续产生色变时作最后判定。抑制价≥16认为是阳性。许多抑制价为128~512,用几份不同种的抗血清同时对一霉形体试验,产生MI效价最高的抗血清其抗原判与被测霉形体同种。
四、免疫荧光试验
1.直接免疫荧光试验 主要用于鉴定自琼脂平皿分离的霉形体菌落,观察标本中全部菌群及估算其不同种的比例,也可用于测定经纯化后的培养物的纯度。
直接荧光法 需购入相应的荧光抗体,如需自制,可将免疫血清按血清学方法自行制备,制备后应测定其效价。将8支小试管,第1管加PBS1.8ml,其余7管每管加PBS1ml。向第一管加荧光抗体0.2rnl,混合后从中取1ml加到第2管,以后由此类推。得到1∶10~1∶1280不同对倍稀释的荧光抗体。然后取长好单个菌落的与抗血清相对应的霉形体琼脂平皿培养物,加入约5ml的PBS,置室温中半小时,吸弃PBS,再用铲刀切取琼脂培养物8块,每块约1cm2,分置于载玻片上,另准备平皿,放入湿滤纸,将两根玻棒平行放在湿滤纸上,再将有琼脂块的载玻片搁在玻棒上。然后将8个不同稀释度的荧光抗体,分别滴到8个琼脂块上,每块1~2滴,并作稀释度的标记,盖上平皿盖,置室温中半小时,取出平皿,用PBS轻洗琼脂表面,用入射式光源显微镜找到菌落,用汞灯观察荧光,以其他霉形体培养物作对照操作,出现特异性荧光的最高稀释度为该荧光抗体效价,使用时用2倍或4倍的效价(即效价前一管或两管的稀释度)。
以直接免疫荧光法正式鉴定霉形体时,选用适当的荧光抗体效价,操作法如上。
2.间接免疫荧光试验 荧光素标记的抗兔球蛋白抗体(标记抗体)与对霉形体的家兔抗血清(未标记抗血清)相结合来鉴定霉形体,本试验也可用于检测抗体。
标记抗体必须对家兔抗血清作棋盘格滴定,以测定其最适工作稀释度。标记抗体的最高稀释度作为盘终点(Plateau end point),与最高稀释度的标记抗体作用产生最强荧光的未标记抗血清的最高稀释度即为盘滴度(Plateau titer)。
试验方法是用含硫柳汞钠万分之一的PBS洗涤琼脂上的菌落,经30min,吸出洗液,加入1.5~2ml二倍盘滴度的抗霉形体的抗血清,置室温中30min,吸去抗血清,用PBS洗2次,每次5ml,加入1.5~2ml二倍盘终点的标记抗体,置室温中30min,吸出标记抗体,再用PBS洗3次,每次5ml,使洗液在菌落上停留30min,最后吸去过多的液体,如直接法同样镜检。