细胞突变体
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第221页(14058字)
(一)抗氨基酸及其衍生物的突变体
从高等植物的体外培养物中分离到的大多数突变体是选择抗氨基酸衍生物或天然存在的氨基酸生长抑制剂。表1l-1总结了已报道的抗氨基酸衍生物和氨基酸的细胞系。已经分离到的大多数突变体或是抗芳香氨基酸衍生物,如5-甲基色氨酸,对氟苯丙氨酸和6-氟色氨酸或赖氨酸和苏氨酸的衍生物,如S-氨乙基半胱氨酸,α-羟基赖氨酸以及赖氨酸和苏氨酸本身。
对于代谢产物的抗性可以从多种机理中的一个或多种发生(见图11-1)。首先是产生过量的天然存在的化合物可能冲稀抗代谢产物的作用。例如,一种氨基酸的过量产生,通常是一种正常受到反馈抑制的酶解调节的结果。Widholm(1972)曾经指出,烟草中对5-甲基色氨酸的抗性,可能起源于色氨酸途径中第一个酶(邻氨基苯甲酸合成酶)对于色氨酸或其衍生物5-甲基色氨酸的反馈抑制的抗性,结果过量产生色氨酸。其次,如果可以有效地把抗代谢产物排斥在细胞外面,即通过影响膜透性的突变,也可以提高抗性。也曾经分离到影响运输的变异细胞系,可以抗多种氨基酸衍生物。第三,化合物也可经降解和解毒。Berlin(1980)曾经指出,对氟苯丙氨酸(PEP)可被苯丙氨酸解氨酶降解。此类突变的几种细胞系可以产生过量的酚类化合物。第四,增加合成次生代谢产物能导致抗其衍生物的突变体。在抗对-氟苯丙氨酸(PEP-res)的细胞系中,苯丙氨酸解氨酶活性提高,结果可以增加合成酚类化合物,如烟草和假挪威槭,或增加合成多酚,如烟草多酚。一种次生代谢产物的过量合成,可能干扰植物的再生。在胡萝卜抗5-甲基色氨酸的细胞系中,IAA合成增加30倍,表现出抑制胚胎发生。
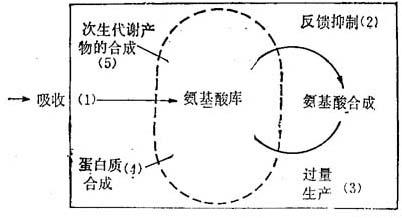
图11-1 抗氨基酸衍生物的机理
(1)减少吸收衍生物(2)一个氨基酸生物合成酶降低对反馈抑制的敏感性,导致天然存在的氨基酸的过量生产(3)(4)过量的氨基酸稀释了衍生物在蛋白质合成中的作用,或(5)导致次生代谢产物的合成增加,也可能是那些可作为次生代谢产物直接前体的氨基酸衍生物的降解方式之一。
只有少数例子中把对于一种氨基酸衍生物或氨基酸的抗性与一种专门的酶相联系。在烟草和胡萝卜对于5-甲基色氨酸的抗性与色氨酸对于邻氨基苯甲酸合成酶的反馈抑制的降低有关。在长春花中邻氨基苯甲酸合成酶活性增加1.5倍,色氨酸合成酶活性提高2倍,证明与对5-甲基色氨酸的抗性成线性关系。至少在一个变异细胞系中,从再生植株得到的愈伤组织中,邻氨基苯甲酸合成酶对于色氨酸反馈抑制的敏感性不及其野生型。然而,从整株植株中分离的邻氨基苯甲酸合成酶,对色氨酸的敏感性与野生类型的酶一样。这就强调了发育问题,即细胞培养物和从细胞再生的植株可表现出不同的同工酶,因而对于抗代谢产物有不同反应。在抗氨基酸衍生物的细胞系中,曾经发现附加酶的活性发生变化。如抗S-氨乙基半胱氨酸的胡萝卜细胞系,天冬氨酸激酶和二羟吡啶羧酸合成酶活性发生变化,和抗赖氨酸和苏氨酸的玉米细胞系的门冬氨酸激酶活性,可抗赖氨酸的反馈抑制。
在所报导的抗氨基酸及其衍生物的细胞系中,有许多是增加了氨基酸库(见表11-1)。这些事例可能具有农业价值。Hibberd等(1980)用赖氨酸加苏氨酸选择高赖氨酸玉米细胞系,玉米是种缺少赖氨酸的植物。Carlson(1973)所分离到的抗蛋氨酸亚砜的烟草,可过量合成蛋氨酸,并提高Q对烟草假单胞菌的抗性(烟草假单胞菌是烟草野火病的病原菌)。抗脯氨酸的大麦突变体,脯氨酸水平增高,可导致提高植物的抗旱性。虽然曾经表明在干旱时脯氨酸会吸引蝗虫,但富含氮的植物,累积脯氨酸的植物并未增加对灾害的敏感性。因此,利用通常对植物细胞有毒的氨基酸衍生物或氨基酸,可以从高等植物中选择有重要经济意义的特性,使其可以抗天然存在的氨基酸及其衍生物。
表11-1 抗氨基酸类似物和氨基酸的细胞株


a.N.R.=未报道。
b.机理的缩写:F=酶抗反馈抑制;S=增加次生代谢产物的合成;A=增加酶的活性;P=增加天然化合物的库;U=改变吸收;C=对各种抗代谢产物的交叉抗性。
尽管分离到的抗5-甲基色氨酸和对-氟苯丙氨酸的细胞系比抗任何其他衍生物的都多,但这些变异体未经遗传分析。确实,在这些类型的变异体中,只有3例能再生植株。然而,从一个抗5-甲基色氨酸细胞系再生植株,对衍生物是敏感的,抗PEP的南洋金花和烟草需在有PEP的条件下再生植株。
对于离体培养所分离到的抗氨基酸或其衍生物的突变体只进行有限的遗传分析,抗甘氨酸羟肟酸盐的特性在烟草中表现出显性孟德尔特性。在烟草中抗旱烟酸肼(甘氨酸转化成丝氨酸的抑制剂)也表现为显性突变。烟草抗缬氨酸的特性或者作为单个的显性等位基因,或者作为拟显性核等位基因方式遗传。玉米抗赖氨酸和苏氨酸是单个显性的核等位基因。Carlson所分离的抗蛋氨酸亚砜的细胞系中,二个是拟显性核突变,一个是二个隐性的核等位基因。因为我们期望用直接的正选择方法分离突变体,因此大多数此类突变是由显性的或拟显性的等位基因决定的。
然而大多数抗氨基酸和衍生物的细胞系是从悬浮培养体、愈伤组织或原生质体分离的。Bright等(1979)为从大麦分离突变体设计了新技术。种子用叠氮化合物处理,播种要让其长至成熟。从收获的种子中分离出胚,培养在没有激素的MS培养基上。此时可以选择其对抗代谢产物抗性。已经分离到抗S-氨乙基半胱氨酸,抗赖氨酸加苏氨酸和抗羟基辅氨酸的植株。对于变异体的这种筛选系统需要植物长大,从而才能对变异体进行遗传分析。隐性(对S-氨乙基半胱氨酸抗性),拟显性(对羟脯氨酸抗性)和显性(对赖氨酸加苏氨酸抗性)突变体都已鉴定到。此外,抗羟脯氨酸的植株产生过量的蛋氨酸、赖氨酸和苏氨酸。这样把常规的和离体培养的技术结合起来,已经分离到对改进作物可能有用的突变体。
(二)抗嘌呤和嘧啶衍生物的细胞突变体
已经报道许多高等植物对嘌呤和嘧啶衍生物的抗性。这类性质的突变在动物细胞中已经得到广泛研究,并用于鉴定体细胞杂种,因此已经开发了它们在高等植物中的应用潜力。只在极其有限的事例中,对抗嘌呤和嘧啶衍生物的突变体进行了生物化学和遗传学的分析。
对溴代脱氧尿苷(BudR,胸苷衍生物)的抗性曾经进行过广泛研究。大豆对于BudR抗性是由于过量合成脱氧胸苷单磷酸的结果。并能抗氟代朊氧尿苷和氨基蝶呤。因为未能从培养的愈伤组织再生大豆植株,不可能进行遗传分析。然而,在烟草中对BudR的抗性是作为显性核基因遗传的,但未报道生化分析。然而发现这种细胞系不是细胞分裂素驯化的。苜蓿也已分离到抗BudR的细胞系。某些这类突变体的胸苷(但不是BudR)可以掺入DNA。抗BudR的突变体也如动物细胞一样,在HAT(次黄嘌呤,氨基喋呤和胸苷)培养基中培养。氨基喋呤抑制硝酸还原酶,因此抑制嘌呤和嘧啶的合成,只有能把外源的次黄嘌呤和胸苷掺入DNA的细胞后(即野生型细胞)才能在HAT培养基中生存。抗嘌呤和嘧呤衍生物的细胞不能掺入外源的次黄嘌呤和胸苷,因此在HAT培养基中死亡。M.sativa的七个抗BudR的细胞系中有五个,和四个抗吖鸟嘌呤细胞系中有二个不能在HAT培养中生长。根据抗衍生物细胞系的互补作用,HAT系统已被广泛地用于动物细胞培养,以选择体细胞杂种,即只有杂种才能把外源的次嘌呤和胸苷掺入DNA,因而活下来。根据M.sativa中所得的结果,HAT选择在高等植物原生质体融合实验中可能也是有用的。
曾经选到了许多抗其他嘌呤和嘧啶衍生物的变异体(表11-2)。Haplopappus gracilis抗8-azaquanine的细胞系次黄嘌呤转磷酸核糖基酶(HPRTase)活性减少30%,而假挪威槭抗8-鸟嘌呤突变体HPRTase的活性降低50%。玉米抗氨基喋呤的二个细胞系是由于增强了二氢叶酸还原酶的活性,但是第三个细胞系,观察到酶对于氨基嘧呤的抗性增强。除了上面所描述的抗BudR系外,只有一个突变体进行过遗传分析。Chaleff(1981)选择了抗羟基脲的烟草细胞系,羟基脲在动物细胞和微生物中抑制核苷酸还原酶。这些突变体的行为象显性的核等位基因。至少在一个例子中,抗羟基脲的等位基因与以前分离到的抗毒莠定的等位基因紧紧联系在一起。确实,大部分的Chaleff氏的抗毒莠定的突变体也是抗羟基脲的,表明对两者的抗性要么是和一个基因有关,或者是对羟基脲的抗体增强了对毒莠定的抗性。毒莠定可能不是诱变剂,因它不能增加啤酒酵母突变作用的回复变异。此外,在许多抗毒莠定的突变体中恢复羟基脲抗性,这表明必然存在某种选择压力。这是视若无关的突变型,同时发生在一个选到的高等植物细胞系中的唯一例子。
表11-2 抗嘌呤和嘧啶衍生物的细胞系
a.N.R.=未报道。
b.机理缩写:F=酶抗反馈抑制;A=增加酶活性;P=增加天然化合物库;C=对其他抗代谢产物的交叉抗性。
(三)抗抗生素的细胞突变体
对于抗抗生素的高等植物细胞系已经进行了比其他在离体分离的高等植物突变体更加广泛的分析,尤其是对由Maliga等(1973,1977)所分离和鉴定的烟草细胞系更是如此。许多抗生素,如链霉素、卡那霉素和氯霉素在原核细胞和真核细胞中,是在翻译机构的物理结构不同的基础上利用的。例如链霉素和卡那霉素作用于原核生物的70S核糖体。70S核糖体只有在真核生物的线粒体和叶绿体中发现。因此,在真核生物中对这些化合物的抗性,可能作为细胞质性状遗传。Maliga等(1973)首次分离到抗链霉素的烟草细胞系。因为链霉素引起从愈伤组织再生的苗失绿,因而抗性细胞系是从再生愈伤组织的绿色区域分离到的。对于抗链霉素突变体SRI已经进行了遗传学和生物学的分析。SRI是作为细胞质基因遗传的,即母性遗传。虽然链霉素会引起敏感细胞中叶绿体和线粒体的物理性异常。但电镜检查表明链霉素对于SRT的这些细胞并无作用。然而这些细胞是可以吸收链霉素的。SRI和链霉素敏感细胞的叶绿体核糖体蛋白质的双相电泳表明,SRI中与从敏感细胞中分离的蛋白有关的一种蛋白质的电泳移动性发生了变化。烟草SRI和奈特氏烟草进行原生质体融合,表明链霉素抗性经叶绿体从前者传至后者,进一步证明这种突变的细胞质基础。此外,细胞质的链霉素抗性通过原生质体融合,而未形成核杂种,就从烟草传给了林烟草中得到了证实。这样,在SRI中一个基因的变化已和叶绿体中的一个蛋白质的变化联系起来了。Umiel等(1978)也分离到一个相似的抗链霉素突变体。这样突变体与SRI一样,也是细胞质遗传的,在链霉素存在的情况下,抗链霉素细胞系的质体是正常的,而在敏感细胞中质体异常。
对链霉素的抗性也可以作为孟德尔性状遗传。从单倍体的林烟草分离到的抗链霉素的细胞系(SR180),是隐性核等位基因遗传。林烟草的第二个抗链霉素细胞系(SR155)是不育的,但不是非整倍体。对这种细胞系的核型分析表明可能是易位。
各种抗菌素间的交叉抗性也是可能的。一种抗卡那霉素的林烟草(KR103)细胞系也抗链霉素和新霉素。然而Maliga的SRI细胞系对卡那霉素是敏感的。Owens(1981)所分离到的抗卡那霉素的烟草细胞系对链霉素抗性比卡那霉素抗性强。这些植物是部分不育的,变化不定的分离资料使得难以作出遗传分析。
曾经试图分离抗放线菌酮的高等植物细胞系。烟草愈伤组织如果在没有放线菌酮的条件下继代培养,会失去抗性。Gresshoff(1979)在胡萝卜也观察到放线菌酮抗性的不稳定性。Sung等(1981)观察到胡萝卜野生型的胚和再生植株对放线菌酮解毒。然而也分离出对放线菌酮抗性稳定的愈伤组织(WCH105)。从WCH105再生绿色植株,但它们不产生正常的多裂叶子。这种抗放线菌酮细胞系用体细胞杂交进行了分析。尽管体细胞杂种的染色体数与预期的相符(2n=3b),但抗放线菌酮细胞和敏感的细胞的杂种细胞系是敏感的,表明放线菌酮抗性是一个隐性特性。对一些别的抗生素,如制霉菌素,Amphotericin B,和氯霉素抗性的报道列于表11-3。
表11-3 抗菌素的抗性

a.抗性机理缩写:D=解毒作用;C=对链霉的交叉抗性;O=过量生产天然化合物;A=叶绿核糖体蛋白改变;P=正常的质体发育。
b.N.R.=未报道。
c.可能是嵌合体。
d.突变不稳定。
e.变化不定的分离比,表明无一定的核遗传控制.
(四)氮代谢突变体
高等植物中氮代谢包括若干步骤。
(1)硝酸盐必须进入细胞,可能由透性酶调节。
(2)硝酸盐经硝酸还原酶作用被还原成亚硝酸盐。
(3)亚硝酸还原酶调节亚硝酸盐转化成氨。
(4)最后,在谷氨酰胺合成酶催化后,氨与谷氨酸合成谷氨酰胺。在体外已经分离到影响开始两步的突变体。
当烟草细胞培养体培养在含有硝酸盐的培养基上,有些氨基酸或氨基酸组合可以通过抑制硝酸盐吸收,从而抑制生长。Heimer和Filner(1970)分离到一种烟草细胞系(XDR-thr),当其生长在硝酸盐上能抗苏氨酸的抑制作用。亲本细胞系除非生长在没有硝酸盐的培养基(如尿素)上,不然对苏氨酸是敏感的。这种细胞系可以抗除苏氨酸以外的其他氨基酸,这些氨基酸在含有硝酸盐的培养基中通常抑制细胞生长,如甘氨酸、亮氨酸、蛋氨酸和缬氨酸。在XD或XDR-thr细胞系水解酪蛋白可抑制诱导硝酸还原酶和亚硝酸还原酶,表明突变没有影响这二种酶。因为在XDR-thr细胞系中苏氨酸并不抑制硝酸盐的吸收,因此XDR-thr突变必然影响硝酸盐吸收的调节。不幸的是对这种细胞系并未进行过遗传分析。
用离体培养分离的突变体广泛地研究过烟草的硝酸还原酶(图11一2)。硝酸还原酶是多亚基的酶,它依赖于NADH而催化硝酸盐还原成亚硝酸盐。此外,FADH2或还原型的苄基Viologtn染料可作为电子供体。这些活性都必须有铜作为辅助因子。如没有辅助因子,这种酶只表现出细胞色素C还原酶的活性。

图11-2 硝酸还原酶活性的遗传基础
(1)在nia等位基因突变,钝化硝酸还原酶脱辅基蛋白
(2)在cn×等位基因突变,钝化硝酸还原酶和黄嘌呤脱氢酶都需要的钼辅助因子
如果没有硝酸还原酶作用,氯酸盐不会转变成有毒的亚氯酸盐,因此,缺少硝酸还原酶的细胞系对氯酸盐有抗性。这种抗性曾被用于从单倍体烟草选择硝酸还原酶缺失的细胞系。9个抗氯酸盐的细胞系中有一个称为cnx,也缺失黄嘌呤脱氢酶。因为硝酸还原酶和黄嘌呤脱氢酶都需钼作为辅助因子,因此认为cnx等位基因是钼辅助因子的,而不是影响硝酸还原酶的脱辅基蛋白。确实烟草cnx系不能在离体与粗壮脉纹孢菌突变体(nit-1)互补恢复硝酸还原酶的活性,而野生型的烟草确实如此。向cnx细胞系加入1-10mM的钼可以部分地恢复其硝酸还原酶活性。cnx细胞系确实具有细胞色素C还原酶的活性,钼辅助因子不依赖于硝酸还原酶的活性。
另一个硝酸还原酶突变体(叫nia)缺少硝酸和细胞色素C还原酶活性,但它们有黄嘌呤脱氢酶活性,表明突变影响脱辅基蛋白。与烟草的cnx细胞系相反,nia细胞系的粗提物可以在体外恢复粗状脉纹孢菌的nit一1突变体的硝酸还原酶活性。进一步证实nia和cnx是作用于硝酸还原酶的不同亚基。例如,cnx和nia细胞系在人工培养下互补,在粗提物中可恢复硝酸还原酶活性,cnx和nia细胞系原生质体融合产生的杂种可在硝酸盐中生长。在活体内可以互补,表明cnx和nia突变是隐性。虽然大多数cnx和nia细胞系不可能再生,但cnx+nia杂种能再生植株。只有渗漏性nia突变体(降低FADH2水平和依赖Viologen染料的硝酸还原酶活性,无依赖NADH的硝酸还原酶的活性)已经再生成植株。
硝酸还原酶缺失的细胞系也从离体培养的另外两种植物中分离到。King和Khanna(1980)在单倍体的南洋金花作为抗氯酸盐的突变体而选到硝酸还原酶突变体。这种细胞系可以吸收硝酸盐,但缺失硝酸还原酶。Murphy和Imbrie(1981)选择到大马士革蔷薇的抗氯酸盐株。这些细胞系中有15%不能在硝酸盐上生长,表明可能缺少硝酸还原酶。其他系看来是通过其他方法获得对氯酸盐的抗性。Strauss等(1981)在筛选Hyoscyamus muticus营养缺陷体时发现依赖水解酪蛋白生存的细胞系。这些突变体以后发现是抗氯酸盐的,在活体内没有硝酸还原酶的活性。
(五)农业上有用的表型
在高等植物的细胞培养中已经选到了各种表型,它们可能在农业上直接应用。例如烟草的蛋氨酸亚砜抗性细胞系提高了对野火病的抗性,玉米的抗赖氨酸加苏氨酸的细胞系在玉米育种上有潜在价值。
在离体培养选择对病原毒素的抗性有希望直接分离到农业上有用的植株。Behnke(1979)分离到抗马铃薯晚疫霉毒素的马铃薯细胞系。从这些细胞系再生的植株及愈伤组织是抗这种毒素的。随后Behnke(1980a)证明抗毒素植株对由马铃薯晚疫霉引起的晚疫病的抗性比其亲本提高25%。没有确定这种抗性的遗传基础,因为马铃薯在商业上是无性繁殖的。
从玉米的抗 H.maydis小种T毒素的细胞系已经再生植株。其中大多数保持了抗性,而且恢复雄性可育。留下13植株是有用的雄性不育株,它不属于cms-T型系。只有对cms-T基因进行修饰才产生对于病原毒素的抗性。这种抗毒素植株的遗传分析表明对病原毒素的抗性和雄性不育都属于细胞质遗传。
离体培养选择耐盐细胞系已有多例报道(见表11-4)。有些报道再生了植株。在烟草中报道了耐盐性的有性传递,但分离比例与预期的不符。从耐盐细胞系再生植株产生的愈伤组织和植株是抗盐的。此外,Kickxia ramosissima可以抗高达120mM的NaCl。表11-4所示,从林烟草、辣椒、苜蓿和水稻也分离到抗盐细胞株。
表11-4 农业上有用的突变体
a.N.R.=未报道。
b.抗性机理缩写:A=2,4-D结合变化。B=选择剂存在情况下再生。C=恢复雄性不育。D=可通过有性生殖传递,但不按预期比例分离。
c.抗性植株。
d.不育的植株。
e.在植株中没有表现。
从林烟草和胡萝卜分离到耐冷的细胞系。虽然从林烟草三个细胞系再生了植株,但耐寒冷的水平较低,这种性状不能通过有性生殖传递。Templeton-Somers等(1981)报道,虽然从胡萝卜分离到耐低温的愈伤组织,但这种特性在胚中没有表现。这一例子强调不是在无组织的愈伤组织中所选到的所有特性都能在有组织的分化植物中表现。
(六)营养缺陷体
高等植物中只分离到很少几种营养缺陷体(表11-5)。从多倍体和非整倍体培养物分离隐性突变体几乎是不可能的。微生物和动物细胞中营养缺陷体有助于阐明生化途径,用作互补作用来选择体细胞杂种及用裸露或用脂质体包起来的DNA转化细胞是无用的。直至在高等植物中有许多营养缺陷突变体可供利用时,这些领域的研究将比动物细胞培养落后许多。
表11-5 营养缺陷突变体
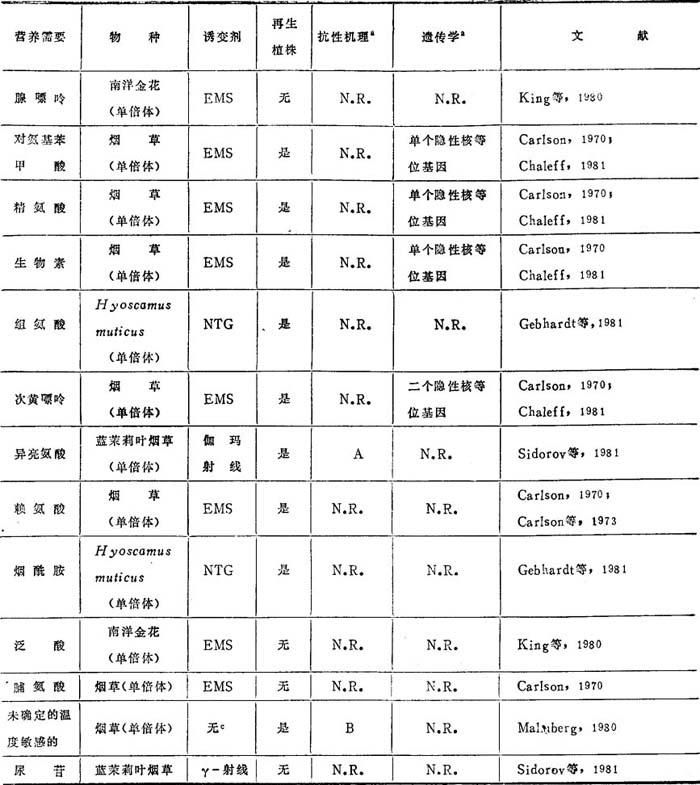
a.N.R.=未报道。
b.机理缩写:A=苏氨酸脱氨酶缺失,B=鸟氨酸脱羧酶,S-腺苷甲硫氨酸脱羧酶和硝酸还原酶活性降低,叶绿素含量降低,增强苯基丙氨酸氨解酶的活性.
c.BudR选择。
与在离体培养分离其他突变体类群不一样,分离程序有两个几乎不变的特征。首先,在每一例子中都用了单倍体。大多数营养缺陷突变体是隐性,在二倍体或较高倍数性的有机体中难以测到。因为植物细胞培养体的染色体数常不稳定。对于单倍体细胞的需求是受限制的,即从单倍体植物材料产生的细胞培养体,在细胞培养中经过短时间就会成为较高倍数体。第二,除了一个例子外,其他都用了物理的(如γ-射线)或化学的(如EMS或NG)诱变剂。在对抗代谢产物的抗性的正选择中,并无必需使用诱变剂,因此无论用与不用诱变剂都能选到突变体。只有烟草分离到的温度敏感突变体(ts),是不用诱变剂获得的。然而,在用BudR富集时,BudR本身就可能是诱变剂。第三,所有突变体都是从茄科植物中分离到的。这可能是由于茄科植物从花药到原生质体易于培养之故。
Carlson(1970)报道了单倍体烟草的第一个营养缺陷体。由于烟草是双二倍体,因此并不奇怪这些突变体是渗漏的,Puck和Kao(1967)设计的用于哺乳动物细胞培养体的一种正选择程序,Carlson(1969)早已成功地用于蕨类以选择营养缺陷体。诱变后,把细胞培养在基础培养基中,因此具有营养缺陷的细胞不能生长。加入胸苷的衍生物溴脱氧尿苷(BudR),把培养物置于黑暗处。BudR只掺入活跃生长细胞的DNA。因为BudR使DNA光敏感,当培养体转至光下时,BudR光解引起生长于最低培养基的细胞DNA广谱受损。营养缺陷的细胞未掺入BudR,因而不是光敏感的。把活下来的细胞转移至完全培养基中,这样突变的细胞会繁殖起来。用这种富集的方法,Carlson(1970)分离到需要生物素、对氨基苯甲酸、精氨酸、次黄嘌呤、赖氨酸和脯氨酸的六种营养缺陷体。除了脯氨酸营养缺陷体外,都成功地再生植株。对这些突变体的遗传分析表明,生物素、对氨基苯甲酸和精氨酸营养缺陷型是由于单个隐性核等位基因的改变,即在F1代显性和隐性以3∶1分离。次黄嘌呤营养缺陷型更加复杂,由于是二个隐性核等位基因突变的结果,即分离比例是9∶6∶1(显性∶杂合∶隐性)。尽管从赖氨酸营养缺陷型也再生植株,加入赖氨酸可以促进生长,但未报道遗传分析结果。第六个营养缺陷体,脯氨酸营养缺陷型,显然没有再生植株或分析。
Malmberg(1979,1980)用同样BudR选择,从单倍体烟草分离到温度敏感(ts)突变体。用其中的一个突变体(ts-4)进行了生化分析。这一突变是多效性的,降低了鸟氨酸脱羧酶,5-腺苷甲硫氨酸脱羧酶,和硝酸还原酶的活性,而提高苯丙氨酸氨解酶的活性。ts-4突变体叶绿素水平也降低。已分离到它的回复突变体,具有正常的鸟氨酸脱羧酶和叶绿素水平。
从南洋金花稳定的单倍体细胞悬浮培养物中已经分离到二个营养缺陷体。没有使用选择方案。筛选大量细胞的营养需要。一个突变体需要泛酸,而另一个需要腺嘌呤。前者在野生型再生植株的条件下不能再生植株。野生型细胞不能交叉饲喂二种营养缺陷型的营养需要,这是设计新的选择方案的主要原因。对这种细胞系没有报道其遗传和生化分析的结果。
从单倍体的Hyoscyamus muticus原生质体已经分离到几种营养缺陷体。如同对南洋金花一样,未能对营养缺陷体的富集方法,但分析了大量愈伤组织的营养需要。组氨酸、烟酰胺和一种没有鉴定的温度敏感的营养缺陷体已经再生植株,但尚未加分析。一个色氨酸营养缺陷体未能再生植株。在筛选营养缺陷体时分离到一种硝酸还原酶突变体,其生长需要水解酪蛋白。
从用伽玛射线照射的单倍体蓝茉莉叶烟草叶肉原生质体分离到两种营养缺陷体。如同南洋金花和H.muticus一样,未用富集程序。一个细胞系缺失苏氨酸脱氨酶,这是异亮氨酸生物合成途径中的第一个酶。从异亮氨酸营养缺陷体已再生植株,但遗传分析尚未报道。尿嘧啶营养缺陷体也已分离到,但尚未进行分析和再生植株。
(七)其他细胞突变体
用离体培养方法已分离到许多其他突变体(表11-6)。这些表型涉及碳水化合物代谢,生长调节剂和其他。其中只有一种进行过遗传鉴定。Chaleff和Parsons(1978)报道烟草的一个细胞系(Gut)可以利用甘油作碳源。初步遗传分析表明突变是显性的核等位基因。由于Gut表型不能在再生植株上表达,后代的分析需从每棵幼苗发生愈伤组织。Gut突变可能按2∶1而不是3∶1比率遗传,而3∶1是显性突变所期望的。但是如果Gut/Gut是致死的,那么可预期为2∶1比率。Gut/+自交所得的种子萌发率低于Gut/+×+/+回交的种子,表明Gut/Gut可能是致死的。为建立这种突变的遗传基础,尚需进一步遗传分析。
表11-6 其他突变体

a.N.R.=未报道。
b.机理缩写:A=生长素合成调节。B=碱性磷酸酯酶分泌器或β-葡萄糖苷酶分泌器。
c.纯合子显性致死。
d.在没有选择条件时稳定。
从各种其它细胞系曾再生植株。抗2,4-D的牛角花植株比其亲本细胞系更抗2,4-D,但抗性还不及一些已有品种。Polacco和Polacco(1977)从烟草抗杀霉菌剂的细胞系(Car1),在有Carboxin的条件下再生植株。虽然Carboxin抑制烟草线粒体中琥珀酸脱氢酶,在Car-1中这种酶对Carboxin同样是敏感的。所分离到的其他细胞系列于表11-6,尚未进行过详细鉴定。
【参考文献】:
〔1〕Chaleff,R.S.1981 Genetics of higher plants.Application of cell culture.Cambridge Univ.Press,Cambridge.
〔2〕Handro,W.1981 Mutagenesis and in vitro selection.In:Plant Tissue Culture.Methods and Applications in Agriculture(T.A.Thorpe,ed.)pp.155-180.Academic Press,New York.
〔3〕Maliga,P.1980 Isolation,characterization and utilization of mutant cell lines in higher plants.In:International Review of Cytology,Suppl.11A,Perspectives in Plant Cell and Tissue Cuiture(I.K.Vasil,ed.)pp.225-251,Academic Press,New York.
〔4〕Sala,F.,Parisi,B.,Cella,R.,and Ciferri,O.(eds.)1980 Plant Cell Cultures:Results and Perspectives,pp.107-187.Elsevier/NorthHoland Biomedical Press,Amsterdam.
〔5〕Chu,I.1982 The use of tissue culture for brceding of herbicide tolerant varieties.In:Potentials of Cell and Tissue Culture Techniques in the Improvement of Cereals.International Rice Research Institute,Philippines, and The Chinese Academy of Science.
〔6〕Mer edith,C.P.and Carlson,P.S.1982 Herbicide resistance in plant cell culture.In:Herbicide Resistance(H.LeBaron and J.Gressel,eds.)pp.275-291.John Wiley and Sons,New York.
〔7〕Dix,P.J.1980 Environmental Stress resistance,Selection and plant cell cultures.In:Plant Cell Culttires:Results and Perspectives(F.Sala,B.Parisi,R.Cella,and O.Ciferri,eds.)pp.183-186.Elsevier/north-Holland Biomedical Press,Amsterdam,New York,and Oxford.
〔8〕Tal,M.,Heiken,H.,and Dehan,K.1978 Salt tolerance in the wild relatives of the Cultivated tomato,Z.Pflanzenphysiol.86:231-240.
〔9〕Levitt,J.1980 Responses of Plants to Environmental Stress,2nd ed.Acade mic Press,New York.
〔10〕Yamada,Y.,Sato,F.,and Hagimori,M.1979 Photoauto trophism in green cultured cells.In:Frontiers of Plant Tissue Culture(T.A.Thorp e.ed.)pp.453-462.IAPTC.Calgary.
〔11〕Yasuda,T.,Hashimoto,T.,Sato,F.,and Yamada,Y.1980.An efficient method of selecting photoautotrophic cell from cultured heterogeneous cell.Plant Cell Physiol.21:929-932.