芹菜
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第497页(14462字)
伞形科芹菜(Apium graveolens L.)很可能起源于欧洲西南部沼泽和河床,和小亚细亚可能到埃及的地中海沿岸。约3000年前希腊人最先利用为药物和香料。1700年前不久,开始芹菜驯化成可食的蔬菜。目前栽培的有三类园艺型:var.dulee(Mill.)Pers.(芹菜),var.rapaceum(Mill.)Gared.Beaup.(根芹菜)和var.secalinum(Mill.)。都是二年生莲座丛状蔬菜。芹菜驯化始于欧洲西部和中国。西欧芹菜是白色或黄叶柄。1930年前北美广泛种植。后因Fusarum yellows病严重危害,发现了远东栽培品种,叶柄绿色,选系,它是美国和加拿大的优势品种。
芹菜是典型二倍体(2n=2x=22)。染色体相对大,着丝粒清晰。核型组成是7长、2短其近端着丝粒的,1中间着丝粒的和1端着丝粒的,无明显随体。芹菜营养期约150-200天(种子播种)。生长适温20-22℃,宜温暖潮湿环境,需肥多,缺钙、硼、镁,表现黑心(钙)、棕色Checking(硼)和黄叶(镁)。主要病害是黄萎病和晚疫病,都是简单显性孟氏遗传。育种主要目标:早熟、稳定高产、一致性、适应性广泛,市场园艺型。
(一)研究进展
1.愈伤组织启动 最常用次氯酸钙或钠溶液(1-10%)加表面活化剂进行组织表面消毒,用无菌洗几次。Browers(1981)报道用各种消毒处理:1-5%次氯酸钙,加或不加表面活化剂,90%乙醇和用或不用恒速振动。采用的外植体有主根,茎尖、叶柄切段,和叶盘。最适消毒方法是2-5%次氯酸钙加表面活化剂连续振动20min。
芹菜的最适组织和细胞培养程序的反应方式与胡萝卜同。Chen(1976)和Williams与Collins(1976)首次用芹菜培养和再生成功。除最近原生质体分离与培养有所进展外,这些技术的改进不大。
由于各实验室所用外植体类型不同如栽培品种,植株发育时期,外植体组织,甚至同一实验室进行时间不同,关于启动愈伤组织的最适技术不能得出结论。Reinert等(1966)首先报道芹菜启动愈伤组织,采用MS基础培养基,White维生素,0.06M蔗糖和0.23μM2,4-D。Williams与Collins(1976)指出效果不好。Chen(1976)用芹菜cv.Florimart幼叶柄切段培养在MS基础培养基加5.4μM NAA和0.47μM KIN,3周后产生愈伤组织。并注意到2,4-D与KIN配合最适于启动快速增殖中的“未分化愈伤组织”,但担心不会再生。Williams与Collin(1976)也用幼叶柄外植体,但供试栽培品种是Latham Blanching,所用愈伤组织启动培养基除用2.3μM 2,4-D,NAA与KIN用2.8μM。如果不加细胞分裂素,生长率较低,不再生根。还注意到原初愈伤组织经连续继代后,的确存在未分化薄壁细胞和胚状体的混合体。Kandeal等(1981)用根芹菜品种Frigga叶柄切段观察到同样结果。
Rappaport等(1980)发现芹菜cv.Tall Utah52-70 R老叶柄基部的休眠侧芽是优势外植体。他们用9.1μM 2,4-D和4.4μM BA启动愈伤组织。Fiji(1982)用同一栽培品种与外植体培养结果,指出BA对启动愈伤组织效果比KIN和ZEA更好,9.1μM 2,4-D比2.3μM为好。Orton(未发表)组织解剖观察指出只有未分化组织,无体细胞胚胎发生。Browers(1981)用芹菜cv.Tendercrisp与根芹菜品种PI 169001,PI 171500和PI 177266(全是希腊品种),发现MS加广大范围的生长素(2,4-D)与细胞分裂素(KIN和BA)的混合液,促进了叶与叶柄外植体的愈伤组织启动。最适水平是6.8μM 2,4-D和2.8μM KIN。栽培品种和叶柄外植体并不是一致地比叶更好。
关于启动愈伤组织物理环境研究较少。Chen(1976)用暗培,25℃。Williams与Collin(1976)26℃,12h光暗周期。Rappaport等(1980)与Fiji(1982)25℃连续光照。这与芹菜生长最适温度20℃不一致。作者提出连续光照比暗培促进旺盛生长的愈伤组织更快启动和频率较高。
曾从广大范围基因型和植株年龄启动了愈伤组织,似乎这些因子对芹菜培养成功无显着差别。常用幼或休眠组织,来知成熟组织能否代用。从叶柄切段、叶切段和休眠芽组织不同外植体,同样启动成功。愈伤组织启动的最适培养基是MS+2.3-9.1μM 2,4-D和2.3μMKIN。当用不同栽培品种或外植体时,BA可能比KIN更有效。当降低2,4-D浓度时,与有无未分化组织同时观察到胚形成,不用细胞分裂素时尤其如此。就长期培养体保持遗传典型性和再生能力而言,保持未分化的与部分分化组织连续混合体状态或是有益的(即降低2,4-D与细胞分裂素水平)。
2.保持愈伤组织和悬浮体 Williams与Collin(1976)采用简单系列转移技术和用与启动愈伤组织的相同培养基和物理条件,以保持愈伤组织。Fiji(1982)用9.1μM 2,4-D启动愈伤组织,发现系列转移的愈伤组织生长率,以生长素浓度较低0.45-2.3μM 2,4-D较高.他进一步指出4.4μM BA虽最适于愈伤组织启动,对愈伤组织继续生长有毒害。用MS+2.3μM 2,4-D启动的愈伤组织,其最适生长率的KIN用量是0.47μM。
Williams与Collin(1976)首次报道芹菜细胞在液体悬浮培养物中繁殖成功。他们将已建成的愈伤组织移入在与启动用的相同成分的培养液50ml,装在250ml锥形瓶中,放在旋转振荡器上100rpm。3周后,产生了胚、未分化细胞团和单细胞混合体组成的悬浮物。Rap-paport等(1980)采用同样程序,以1.1μM BA代替KIN改进的培养基。培养物放在旋转振荡器上80rpm,连续光照,25℃。每5天细胞体积加倍,全是单个或集团的未分化细胞所组成的培养物。
3.再生 Williams与Collin(1976)在愈伤组织启动和保持过程中,看到自发体细胞胚胎发生。并在叶柄外植体的愈伤组织上有根形成,提出在某些情况下,也可能产生经器官建成的植株再生。在加2,4-D与KIN培养基上产生体细胞胚,继续分化到能以区别胚胎发生的芽与根的时期。生长素与细胞分裂素之比是启动体细胞胚的关键。逐步增高KIN浓度促进胚胎发生,2,4-D有明显抑制性。2,4-D超过9.0μM,最初只形成球形胚,2周后未见胚形成。在高2,4-D中10周后,再生潜势永远失去。在多数培养体中,自发胚胎发生保持2年以上,显然由于对KIN反应不同,少数培养体似乎失去了这种能力。
当愈伤组织分散在振动的液体培养基中时,存在着自发胚胎发生与未分化生长,似乎较幼体细胞胚占优势。不加2,4-D与KIN时,看到胚的进一步发育。将矿质营养浓度降低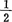 ,促进了继续生长和发育,形成缠在一起的再生植株密集体。
,促进了继续生长和发育,形成缠在一起的再生植株密集体。
Chen(1976)指出用5.4μM NAA和0.47μM KIN启动的愈伤组织,出现再生的某些标志,而用4.5μM 2,4-D和4.7μM KIN启动的,仍未分化。将这二类愈伤组织转移到0.54μMNAA和13.9μM KIN培养基上,能诱导发生胚胎发生。可是,在加2,4-D的培养基系列繁殖的愈伤组织,8个月内胚胎发生减少。将胚植板在无荷尔蒙培养基上,胚的发育超过球形时期。
中国芹菜叶柄外植体接种在MS+2.3μM 2,4-D,在其表面直接出现球形胚,同时产生未分化愈伤组织生长,但未能继续发育。当用2.8μM KIN代替2,4-D时,观察到鱼雷期胚。继而植出体细胞胚胎发生是在外植体切面上靠近维管束的皮层细胞产生的。
Rappaport等(1980)和Fiji(1982)报道了芹菜cv.Tall Utah 52-70 R愈伤组织和细胞悬浮体内植株再生的表型学。在不加2,4-D培养基中,未分化愈伤组织迅速产生再生植株。在MS+2.3μM KIN上发育正常,再生植株能直接移栽 石,放置温室。液体悬浮体里的细胞和组织或直接或植板在固化培养基上能以再生植株。当将培养体保持在只加1.1μMKIN的MS上,观察到非同步的胚胎发生。4周后,产生了未分化细胞和组织、各种时期的胚,和幼绿色再生植株的混合体。将1.5m1培养体移至固化MS不加荷尔蒙的表面,也取得再生植株。
石,放置温室。液体悬浮体里的细胞和组织或直接或植板在固化培养基上能以再生植株。当将培养体保持在只加1.1μMKIN的MS上,观察到非同步的胚胎发生。4周后,产生了未分化细胞和组织、各种时期的胚,和幼绿色再生植株的混合体。将1.5m1培养体移至固化MS不加荷尔蒙的表面,也取得再生植株。
Rappaport等(1980)的悬浮培养体,经直接计数涂沫制片测定,含有细胞和细胞团达105细胞。经试验测定体细胞胚发源的细胞团大小级别。小细胞团和单细胞虽观察到一些再生,至今以最大细胞团的再生频率最高。
这些独立报道,所用方法和种质虽未必相同,结果明显一致。在2.3μM 2,4-D上启动愈伤组织,同时产生着自发体细胞胚胎发生。经用相同培养基系列转移后,混合培养体仍能保持,但除去2,4-D后,则以胚胎发生占优势。用2,4-D浓度大于4.5μM启动愈伤组织,未见同时存在体细胞胚,即使以后把愈伤组织转移到2.3μM2,4-D中。可是,完全除去生长素,能诱导产生胚胎发生。细胞分裂素类型和用量对体细胞胚胎发生无显着效果。图解如图21-1。
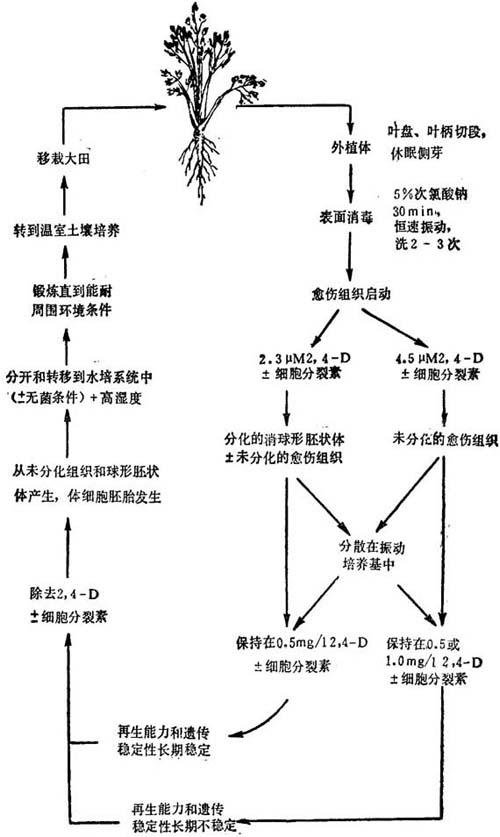
图21-1 用离体培养再生芹菜程序的示意图
与伞形科其它种相似(例如胡萝卜、欧芹),A.gravevlens对外源诱导发育改变的反应是可预见快速和高频率的。再者,基因型对人工培养和再生改进性的影响不明显。由此可知,芹菜正在探索成为典范种,将离体培养技术学应用于基础生物学、作物改良和大田生产,并不奇怪。
4.单倍体 任何伞形科未报道过单倍体愈伤组织或完整植株分离成功。这是由于花小,极难取得配子体。选择孤性生殖植株或异种间杂交后染色体丢失取得芹菜单倍体植株的过程尚待研究。人工培养下偶见单倍体染色体数的细胞,但是否是真单倍体尚不可知。需要加强努力研究。
(二)芹菜细胞培养的应用
1.体细胞胚胎发生基础研究 芹菜悬浮培养物曾用作外源化合物对形态建成和其相关联的生化变化影响的探针。芹菜体细胞胚胎发生过程与胡萝卜的极为相似。可是,Williams与Collin(1976)指出过芹菜对荷尔蒙反应不同,并有保持胚胎发生潜势倾向的时期比胡萝卜的更长。
Al-Abta与Collin(1978)的观察,提出在总发育的可比较诸阶段,体细胞胚的内在分化比合子胚的为少。已发现从细胞决定到球形胚时期的早期发育,有赖于外界培养基中的2,4-D和KIN。可是,球形期后的发育,发现受外加生长素或细胞分裂素的抑制。
Zee等(1979)用芹菜叶柄外植体培养在2.3μM 2,4-D上,观察到球形期前的三种不同早期形态状态:(a)停滞期(0-4天);(b)围着维管束的皮层细胞增殖,和形成分生组织层(4-10天),和(c)分生组织层产生原胚。与Al-Abta与Collin的结果不同,Zee与Wu(1979)报道了除去生长素加2.8μM KIN,可诱导球形胚进一步发育。鱼雷期胚的组织解剖观察,提出了随后极性的发生,是不同淀粉分布结果。Zee与Wu(1980)培养叶外植体观察到相似形态状态顺序。初步比较试验指出,在形成原胚产生的组织到鱼雷期胚的全部阶段期间存在着诸蛋白质间的质与量的差异。
2.离体培养下遗传不稳定性 研究培养的真核生物细胞中自发遗传变异性现象颇有价值。已取得的论据有:再生植株中出现新遗传特性(合与不合需要的)和失去胚胎发生或形态建成潜势。重要的中心问题是:(a)与出现自发遗传变异性的遗传的和生理学因子是什么?和(b)关于遗传稳定性,分化与未分化组织间明显差异的源由是什么?愈伤组织和细胞培养出现很少或无外表变异;因此染色体数与结构的变化曾是信息的主要来源。曾用Haplopappus gracilis和Crepis cappilaris进行了广泛研究,它们的染色体数少和明确结构。但在离体培养下难得再生植株。烟草培养虽易,但它是异源多倍体,染色体结构难于辨认;胡萝卜极难进行细胞遗传研究。比较而言,芹菜有许多优点适于此项研究;二倍体(2n=22),大而明确规定染色体,易于进行离体培养。遗传研究较深入。它的体细胞组织标准核型已叙述如前。少数情况下,报道过染色体数减少,显然是Robertsonian融合的结果。
Williams与Collin(1976)比较观察芹菜品种Lathom Blanching种子繁殖植株与9和15月龄愈伤组织培养体的再生植株的形态学状态和细胞学。三类植株间的生长率和叶柄结构相似,未见明显表型变异体。近于68%再生植株2n=22,27%2n=18,其余2n=42和44。种子繁殖植株只测定4株,其中有一株是2n=18(其余是2n=22)。合理结论是这个栽培品种活体中常见染色体数减少,很少或无严重表型改变。再者,2n=18再生植株不过是正常活体现象,显然是暂时性的,并限于体细胞组织。种子繁殖植株染色体数测定受数量限制,不是以肯定在再生植株中观察的4-5%多倍体性的来源。这些培养物的遗传稳定性或由于培养的细胞的永远组织化,成为球形胚结构。
四种芹菜种质材料(品种.Tenderscrisp,PI169001,PI171500和PI169001×品种Tall Utah52-70RF1)间离体培养下染色体数比较研究,Browers与Orton(1982)发现表型间的可重现的显着差异。PI169001培养的细胞近于2n=22,其余大都是非整倍体,2n=23-43。反之,品种Tendercrisp愈伤组织细胞只有45%是2n=22。在另一试验中,PI171500表现更不稳定。同一种质的不同植株间已测出差异,但同一植株(例如不同外植体)产生的培养体间从未见到。可是研究指出随着培养时期增长核型构成会有改变。得出结论基因型和培养物年龄是出现和保持核型变异体细胞的主要因素,而外植体组织间的生理学差异和随机漂迁是不显着的。
最近,Murata(1982)应用动物培养技术于植物原生质体培养取得成功。由此产生很好分散的中期染色体,形态保持极好。Murata与Orton(1982)成功地运用这种技术,研究培养的芹菜细胞的染色体结构改变。并应用于区分染色和与克隆的探针顺序就位杂交。
研究染色体结构改变的供试材料是PI169001×Ta1l Utah 52-70 R1,根芹菜×芹菜F1杂种,启动(愈伤组织)后保持在液体悬浮体里21个月。观察到相伴发生的形态学上“正常”染色体丢失平均每细胞2.40和发现结构上改变的染色体平均每细胞1.35。再者,形态学上正常染色体丢失就其类型(例如具近端着丝点的,端着丝点的等等)而言,不是随机发生的。在设想是正二倍体2n=22细胞中,56%出现明显染色体片段丢失,其余44条都至少有一种结构改变(与当地核型相比)。
许多潜在遗传变异体,在分析染色体数、结构或DNA含量方法未能检测。由于培养的细胞和组织,不出现形态变异,供遗传分析,将有必要采用直接鉴定DNA顺序和基因产物,以检测由于突变、重组合和插入等等而产生的变异。研究这种问题的一种方法,是利用已造成的芹菜具有许多已知位点的异质体,在相应培养的组织和再生植株中,鉴定表型变化。在离体培养下,能看到这些表型如同功酶谱。4位点,包括Pgm-2和Sdh-1,异质植株单细胞无性系培养物中,100单细胞无性系中有22个丢失了速移Pgm-2电形态,而异质表型常能保留Sdh-1。在造成这种现象中的全部可能致因中,就它性质言,有力提出插入顺序发生作用。可是当用Pgm-2FS和Pgm-2S克隆为相对核型时,背景差异过大,难得出有效结论。
人工培养产生的染色体变异体细胞也传递给再生植株。PI 169001悬浮培养体有80%是二倍体和20%非整倍体或多倍体细胞,其再生植株根尖细胞85%二倍体和15%亚二倍体;未见超过2n=22的非整倍体或多倍体。核型分析指出再生植株中的低二倍体细胞是真正非整倍体,无一与PI169001活体相当的任何核型。再者,只在植株内混合体中观察到低二倍体细胞,从未看到纯净局部或整个植株是如此的,提出或是来源于多细胞的胚,或自发变异性,这是发育期间能以发生的。这些观察与Williams与Collin(1976)结果多少不一致。他们观察到的多倍体性和低二倍体性(但与二倍体性不同)和二倍体性,但常发生于植株间而非植株内。这些报道间的差异,可能由于用于计数染色体的再生植株发育时期所致:Williams与Collin(1976)采用2月龄植株新生侧根,而Browers与Orton(1982)用的是很幼年再生植株的初生根。
离体培养条件下产生的染色体变异性程度(不同基因型间,如前所述的)似乎与芹菜再生植株能力成负相关。PI171500启动愈伤组织后,非整倍体和多倍体很快占优势,却难于诱导胚胎发生。上述PI162001×Tall Utah52-70 R的悬浮培养物用于研究人工培养核型,当这种试验结束时,只出现反常有组织生长。
PI169001×Tall Utah 52-70 R(原来是Pgm-2FS)培养物中不见Pgm-2F电形态表达,也似与再生完整植株能力降低相关联。当用集团转移愈伤组织培养体时,把已知由Pgm-2FS和Pgm-2S组织的混合体转移到无2,4-D培养基上,再生植株中只出现Pgm-2FS表型。Pgm-2S表型亚系只是零星再生,但这些再生植株保持变异体Pgm-2表型。培育Pgm-2S再生植株到开花状态,迄未获成功。直到鱼雷期后,胚明显正常,但在子叶期表现某些反常形态。与子叶相当的结构相互融合,再生植株茎顶表面产生大量不定球形胚;未见明显茎尖分生组织。继而,再生植株变成失绿的,根停止生长,而不定胚继续发育。这种培养体,在无荷尔蒙培养基上,保持这种状态,达7个月以上。这种“反常发育综合症”不限于Pgm-2S表型的愈伤组织培养体,Pgm-2FS培养体也有。正在采用分子生物学手段进一步研究,期望详细了解相应遗传损害,更具结论性。
芹菜可能提供有宽广生物学重要性的技术和基础信息,例如胚胎发生遗传学和活体体细胞组织自发遗传变异性的机理和影响。
3.交替植物育种方法 芹菜易诱导形成愈伤组织和体细胞胚胎发生,又是重要作物种,提出了许多方面应用于植物改良。最活跃领域之一是除莠剂抗性。由于这种植物的叶是供人们食用的,除莠剂的选择施用是严格的而成本高。合理的代替方法是利用离体培养以选择广谱,抗除莠剂的细胞(和植株),要求对人们操作的毒性低,和生物降解较快。Metcalf与Collin(1978)发现西玛津(5.0-50.0μM)抑制芹菜悬浮培养中细胞分裂和扩散。认为它是呼吸解偶联剂。提出离体培养选择西玛津抗性植株,有理论上可能性,但尚未见报道。除莠剂Asulam对分化和未分组织有相似毒效。从芹菜悬浮培养物中选得了稳定自发Asulam抗性(8×10-5M)变异体,但选出的无性系未能再生。用EMS诱变大大地增高从芹菜悬浮培养物选出Glyphosate(Roundup)抗性无性系(达0.1-1.0mg/l)。现在这些变异体表现某些再生迹象。
此外,抗病性和香味改良育种。Rappaport(1980,1981)有力论断黄萎病原菌含有毒性化合物。用亲溶菌的乙醇提取病斑的溶出液10%,能完全抑制cv.Tall Utah 52-70 R(感染这种病原菌的侵害)悬浮培养体生长,而PI169001(抗性)只受部分抑制。再者,这种提取液和病原菌激起离体叶柄和发芽中种子的相似反应,更证明提出液毒物来自这种病原菌。选出了和再生了抗10%提出液抗性cv.Tall Utah52-70 R无性系,但其再生植株的抗、耐性未见加强。正在进行这些提出液的毒物组成提纯和测定与致病性关系。
芹菜“分化愈伤组织”中发现了主要香料化合物Phthallide衍生物(即有球形胚的),但未分化愈伤组织则无。再者,完整植株和分化愈伤组织的Phthallide成分质和量都相似。由此有可能采用色层分析和质谱分析以筛选分化愈伤组织体细胞克隆,以改变Phthallide成分,最后选出味料增高的遗传变异体。
利用原生质体(例如体细胞杂种,胞质杂种,通过吸收转化)的遗传修饰研究很少。Tseng等(1975)用叶肉为供试材料,首次分离芹菜原生质体成功。最近采用胡萝卜的成功技术,从悬浮培养物分离和培养原生质体(表21-4)。用荧光增白剂证示分离后2-4天内沉积在分离的原生质体上的细胞壁。Pullman博士改进了这种培养程序,改用10%MS基础盐类(不加NH4NO3),0.3M山梨糖醇+0.075M蔗糖作为原生质体分离培养基的渗透剂。将细胞块植板在无荷尔蒙培养基上后,再生植株成功。
表21-4 从芹菜悬浮培养物分离和培养原生质体方法

4.供大田生产用的无性系 体细胞胚再生植株移植大田的可能性,引起这种设想离体培养将能用于产生比现有技术可达到的更优越作物。例如,种子长成的和人工培养产生的值株移栽过程如图21-2其主要限制是:(a)芹菜(和根芹菜)种子发芽慢、多变和不完全,和(b)每单元遗传状态与大田生产价值不稳定,这是由于大田种植的遗传性不同群体自由授粉的结果。相反,离体培养细胞无性系,提供克服这些限制的可能性。因为芹菜易于从愈伤组织和悬浮培养物中诱导产生胚胎发生过程,结果产生大小和形状不一的胚,将有可能用工程方法在批量培养体中产生同步发育的体细胞胚的一致悬浮物。用选择优越植株做外植体供体,可能是优越自交亲本的F1杂种,以克服遗传性限制。采用体细胞胚或克隆移栽体,避免产生遗传性完全一致带来的潜在问题(例如脆弱性)。取得成功的主要因子:(a)外植体供体的基因型,(b)批量保持费用,包括遗传纯度,(c)建立产生同步体细胞胚(关于收获时的一致性)的有效方法,和(d)产生使同步胚长成移栽植株的有效方法,它们有经受严酷环境和生态压力能力。

图21-2 芹菜种子与人工培养产生植株移栽大田程序比较
离体培养细胞无性系技术还可应用于杂种芹菜种子生产。常用遗传雄性不育生产杂种种子,但雌亲本系难于繁殖。可用自交或姊妹株授粉繁殖亲本系,但有自交衰退问题(芹菜)。理想方法可将雄性不育和可育纯系(杂种品种的雌和雄亲本)保存在液氮中,以保证遗传纯度,备用。
Chen(1976)和Williams与Collin(1976)决定了人工培养启动、繁殖和再生芹菜的基本操作。Chen(1976)证实了采用这种技术有产生锻炼的植株可能性。Williams与Collin(1976)提出了某些可能的改进,注意到夭亡率比胡萝卜的低得多。这种方案产生高遗传真实性,如染色体数和植株经济特性。
Rappaport(1980)与Fujii(1982)提出已有程序的某些改进,以提高绿Utah芹菜克隆化效率。营养成熟植株的休眠侧芽是优势外植株,与前人采用幼叶柄相反。再者,他们发现用高水平2,4-D(9.0μM)与BA代替KIN,有利于愈伤组织启动。温室群体出现的不正常形态,经移植大田常会消失。营养生长后期常出现变异,在温室里常不出现。不同地区和时间在加利福尼亚海岸三次种植结果,65-70%植株长到成熟(可上市场出售),30-35%出现不需要状态,如未熟开花、矮生、非正常色,和多茎。正在测定其遗传构成。
Williams与Collin(1976),Rappaport(1980)和Fujii(1982)报道的方法间的精确性明显差异,可能由于用作启动愈伤组织的2,4-D浓度所致。前者用2.3μM,产生未分化愈伤组织与球形胚的永久性混合体,而后者用9.1μM,只产生未分化愈伤组织,即使转移和保持在2.3μM 2,4-D上也如此。Chen(1976)和A1-Abta与Collin(1978)观察到逐步培养在2,4-D浓度超过4.5μM的芹菜培养体,产生相应的胚胎发生潜力的消失。有的潜在胚胎发生与核型反常有密切相关,Fujii(1982)报道的变异,可能是启动早期产生的变异,并在保存期间保留。另一这样后果,可能是他们的培养物,当经系列继代或培养在2.3μM2,4-D上,逐步失去胚胎发生潜势。
(三)展望
芹菜培养物大都易于再生,唯一例外是老培养物或高浓度2,4-D培养的,某些栽培品种的培养物(例如PI171500),以及原生质体培养物。因为大多数芹菜培养物遗传性相对稳定,和能长期保持胚胎发生潜势,它对研究胚胎发生期间分子事项具有卓越潜势。将有趣地看到已建立的胡萝卜体细胞胚胎发生现象能否扩大应用于芹菜。经找出许多属的胚胎发生过程中诸事项的相似性,将能阔步进入了解决定和继后发育。
就芹菜而言,人工培养克隆应用于大田移栽生产条件业已成熟。遗留问题是体细胞胚的同步发育,和掌握和锻炼过程。由于有潜在应用价值的组织培养技术是高等学府研究产生的,它已达到基础与应用生物学间界面上的死角。芹菜将可望架起其间桥梁。
【参考文献】:
〔1〕Dunstan,D.I.and K.C.Short 1977 Improved growth of tiSsue cultures of the oniun,Allium cepa.Physiol.Plant,41:70-72.
〔2〕Havra′nek,P.and F.J.Novak 1973 The bud formation in the callus caltures of Allium sativum L.Z.Pflangenphysiol.68∶308-318.
〔3〕Hussey,G.and A.Falavigna 1980 Origin and Productiom of invitro adventitious shoots in the Onion,Allium cepa L.J.Exp.Bot.31∶1675-1686.
〔4〕Jones,H.A.and L.K.Mann 1963 Onions and their allo′es-Botany,Caltivation and Utilization,Leonard Hill,London Interscience,New York.
〔5〕Koul,A.K.,R.N.Gohil and A.Langer 1979 Prospects of breeding improved garlic in the light of its genetics and breeding systems.Euphytica 28∶457-464.
〔6〕Novak F.J.1980 Phenotype and cytological status of plants regenerated from cellus Cultures of Allium sativum L.Z.Pflanzenzueht.84∶250-260.
——1981 Chromosomal characteristics of long-term callus cultures of Allium sativum L.Cytologia 46∶371-379.
——,L.Hayel and J.Dolezel 1982 In vitro breeding system of Allium.In∶Plant Tissue Culture 1982(A.Fujiwara,ed.)pp767-768,manuzen,Tokyo.
〔7〕Clare,M.V.1974 The production of plantlets from tissue culture of brussel sprout(Brassiea oleracea var.Gemmifera D.C.)Atnn.Bot.38∶1067-1076.
〔8〕Gatenby,A.A.and E.C.Cocking 1977 Callus formation from protoplasts of marrow stem kale.plant Sci Letter 8∶275-280.
〔9〕Grout,B.W.W.and P.Crisp 1977 Pratical aspects of the propagation of cauliflower by meristem culture.Acta Hortic.72∶289-296.
〔10〕Johnson,B.B.1978 In vitro propagation of braecoli from stem,leaf and leaf rib explants Hortscience 13∶246-247.
〔11〕keller,W.A.1978 High frequency production of microspore derived plants from Brassica napus anther cultures.Z.Pflaryenzüecht.80∶100-108.
〔12〕Xu,Z.H.,M.R.Dowey and E.C.Cocking 1982 Plant regeneration from root protoplasts of Brassica.Plent Sci.Lett.24∶117-121.
〔13〕Zee,S.Y.,S.C.Wu,and L.H.Hui 1980 Rosearch on tissue calture explant morphogenesis and the enhancement effect of some chinese drugs on explants a summary report.Acta Physiol.sinica 6∶419-423.
〔14〕Al-Abta,S.and H.A.Collin 1978 Control of embryoid development in tissue ualture of eelery Ann.Bot.42∶773-782.
〔15〕Merrick,M,M.A.and H.A.Collin 1980 Selection for asulam resistance in tissue cultures of celery,Apium graveolens L.var.Dulce cv.New Dwarf White PIant Sci.Lett.20∶291-296.
〔16〕Sims,W.L.,J.E.Welch,and V.E.Rubatzky 1977 Celery production in California.Leaflet 2673,Cooperative Extension,Division of Agricultural Scie-nce,Univ,of California,Berkeley.
〔17〕Williams,L.and H.A.Collin 1976 Embryogenesis and plantlet formation in tissue cultures of celery.Am.Bot.40∶325-332。