骨髓移植
出处:按学科分类—医药、卫生 上海科学技术文献出版社《新编内科临床诊疗手册》第660页(15265字)
【概述】
骨髓移植(bone marrow transplantation,BMT)是通过异体或自体的骨髓植入受体内而获得造血和免疫功能重建的医疗手段。按来源不同分为同基因移植(syngeneic BMT,Syn-BMT)、异基因移植(allogeneic BMT,Allo-BMT)和自身骨髓移植(autologous BMT,Auto-BMT),其中,Syn-BMT仅能在同卵孪生的供受者之间进行。
现已知道,骨髓移植的实质是骨髓中存在的多能造血干细胞的移植。由于多能造血干细胞兼有淋巴系细胞和髓系细胞的分化能力,并能不断自我更新、分化和成熟,最终使造血和免疫功能得到恢复。
骨髓移植能使造血功能得以恢复,从而使化、放疗剂量增加到不受造血组织耐受能力限制的水平,以达到更大的治疗效果。在Allo-BMT中,尚存在对白血病克隆的过继性免疫(adoptive immunity),即移植物抗白血病作用(graft-versus-leukemia,GVL)。通过这两个方面的作用,骨髓移植和在此基础上发展起来的外周血造血干细胞移植提供了目前血液系统恶性肿瘤最佳的治愈机会。
骨髓移植来源不同,其特点亦不同。Auto-BMT近年来发展较快。由于不受供者来源、HLA配型、GVHD等限制,且年龄限制较宽,目前已为患血液系统恶性疾病而无合适Allo-BMT供者的患者提供了积极的治疗机会,但其移植后复发率相对较高。Syn-BMT也同样存在易植活、无GVHD的优点和复发率高的缺点,且其供者受条件限制最大,在所有骨髓供者中比例不到1%。Allo-BMT是目前进行的最多的BMT,绝大部分应用于各种白血病治疗。其优势在于移植后有GVL作用,复发率低。但同时存在供者HLA限制、GVHD等诸多制约,移植期间和早期并发症及较严格的年龄限制等不足之处。
我国自20世纪50年代后期开展实验性BMT研究以来,逐步形成了我国所特有的BMT工作特点,但还存在一些不足之处:①Allo-BMT供者来源困难,组织工作滞后,导致Auto-BMT比重较大;②移植中,TB感染和HBV处理是重大课题;③GVHD发生情况较西方国家程度轻、发生率低;④部分中草药可以在BMT过程中发挥巨大作用。
【骨髓移植】
1.同种骨髓移植
(1)临床指征 BMT临床上用于治疗各种恶性肿瘤和非恶性疾病(遗传性血液病和代谢疾病),详见表6-27和表6-28。
表6-27 骨髓移植适应证(Ⅰ)肿瘤性疾病
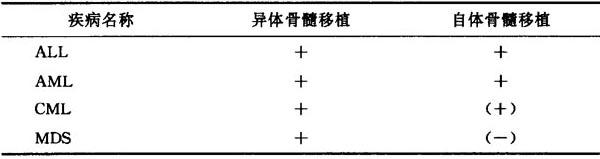

注 +有条件者应积极开展,作为主要治疗手段;(+)临床可考虑应用;(-)一般不主张骨髓移植治疗,个别患者可考虑试用;-目前不考虑该种治疗
表6-28 骨髓移植适应证(Ⅲ)非肿瘤性疾病

注 符号意义同表6-27
(2)供者选择 Allo-BMT是将供者的骨髓移植至同种异基因受体体内。在人类,HLA系统决定了不同个体间的组织相容性。患者基因型与一位同胞兄妹相配的机会是1∶4。在有兄妹同胞的患者,约25%~35%可找到HLA相配的供者。其他供者包括部分相配的家庭成员或完全相配的无血缘关系的无关志愿者。
HLA不相容可以引起移植延迟,排斥危险增加以及早期aGVHD发生率增加(与历史上HLA相配同胞供者作对照)。处于缓解的急性白血病患者,如有一个HLA位点与同胞供者不配,其存活可能性与完全相配同胞供者并无明显差别,但并发症会增加。一个位点不相配是目前使用免疫抑制治疗的Allo-BMT的极限。仅10%患者有合适的部分相配的同胞供者,因而50%以上的患者找不到同胞供者。一些移植中心已探索HLA相配的无关志愿供者进行Allo-BMT。
(3)Allo-BMT的预处理 预处理阶段的目的是清除新生物克隆和形成免疫抑制,使骨髓移植成为可能。预处理包括大剂量化疗及全身放疗(TBI)。最常用方案由TBI与环磷酰胺(CTX)组成。分次或高分次方案较一次照射更好,毒性低而存活长。其他药物如依托泊苷(VP16)与阿糖胞苷(Ara-C)也已证明与TBI联合有效。不包括TBI的方案如白消安(马利兰)与CTX可用于治疗白血病,其效果基本上与TBI方案相当。目前并无特别的方案,大部分再障或非恶性疾病患者可单独用CTX或白消安(马利兰)联合。儿童严重免疫缺陷通常不要求移植前处理,除非因为HLA不相配时才用免疫抑制治疗。
(4)BMT过程 对供者实施全身或脊髓麻醉后,通过髂后上嵴多部位穿刺取得供者的骨髓,与组织培养液混合,肝素抗凝,通过金属筛网分散成单一细胞悬液。此骨髓移植物静脉输给受者。抽集程序很少引起不适,通常仅中度疼痛和局部青肿。威胁生命的合并症发生的机会小于0.5%。红细胞ABO抗原主要不合约占HLA相合的供者的15%~20%,此时应移去RBC。可用血细胞分离机去除骨髓中的红细胞,也可用羟乙基淀粉进行简单的沉降以预防骨髓回输时的溶血反应。必要时可用血浆置换的办法移去受者红细胞抗体。ABO不相合可在10%~15%的移植过程中发生免疫性溶血。一般在移植后2~3周时发生。因此时供者淋巴细胞开始产生抗红细胞抗体。但ABO不合不会引起造血重建延迟或GVHD增加。
BMT后2~3周,因预处理的骨髓清除效应使骨髓处于再障状态。14d时可在BM中发现造血细胞的稀散聚集,由数量相对单一的红、粒细胞和不可分类的克隆组成。表明造血细胞表面有识别骨髓基质细胞上的受体分子并与之相结合的蛋白。如果移植成功,骨髓将进一步增生,移植产生的正常血细胞在外周血循环中增加。
影响移植成功的因素包括预处理,供者细胞表达的同种抗原与受者细胞的免疫拮抗状态,输注的造血干细胞数量和移植物的淋巴成分等。同种移植骨髓的造血通常是多克隆的,但某些研究发现也可呈单克隆性,表明少量干细胞即可重建造血功能,能够重新产生粒系与淋巴系两部分。供者移植物可通过许多方法来确认,包括血细胞同工酶、红细胞抗原、染色体分析、免疫球蛋白基因型及DNA限制性片段长度多态性研究。大部分患者可建立完整造血嵌合体(所有细胞成分均为供者来源),但也可部分保留宿主型造血(所谓混合嵌合体),部分宿主型造血占未处理BMT的20%,去T细胞BMT的67%。后者与高危排斥有关,但与复发无关。肝库否细胞、中枢神经系统胶质细胞、破骨细胞及皮肤Langerhans细胞等均可变成供者型。说明这些细胞起源于造血干细胞的单核-巨噬系统。
(5)移植后的支持护理 移植后再障期需输红细胞与血小板,应照射血制品以预防输血相关的GVHD。大部分患者由于大剂量化疗、放疗引起的口腔黏膜炎和胃肠炎,减少了经口食物摄入及肠道对营养的吸收。非肠道营养可解决移植患者对热量的需要,改善存活,缩短住院日期。个别患者在仔细监视下也可通过肠道给予营养支持。重组集落刺激因子(rh-CSF)是影响造血祖细胞增殖与分化的糖蛋白,G-CSF和GM-CSF可以安全地用于Allo-BMT受者。前瞻性研究表明,G-CSF和GM-CSF可缩短中性粒细胞恢复时间,减少感染的发生,而且并不影响GVHD。
2.自身骨髓移植 在Auto-BMT中,使用患者自己的干细胞以帮助患者从摧毁BM的治疗中恢复。Auto-BMT无需HLA相合的供者,无GVHD发生,故可用于年龄偏大的患者,应用范围较Allo-BMT为广。移植前无需免疫抑制治疗,预处理主要考虑抗肿瘤活性。Auto-BMT的核心是剂量-效应概念,即药物或射线的剂量的增加在一定的范围内可增加肿瘤细胞死亡。
(1)骨髓的收获 Auto-BMT与Allo-BMT一样,尽管患者因恶性疾病接受化疗或放疗,但收集骨髓引起的死亡率与健康供者比较并无差异。术后短暂发热是最常见的并发症。BM细胞产量与健康人相当,但抽吸量为正常人2~3倍。
(2)骨髓的净化 Auto-BMT治疗的疾病大多易于侵犯骨髓,所以回输的骨髓液可能含有克隆性的肿瘤细胞。净化是指使用各种方法从抽吸骨髓中去除肿瘤细胞,保留正常造血干细胞。早期曾试用免疫人白血病细胞的多克隆抗体,近来使用更多的是抗淋巴细胞和髓细胞表面抗原的单抗。补体和抗体可除去99%~99.9%的肿瘤细胞。目前实验室肿瘤细胞检出水平已达10-6以下。大部分移植后复发,位于疾病原来部位,系残留的对治疗抵抗的细胞造成而非回输引起。若干研究提示,骨髓易受肿瘤污染,因此临床净化是必要的。急性髓细胞白血病患者骨髓液在用4HC(一种CTX的活性代谢物)净化后,如果CFU-GM高则移植后复发率也高。CFU-GM可作为4HC净化程度的标记。大系列回顾性研究表明,应用mafosfomide净化,改善了AML患者移植后的无病生存,降低了第一次缓解6个月内的复发。淋巴瘤患者在骨髓组织学检查为阴性者,骨髓累及是未净化的自身移植患者预后不良的原因,因而淋巴瘤复发患者进行移植的最重要的无病生存预后指标是应用PCR检测移植物有无残留淋巴瘤细胞。
骨髓净化的另一办法是分离、净化、收集造血干细胞(阳性选择),或去除肿瘤细胞(阴性选择)。造血干细胞能自我更新及分化成各成熟细胞系列。现已知道,干细胞群的细胞表面标记是CD34和Thy-1,但不表达任何系特异抗原。这类细胞约占骨髓细胞的0.05%~0.1%。在早期临床实验中,从骨髓中收集的 细胞(纯度为60%)可以使接受特大剂量化疗的乳腺癌及神经母细胞瘤患者恢复造血。在CML患者中,纯化的干细胞群没有Ph染色体及相应的分子异常。
细胞(纯度为60%)可以使接受特大剂量化疗的乳腺癌及神经母细胞瘤患者恢复造血。在CML患者中,纯化的干细胞群没有Ph染色体及相应的分子异常。
(3)细胞冷冻及保存 在一般情况下,骨髓纯化后需保存一段时间,以等待患者完成大剂量化疗。骨髓可通过沉降法去除RBC及颗粒细胞,加入一定量的组织培养液,自身血浆和冷冻保护剂,如DMSO,混合后按一定的降温速率降到-80℃,然后保存在-196℃的液氮中。用此法骨髓可储存数月至数年仍有活性。
(4)ABMT的预处理 ABMT的预处理方案类似Allo-BMT,Auto-BMT预处理基本目标是消灭肿瘤细胞,此时并无免疫抑制的必要。可选用对肿瘤细胞有最大杀灭作用而造血毒性最小的药物组成预处理方案。在选择预处理方案时,为能最大剂量使用一些药物,联合用药时其限制剂量的毒性不要重叠。在ABMT不存在GVHD情况,这些患者能耐受比Allo-BMT更强的预处理方案。
(5)Auto-BMT回输 在移植时,骨髓或外周血干细胞在患者床边迅速溶解,不作任何处理,立即回输。回输时往往有恶心、呕吐、腹痉挛、咳嗽、呼吸困难、脸色潮红及高血压。这些毒性反应由冷冻保护剂所致。为预防移植时因细胞溶解引起肾损害,回输时应水化及利尿。
(6)移植后的支持治疗 支持治疗原则包括血制品、抗生素和营养支持。早期研究表明,GM-CSF与G-CSF可以加速粒系恢复(与历史对照材料相比)。而前瞻性研究(随机对照研究)表明,HD及NHL的Auto-BMT患者使用rhG-CSF使中性粒细胞缺乏期缩短,减少了细菌感染发生率,缩短了住院天数,降低了费用。但患者的存活率与复发率不受rhG-CSF影响。ABMT后给予GM-CSF,G-CSF及其他造血生长因子已是临床治疗常规。
(7)Allo-BMT及Auto-BMT后免疫重建 Allo-BMT受者一般都有严重的免疫缺陷,可予移植后延续数月,与原发病及预处理方案无关。在无慢性GVHD(cGVHD)情况下,免疫功能要1~2年才能重建,如有cGVHD则免疫抑制状态可持续更长,直至cGVHD结束。若患者外周血循环中有足够细胞,其中性粒细胞吞噬作用和细胞内的杀伤作用基本上正常,但白细胞趋化作用受损,可持续数年之久。移植后淋巴细胞的TH与TS比例降低,尤在移植后早期是非常突出,一般持续约1年左右。在移植后第1年,B淋巴细胞缺乏活性,增殖及分化也有缺陷。其后B淋巴细胞活力及增殖恢复正常,但免疫球蛋白低于正常水平。1~3年后,大部分B淋巴细胞功能恢复正常(除有cGVHD患者外)。对于缺乏抗体滴度的BMT受者,不宜使用活的病毒疫苗。
在移植过程中,尚需治疗和预防一些常见的并发症,其重要性体现在对移植成败的决定性作用。由于篇幅所限,请参阅相关专业书籍。
3.骨髓移植的临床结果疗效
(1)急性髓细胞白血病 1977年Thomas及同事报道了100例急性白血病终末期接受相配同胞骨髓移植的结果。54例AML,在报告时7例生存,移植后CR已1~4.5年。1992年该7位患者中6例已无病生存17~20年,另一例因肝癌死于移植后16年。早期研究证明,少数患难治性白血病患者能够在移植后长期存活。近年来各种支持疗法,组织配型和GVHD预防明显进展,但难治性AML成年患者长期无病生存率依然只有20%~25%。
复发早期进行BMT的结果类似于第2次缓解期进行BMT,无病生存在20%~38%之间。所以有HLA相配供者的患者,在AML刚开始复发时即应移植。在一项研究中,对二个诱导治疗疗程无效的16例难治AML患者进行大剂量化疗合并HLA相合同胞供者BMT(Allo-BMT),8例患者存活,无病生存18个月~11年(移植者)。该研究表明,AML患者诱导化疗无效时可用Allo-BMT挽救。因此任何新诊断的AML患者均应做HLA配型,以尽快找到合适的供者。凡有合适供者的患者如经诱导治疗不能进入缓解时,则应及时进行移植治疗,以避免接受过度的药物毒性。移植前缓解状态与患者Allo-BMT后持续CR率有关(表6-29)。
表6-29 Allo-BMT后AML长期生存与移植前缓解状态的关系
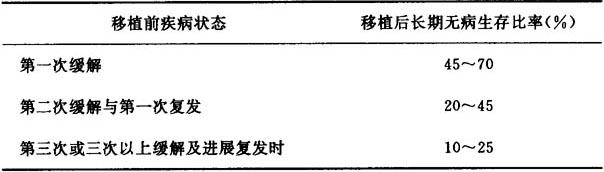
大多数研究表明,Allo-BMT无病生存优于常规化疗,在第一次CR中接受Allo-BMT患者结果最佳,5年无病生存为45%~65%,复发率为10%~25%。复发率低于接受普通化疗的进展性白血病的患者,其最常见的失败原因是移植相关的GVHD,间质性肺炎和感染。
据一些研究报道,移植时患者小于20岁者疗效比年长的好。但另一组患者不能证明年龄与移植后无病生存的关系。Allo-BMT对30~50岁的患者是最佳的治疗选择。50岁以上患者移植后相关并发症明显增高。在儿童患者中,年龄差别一般对BMT预后无明显影响。在相配的无关供者的Al-lo-BMT,GVHD引起的移植相关并发症大大增加,在CR1和CR2进行BMT,AML无病生存率仅为36%~48%,患者疾病进展时为17%~30%。但无关相配供者BMT时,年轻的AML患者的结果与HLA相配的同胞供者相当。
Auto-BMT也用作AML患者CR期巩固治疗。早期研究证明,CR期患者用4-氢过氧环磷酰胺(4-Hydroperoxycyclophosphomide)净化收集的骨髓,在CR2,CR3行Auto-BMT,无病生存率为43%,复发率为46%,与同基因BMT相似。随访表明移植后4~5年,38%患者无白血病生存。以后的资料表明,类似患者的无病生存率为25%~56%。当患者在CR1时进行Auto-BMT,无病生存率为35%~76%,复发率为22%~60%,优于标准化疗,并可与Allo-BMT相比。但约40%处于CR1的AML患者,由于早期复发或其他临床问题而不能进行Auto-BMT。
骨髓的净化作用尚在争论之中。据文献报道净化骨髓者的无白血病生存率较高,但缺乏前瞻性随机试验资料。
在AML患者,其预后不良的指标有:①年龄小于2岁或>60岁;②继发性白血病;③外周血WBC>75.0×109/L(一说为50×109/L);④mHLA-DR阳性、CD34阳性或有2个以上淋系标记;⑤髓外病变;⑥特定的遗传学改变如del(7q),del(5q),11q23异常及3q21,3q26异常;⑦诱导缓解治疗时间大于6周,或两次诱导失败者。其中以继发性预后最差。而在有些研究中,CR1期行Allo-BMT可达到45%~65%不等的长期无病生存。前瞻性研究证实达4年时无病存活率在Allo-BMT组为40%~51%,相比较的传统化疗组仅达16%~27%。复发概率在移植组为15%~33%,化疗组为64%~77%。
(2)急性淋巴细胞白血病 如AML一样,ALL的Allo-BMT结果主要依据患者缓解状态(表6-30)。标准化疗在大部分儿童急淋疗效较佳,但成人、大部分复发的儿童及有不良预后特征的儿童结果极差。对于这些患者Allo-BMT是有效和可接受的治疗方法。1997年Thomas等报道46例难治ALL。在报道时6例无病生存(13%)。其他报道表明,在第3次或3次以上的缓解或难治复发患者中无白血病生存可达15%~25%;第2次缓解期ALL儿童应用Allo-BMT,其长期无病生存可达40%~64%。第1次缓解期或第1次复发时Allo-BMT的疗效远比常规化疗效果好。
表6-30 Allo-BMT后ALL长期生存与移植前缓解状态的关系

在ALL患者,现已知道下列特征表明传统化疗疗效不佳:①年龄大于30岁;②确诊时白细胞计数大于25×109/L;③髓外病变:m特定细胞遗传学改变如t(9;11),t(4;11),t(8;14),t(9;22),等;④免疫分型为裸细胞表型、前B细胞;⑤诱导缓解治疗时间大于4周。凡具备上述任何一点都说明该患者属“高危人群”,其中尤以Ph染色体阳性者预后恶劣。传统化疗在此类患者平均缓解期不足1年。高危ALL患者应用Allo-BMT治疗,59%~71%患者可达长期无病生存,对儿童ALL患者则高达84%。根据IBMTR的研究报道,全球32例CR1期间进行Allo-BMT的Ph阳性ALL患者中,有11例无病生存;3年无病生存概率为36%±17%,明显优于化疗。以往因儿童ALL生物学特性、临床疗效完全不同于成人,不提倡CR1时进行BMT。但现在认为,CR1是BMT进行的良机,不仅治愈率进一步提高,更改善了远期第二肿瘤发生率和远期生存质量。
迄今为止,ALL患者应用ABMT治疗也有成功的报道。不论是否使用单抗净化骨髓,CR1期ABMT后,32%~65%患者可达长期无病生存。CR2或CR3期移植,其数值为21%~31%。CR1期比较长或净化处理比较有效者,ABMT的无病生存率明显提高。目前尚无ABMT及化疗两种方法直接比较的研究报告。一项比较研究提示:高危ALL的CR1期进行Allo-BMT与ABMT后无病生存率分别为71%和40%。Allo-BMT复发率比ABMT低,但Allo-BMT相关死亡率高,以致无白血病生存两者并没有明显差异。
(3)慢性髓细胞性白血病 Allo-BMT是CML患者惟一有根治作用的治疗手段。在CML的慢性期,其血液学异常应用口服烷化剂即可控制,但一旦进入加速期或急变期,常规化疗只维持短期生存。如同急性白血病一样,Allo-BMT的结果取决于疾病期。早期研究证明,先用骨髓灭绝性的化疗和放疗,而后行同基因或异基因骨髓移植可以有效治疗CML。进一步研究指出,在第一或第二慢性期的CML患者经Allo-BMT可使50%~75%患者进入长期无病生存;加速期成功率降至30%~40%;急变时仅有5%~15%。慢性期移植失败的基本原因是移植相关毒性。在进展期,复发是失败的主要原因。对生存的最重要的预后因素是疾病的分期。年轻患者生存率高,而脾脏肿大或脾切除并不影响BMT结果。CML诊断后1年内进行移植也是一个预后因素。在一组于诊断后1年内进行移植的CML患者应用现代预处理方案及GVHD预防,80%无病生存1~5年。目前,一般认为患者年龄在50岁以下、近期诊断CML、有HLA相配的同胞供者,则Allo-BMT是其标准治疗。
青少年CML病情凶险,对常规化疗反应差,中数存活期小于2年。Allo-BMT成功地治疗了儿童患者,诊断后如有适当供者,应尽可能进行移植。CML是无关供者移植最佳适应证。CML自然病史允许有足够的时间去寻找合适的供者。无关供者BMT结果取决于疾病的分期、受者年龄、受者与供者HLA相合的程度。第一次慢性期患者的无病生存率为37%,诊断1年内移植的患者结果较好(45%),类似于HLA相配同胞间移植。无关供者移植GVHD发生率高,移植失败率高,但仍是CML尤其是有相配供体年轻患者的可行选择。
CML复发可从临床、细胞遗传学(Ph′)及分子生物学方法(BCR-ABL融合基因)证明。持续PCR转阴复发危险较低,而PCR阳性者其危险性高低不一。通常PCR一次以上阳性或移植后6个月内仍阳性则复发率较高,但文献中并不都支持这一观点。
Auto-BMT治疗CML依然是一个有吸引力的研究课题。CML患者长期骨髓培养可以获得Ph(-)的造血祖细胞克隆。初步研究表明这些细胞可在清除骨髓治疗后移植达到造血重建。使用干细胞表面特殊的表面标记单抗可以从CML患者骨髓中分离出不表达Ph′染色体的造血祖细胞,使用这样的纯化造血干细胞进行自身移植是未来可行的治疗方法。
(4)骨髓增生异常综合征(MDS) MDS用标准的化疗治疗无效,但应用CSF可能有益。Allo-BMT后无病生存率达40%~60%。年轻及移植前原始细胞数量是影响无病生存和复发的主要预后因素。但去T的BMT则是一个危险因素。文献报道,急性骨髓硬化也可用Allo-BMT进行有效治疗。
继发于化疗的急性白血病Allo-BMT的无病生存率可达30%~60%,移植前能用标准治疗进入缓解的患者有比较好的结果。无病生存率可与急性白血病相比。
(5)霍奇金病 大部分初治霍奇金病的患者可以用现代联合化疗或放疗治愈。单一放疗后或第一次化疗后1年以上复发患者大多数可以用化疗成功地治疗。但第一次化疗后早期复发或者经一种以上化疗方案治疗无效者预后较差。大剂量化疗联合不净化的Auto-BMT是对此种高危患者的拯救性的治疗。若干研究表明,使用各种大剂量化疗方案作预处理的无病生存率为30%~50%,移植后无病生存率的预后因素包括有无大块肿瘤,以前化疗次数,当时状况及复发状况。方案相关死亡率为5%~20%。强烈预处理虽然增加了移植相关毒性,但可以改善无病生存。对100例患者行Auto-BMT,中位随访时间2~3年。5年无病生存率约为50%。骨髓受累或髂骨曾接受过放疗以致影响骨髓收获时,可采用大剂量化疗,尔后用外周血造血祖细胞移植可获得较好的结果。大剂量治疗伴骨髓重建的方法治疗15例处于疾病进展期,有多个不良预后因素的患者,无病生存率达86%。而历史对照组用标准方法治疗的患者仅33%。该项研究证明,大剂量化疗合并ABMT或APBSCT可以使预后差的HD患者延长生存期。
Allo-BMT也可用于HD患者,无病生存率为20%~40%,并不比ABMT优越。
(6)非霍奇金淋巴瘤(NHL) NHL的临床过程取决于组织类型(低、中、高)及分期。一定比例低度NHL将会转化成进展类型,此时标准治疗往往无效。大剂量化疗合并ABMT已被作为拯救性治疗方法用于低度NHL转型前后的治疗。最初报告建议,在转型前进行移植比较有效。对化疗的敏感性可以通过移植前达到CR来证实,对化疗敏感的低度NHL与转型患者的ABMT结果并无明显差别,一些复发的低度NHL可以用ABMT治愈。联合化疗合并或不合并放疗可以使大约50%中高度NHL达CR,而最初化疗后复发的患者预后较差。ABMT可以使这些患者无病生存率达到16%~57%。与预处理方案相关的死亡率为4%。ABMT前的疾病状态影响治疗结果,化疗敏感的复发患者明显优于化疗抵抗的复发患者。移植时CR的患者无病生存率为80%,PR只有60%,而疾病进展时只有11%。ABMT治疗复发NHL的生存率优于单纯化疗者。中高度恶性晚期NHL患者预后很差,CR期进行ABMT,术后无病生存率可超过80%。组织学阴性的隐性骨髓累及者,如不采用净化措施,ABMT的预后较差。在一项研究中,一组复发淋巴瘤患者无病生存的预后因素中,最重要的是净化过程中,完全消灭残留淋巴瘤细胞的可能性。在大部分患者,复发位于以前发病的部位,似因残留肿瘤细胞所致,但在ABMT过程中,活的淋巴瘤细胞可再次输入体内,由于归巢(Homing)作用而在以前病变部位复发。
Burkitt淋巴瘤大部分可用常规化疗治愈,复发患者预后差。对预处理敏感者ABMT可使50%患者达长期无病生存。
淋巴母细胞淋巴瘤进展期合并大块肿瘤,或累及骨髓和中枢神经系统、对标准化疗反应差者预后不良。第一次缓解期行ABMT者无病生存率可达67%~77%。如对化疗敏感,大剂量化疗可拯救50%复发患者。NHL的Al-lo-BMT结果与Auto-BMT类似。由于Allo-BMT有移植物抗淋巴瘤作用,因而复发率低。在高危淋巴母细胞淋巴瘤患者中,第一次缓解期进行Allo-BMT与ABMT相当;而在复发患者中,Allo-BMT略好于Auto-BMT。
(7)多发性骨髓瘤(MM) MM对化疗与放疗敏感,但CR率仅10%~15%,中数生存期大约为3年。ABMT或APBSCT的CR率为20%~60%,有效率60%~80%。无病存活率短期随访为30%~80%之间。β2微球蛋白在诊断时水平较低、对大剂量化疗有反应或达到CR者预后较好。净化骨髓或PBSC的结果与未净化类似。在一些研究中,浆细胞增生程度并不影响结果。理论上认为,PBSC受恶性细胞污染危险少,但最近已证明,大部分未治MM患者周围循环中有新生的浆细胞。
Allo-BMT治疗浆细胞病已有鼓舞人心的结果。7个中心的回顾性研究中,CR率达43%,中数生存期4年。疾病早期化疗次数少者可以得到较高的缓解率。BMT缓解者生存质量可得到改善,Allo-BMT或Auto-BMT可使MM进展得到长期控制。
(8)实体瘤 Auto-BMT已用于多种化疗敏感的实体瘤。转移性乳腺癌CR率可达25%~60%,长期无病生存达15%~25%。Auto-BMT仅适用对化疗敏感的患者。乳腺癌的骨髓净化尚在研究之中。转移或高危初发患者的标准化疗与ABMT的比较研究也在研究中。难治性卵巢癌和精原细胞癌,用ABMT治疗达到了期望的结果,无病生存率为15%。在疾病早期使用Auto-BMT治疗反应较好。
在儿童患者疾病处于进展期,预后较差,常规化疗不可治愈的神经母细胞瘤,使用ABMT可延长无病生存期。
(9)再生障碍性贫血 获得性再障是造血干细胞或骨髓微循环缺陷的结果,也可以是免疫介导所致。由HLA相配同胞供者进行BMT,如受者曾输过血,移植物排斥将成为一个重要临床问题。移植前不进行任何免疫抑制治疗,同卵双胎供者进行的同基因移植后出现的排斥引人注目。该结果表明,部分再障患者的发病机制与免疫介导有关。HLA相配同胞移植的移植物排斥相关因素包括移植的细胞太少和MLR(matching lymphocytic reac-tion)时受者与供者细胞体外相互反应。受者细胞的反应性往往是由于对以前输血的组织相容性抗原敏感所致。
一个降低移植物被排斥的方法是将供者血液的灰白层细胞在骨髓移植后输给受者。此种尝试减少了移植的失败,改善生存率,但与之同时慢性GVHD发生率增加。预处理如全淋巴照射可减少移植失败,但并发继发性恶性肿瘤特别是实体瘤的危险明显增加。移植前未输任何血制品者可以得到最好的结果,未输血患者有80%的无病生存率,而输血致敏者仅50%左右。未输血的儿童及18岁以下青年无病生存率为95%。
初治再障,年龄在40岁以下,有HLA相配的兄弟,可以选择Allo-BMT作为治疗措施。移植前不应输血。如果患者必须输血,血制品必须滤去白细胞,并避免输家庭成员的血。没有HLA相配同胞的患者应立即用免疫抑制治疗,如果免疫抑制治疗失败,可选择相配无关供者行Allo-BMT,约29%可以存活2年以上。再障患者在严重感染之前,在对输血支持耐受前进行Allo-BMT,结果更为理想。
(10)范可尼贫血(Fanconi anemia,FA) FA患者早期移植因大剂量CTX伴随的严重毒性,致治疗疗效很差,成功率为20%~50%。较低剂量CTX与低剂量TBI可改善结果。有HLA相配同胞供者的FA患者,应在患者白血病变以前进行Allo-BMT,供者应做染色体检查,排除FA可能。
(11)重型珠蛋白生成障碍性贫血(地中海贫血)及其他血红蛋白病第一例成功的Allo-BMT治疗重型珠蛋白生成障碍性贫血(地中海贫血)是1982年,此后进一步经验在意大利获得。222例年龄在16岁以下的重型珠蛋白生成障碍性贫血(地中海贫血)患者,Allo-BMT的无病生存率为75%。肝肿大、门静脉纤维化是预后差的因素。无肝肿大及门静脉纤维化者,无病生存率为94%。患者若有一个危险因素,生存率为77%,有二个危险因素为61%。患者年龄大于16岁移植者预后很差,无长期生存。其原因与年龄大的患者往往并发肝肿大和门静脉纤维化有关。近年来,由于预处理方案改善及GVHD预防使无病生存率与年轻人相仿。
1984年文献报道一例8岁镰形细胞贫血患者因患AML行Allo-BMT,术后贫血也得到根治。其后,17例患者在一些中心接受了Allo-BMT,16例得到了根治。
(12)免疫缺陷综合征 第一例成功治疗的BMT报道是1968年进行的2例免疫缺陷综合征儿童患者。目前,一般认为,重型杂合子病例的治疗选择之一是行同胞相配供者的Allo-BMT,成功率为20%~80%。严重免疫缺陷者(SCID)可以不做预处理,直接HLA相配同胞的骨髓做BMT,如进行去T细胞移植,为防止移植物被排斥,仍需免疫抑制处理。自从1977年报道的第一例以无关供者移植治疗SCID以来,最近又有12例免疫缺陷综合征患者接受了无关供者的BMT,成功率为83%,并伴良好免疫重建。
(13)遗传性代谢性疾病BMT能治疗遗传性代谢性疾病是因为缺失或缺陷的酶可被植入细胞所纠正。在这些遗传性代谢性疾病,缺失或缺陷的酶必须在造血或淋巴组织的细胞中表达,BMT才能有治疗作用。目前已成功应用Allo-BMT治疗的遗传性代谢性疾病包括戈谢病、Hurler综合征,异染性Lenrodystrophy等。
(14)其他非遗传性疾病 1956年南斯拉夫放射事故中,6例患者首先试用BMT。其后,1986年切尔诺贝利核事故中,13例患者接受了同胞或父母的骨髓,手术于事故后4~16天进行,6例患者部分植活后,发生短暂恢复,仅2例患者存活。死亡原因包括烧伤,间质性肺炎,GVHD和肾衰。
HIV-1感染也试用Allo-BMT或同基因移植。一例HIV感染的淋巴瘤患者接受了HLA相配姐妹骨髓及抗病毒治疗。预处理破坏了HIV感染的细胞,而抗病毒治疗将预防供者细胞被感染。移植后患者体内有完整的造血嵌合体,并没有GVHD发生。但患者于第47天死于淋巴瘤复发,尸解时无HIV-1感染证据。
(15)第二次移植 白血病患者接受基因型相配的骨髓移植约1%发生排斥。部分相配的相关或无关供者进行移植,排斥发生率为7%~10%。在这些患者中,进行额外的免疫抑制治疗后再予以移植,通常是不成功的。在既往接受输血治疗的再障患者预处理单用CTX,其排斥是一种严重并发症,大部分此类患者可再次应用CTX,ALG治疗后,进行第二次移植以达到植活。然而,由于GVHD及感染,只有一小半患者可以长期存活。
AL的Allo-BMT后,特别是移植时疾病进展,白血病可以复发。大部分复发发生在移植后2年之内,但也可在移植后第7年发生。复发白血病患者预后极差,仅少数能够耐受再次化疗,大部分患者数月内死亡。
再次BMT已在一些白血病复发患者中进行,无病生存率为19%~29%,复发率为42%~60%。移植相关毒性是移植失败主要原因,特别是1年内的再次移植患者更是如此。这些观察表明,第二次移植在某些选择病例中是有效的。第二次BMT的候选人至少要有1年无病生存,并且在第一次BMT时不应发生预处理所致的严重毒性反应,如VOD、肺炎或GVHD。
(16)未来的发展 过去的20年,BMT领域中,已取得明显进展。在临床治疗疗效、机制的了解,BMT的生物学和免疫学方面都是如此。许多疾病BMT的最适时间与指征的临床研究正在进行之中。不同预处理和预防GVHD方法的随机对照研究和集落造血生长因子使用减少了移植死亡。
去T的BMT减少了GVHD的发生,但移植物被排斥的机会增加了,复发也增加了。GVHD动物模型已可将GVHD与GVL分开。鼠脾细胞与骨髓低密度部分可在经致死照射鼠形成持久的移植,而无GVHD的发生,但同时保留了GVL。在另一鼠模型中,IL-2可减少GVHD而不影响移植或GVL。现正努力把从动物模型中发展来的这些技术使用到人类的BMT中。
干细胞也可以提供转基因载体,以纠正遗传缺陷。某些遗传性疾病可用Allo-BMT纠正,但这些移植常合并免疫移植治疗及GVHD。使用自身造血干细胞,使缺陷基因的正常拷贝嵌入,这样可以避免免疫抑制及GVHD危险。逆转录病毒载体最近已有进展,可以有效地转移许多人类基因如腺苷酸、胱氨酸和葡萄糖脑苷酯酶(gluco-cerebrosidase)进入鼠或人的造血细胞中。如此改变基因的细胞有能力纠正患者各种遗传缺陷。