重症肝病患者抗心律失常药物应用
出处:按学科分类—医药、卫生 上海科学技术文献出版社《临床心律失常诊疗手册》第192页(4815字)
肝脏为人体的一个重要器官,参与多种药物的生物学转化过程,尤其是血流75%来自门静脉,25%源于肝动脉,遂使肝脏在灭活药物过程中处于特殊的地位。研究发现,重症肝病可直接影响肝脏对药物的代谢过程。与肾脏损害不同,肝脏损害后,药物对人体的影响与常规实验室检查的肝功能标记物不常相关,据此,当肝病患者合并心血管事件时,合理选用抗心律失常药物有其重要的临床意义。
【正常肝脏的药物代谢】
口服给药者,药物吸收需历经肝脏的首过效应后,方能进入全身循环。前者的第一阶段,发生在滑面内质网,代谢涉及的酶,主要为细胞色素P450基因家族,在人类现已区分出12个催化氧化还原反应的基因家族中,第1、2、3酶家族参与所有的药物代谢过程。另有酯酶、酰胺酶及微粒体环氧化物水解酶,可灭活由P450酶产生的高度活性氧化产物。第二阶段则见于细胞质内,显现以葡萄糖醛酸化为代表的结合反应。
(一) 肝脏摄取率
为肝脏摄取药物的效率,受肝血流、蛋白结合率及自身代谢活性的影响,临床按肝脏摄取率可将药物分为高摄取率和低摄取率两类。凡遁越首过效应的药物含量为生物利用度,肝脏病变并肝功能不全者,可使具首过效应药物的生物利用度增加。
(二) 肝脏清除率(CLh)
为每分钟由肝脏完全清除含药的血液量。CLh=Q×(Ci-Co)/Ci(Q为肝脏血流量;Ci为流入肝脏的血药浓度;Co为流出肝脏的血药浓度)。公式示,当肝脏药物摄取率高者,Co接近0,则CLh近似肝脏血流量。肝脏对非结合药物(未与蛋白结合药物)的清除率为肝细胞在不受血流量药物结合状态以及代谢部位转变等限制时,清除药物的能力,后者与肝酶活性有关。
(三) 分布容积(Vd)
为体内含药液体的总量。公式示Vd=药物剂量/血药浓度。
(四) 半衰期
为体内药物的代谢,衰减为原药量1/2所需的时间。公式示t1/2=0.693×Vd/CL,据此半衰期有赖于清除率和分布容积。分布容积不变时,半衰期与清除率呈反比。当不伴分布容积改变时,肝病患者的半衰期因其肝脏清除率下降,每可导致数种高摄取率药物半衰期过长,于临床应减少所给药物的维持用量。
【病态肝脏的药物代谢】
(一) 肝硬化
除肝硬化外,肝病轻度影响药物代谢,故临床多无需更动给药剂量。然而,当病变已进展为肝硬化时,则属不可逆损害:肝细胞坏死伴病理性修复,血管结构破坏,并肝内、外门脉系统分流。Gross等报道肝内门脉分流量范围在4%~66%。届时,血液将越过肝细胞直接注入中央静脉,而增加原首过效应药物的生物利用度。此外,肝功能衰竭或重症肝硬化患者的P450酶活性降低,Brodir等报道下降幅度高达50%。有认为P450酶的表达尚与胆汁淤积有关。此亦成为肝脏不同病变可呈现药物代谢各异的原因之一。
晚近,涉及病变肝脏影响药物代谢的研究尤其关注肝实质的变化。肝硬化患者每可继肝实质毛细血管纤维化、基底膜沉积、Diss间隙胶原生成等改变,致摄氧匮乏影响药物清除。动物模型研究已检获低氧致P450酶含量及其活性降低的证据。据此,按肝硬化时改善氧供为调节药物经肝脏代谢的观点,临床可采用扩血管药物增加肝动脉血流量,并提高肝实质血氧含量以达到改善病态肝脏药物代谢的目的。
(二) 充血性心力衰竭
充血性心力衰竭患者,肝窦明显淤血并伴器官低灌注状态,皆可损害肝脏对药物的代谢功能。研究显示,静脉压升高导致肝细胞萎缩,肝窦周围水肿而减弱氧的弥散。Stenso等就充血性心力衰竭患者采用利多卡因治疗的研究发现,肝血流量与心脏指数呈线性相关,而与动脉血利多卡因浓度呈负相关,利多卡因清除呈流量依赖的特征。
充血性心力衰竭时,肝小叶中央区因远离门脉汇管区,氧供不足尤为明显,遂成为主要损伤区域。尽管如此,常规肝功能指标多无法如实反映充血性心力衰竭时的肝脏损害,届时,有认为需采用肝活检和相关敏感检测法,方可确认肝脏药物代谢能力异常之改变。TokoLa等经肝活检发现充血性心力衰竭患者药物氧化酶含量下降达30%。近期,Lambert等就充血性心力衰竭动物模型研究发现细胞色素P450酶含量明显减少,其时,尤以苯巴比妥诱导之P450酶(PBD—2αP450ⅡB酶)更为显着。
【肝病患者抗心律失常药物的应用】
(一) 奎尼丁
主要由肝脏代谢。肝硬化时半衰期明显延长,剂量及用药频率均需相应减少。Ueda及Dzindzio发现,充血性心力衰竭患者摄服奎尼丁后血浆清除率为对照组的70%,并血药浓度升高43%,但半衰期未有改变,系与该药分布容积减少有关,故充血性心力衰竭患者应酌减用量,并严密监测血药浓度。
(二) 普鲁卡因胺
经肝脏代谢后的主要代谢产物为N乙酰普鲁卡因胺(NAPA)。研究发现,肝硬化时尽管可波及其代谢速率,但对药效及毒性无甚影响。故充血性心力衰竭患者可不必调整剂量。最近有报道指示,充血性心力衰竭患者对该药代谢的方式提出异议。遂建议:轻症者静脉维持用量减少1/3,重症者减少3/4,且负荷量减至12mg/kg为宜。
(三) 丙吡胺
由肝脏代谢灭活,经肾排泄。肝硬化时游离药物清除率、分布容积、蛋白结合率均降低,用量应减少25%,并需监测血药浓度及毒性反应。
(四) 莫雷西嗪
存在首过效应,肝功能受损时清除率下降,应酌减用量,重症肝损患者不宜使用。
(五) 利多卡因
主要由肝脏清除。肝硬化时清除率下降40%,分布容积增加,半衰期延长。充血性心力衰竭时,虽因心排量下降而清除率降低,但由于分布容积相应减少,其半衰期多无改变,同时仍应降低首次负荷量。据此,肝硬化和(或)充血性心力衰竭者应用本品建议酌减用量为40%~50%为宜。
(六) 美西律
与利多卡因类似。肝硬化时半衰期延长至10~28h,应减少1/4维持量。充血性心力衰竭者,美西律的半衰期也有延长。
(七) 妥卡尼
与利多卡因类似。肝损时用量减为50%。确切剂量需视临床反应及血药浓度而定。
(八) 氟卡尼
经肝脏代谢,由肾排泄。肝损时半衰期延长,应减少用量。充血性心力衰竭患者存在清除率降低现象,应监测血药浓度。
(九) 普罗帕酮
本品经细胞色素酶P450D6代谢为活性产物。有报道7%高加索人缺乏该酶。肝硬化时普罗帕酮半衰期延长,临床应用需减量70%~80%。
(十) 胺碘酮
经肝脏代谢为活性去乙胺碘酮(DEA)。研究发现,重症心力衰竭患者静注胺碘酮后,DEA半衰期延长60%。然而,短期(<2个月)治疗者尚不至于加剧胺碘酮作用。尽管如此,仍应严密监测药物浓度,一经有效控制心律失常后,即应减量,以最低剂量维持其药效。
(十一) β受体阻滞剂
1.普萘洛尔 本品有左旋及右旋两种异构体。左旋普萘洛尔较右旋作用强100倍。普萘洛尔肝脏清除率高,致生物利用度低。研究认为药物总清除率与肝血流及P450酶分解速度有关。临床发现,普萘洛尔并可降低安替比林清除率,遂提示甚可影响肝微粒体酶的活性。肝硬化时普萘洛尔清除率明显下降,半衰期延长。据此,充血性心力衰竭及肝损患者应慎用普萘洛尔,但对阿替洛尔、纳多洛尔、艾司洛尔、索他洛尔以及醋丁洛尔等药物于肝功能不全时,均无需调整给药剂量。
2.拉贝洛尔 主要由肝脏代谢,在慢性肝病时,生物利用度加倍,需酌减剂量。
3.美托洛尔 主要在肝脏代谢,肝损时慎用。
(十二) 钙离子通道阻滞剂
1.维拉帕米、地尔硫 及硝苯地平 均经肝脏代谢。肝硬化时清除率下降,分布容积增加,半衰期延长、生物利用度加倍。Ene报道,肝硬化患者口服单剂硝苯地平后,半衰期延长达4倍之多,应注意多次用药后的药物集聚,临床在患者初始用药及维持给药之时,推荐采用低剂量为宜。
及硝苯地平 均经肝脏代谢。肝硬化时清除率下降,分布容积增加,半衰期延长、生物利用度加倍。Ene报道,肝硬化患者口服单剂硝苯地平后,半衰期延长达4倍之多,应注意多次用药后的药物集聚,临床在患者初始用药及维持给药之时,推荐采用低剂量为宜。
2.氨氯地平 与其他钙离子拮抗剂不同,本品清除率低,生物利用度较高。肝硬化患者给予单剂口服与肌注,半衰期延长,提示长期服药者可致蓄积。Keaoler建议2.5mg/d为宜,并以14天为周期逐次增量。
3.非洛地平 本品存在首过效应,生物利用度为10%~25%。肝硬化患者清除率下降致血药浓度增加,故应酌减初始剂量,并调整给药周期。充血性心力衰竭患者于初始接受治疗时,剂量需低,并应个体化用药。
4.伊拉地平(Isradipine) 存在首过效应,生物利用度低。肝病患者单次口服给药后生物利用度及分布容积增加,肝硬化患者需酌减用量。
5. 尼卡地平(Nicardipine) 存在首过效应,生物利用度低。肝硬化患者半衰期延长。重症患者尤应慎用,初始剂量以20mg每日2次为宜,尔后按临床反应调整。
6. 苄普地尔(Bepridil) 经肝脏代谢,肝功能不全时慎用。
表6-4-1 抗心律失常药物在肝硬化和心力衰竭治疗中的运用
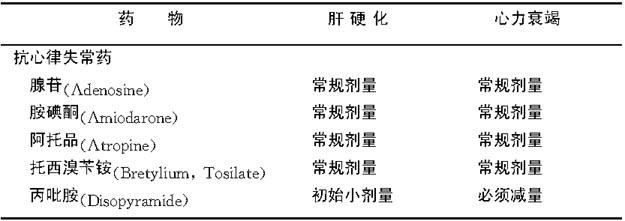
(续 表)

(续 表)
