小麦籽粒、植株和土壤中残留量检测方法
出处:按学科分类—农业科学 中国农业出版社《农药残留量实用检测方法手册第3卷》第541页(3103字)
上海市农业科学院植保所 王伟民 盛亚红
样本用乙腈盐酸溶液提取,SPE柱净化,气相色谱法(NPD)测定。
1.主要仪器及设备
气相色谱仪 氮磷检测器(NPD)
高速组织捣碎机
旋转蒸发器
国际型振荡器
超声波清洗器
电热恒温水浴锅
固相萃取装置
真空泵
2.主要试剂
乙腈(光谱纯)、正己烷(重蒸)、乙酸乙酯(重蒸)、丙酮(重蒸)、甲苯(重蒸)、甲醇(重蒸)、盐酸、磷酸、氯化钠、无水硫酸钠
10%三甲基硅烷基重氮甲烷正己烷溶液
SPE-SCX柱 Bond Elut LRC SCX,500mg
SPE-C18柱 Bond Elut LRC C18,500mg
SPE-Si柱 Bond Elut LRC Si,500mg
吡草醚标准品
3.检测步骤
3.1 提取
3.1.1 小麦籽粒(麦粉)、土壤
称取20g样本,放入500mL三角烧瓶中。加入100mL乙腈/1mol/L盐酸(4∶1,V/V)溶液,振荡提取1h,抽滤。滤渣用100mL提取液洗涤两次,合并滤液。
3.1.2 植株
称取20g样本,加入120mL乙腈/1mol/L盐酸(4∶1,V/V)溶液,高速匀浆2min,抽滤。滤渣用100mL上述提取剂洗涤,合并滤液。
3.2 净化
3.2.1 液-液分配
将上述滤液用旋转蒸发器(40℃)浓缩后,加入20mI饱和氯化钠溶液,转入250mL分液漏斗中,用40mL、30mL、30mL正己烷/乙酸乙酯(9∶1,V/V)萃取。萃取液经装有10g无水硫酸钠的漏斗脱水,再用10mL正己烷/乙酸乙酯(9∶1,V/V)洗漏斗。合并萃取液与洗涤液,用旋转蒸发器(40℃)浓缩至近干,氮气吹干。
3.2.2 离子交换柱净化
加入1mL丙酮溶解残余物,移入SPE-SCX柱中,用4mL丙酮分3次洗烧瓶并用于上柱洗脱。收集洗脱液于具塞刻度试管中,定容至10mL。
将定容后的溶液分成A、B两份样品,每份5mL,分别在40℃条件下用氮气吹干。A份样品用于测定吡草醚母体,B份样品用于测定吡草醚的降解产物E1。
3.2.3 甲基化反应
取样品B,加入0.4mL甲苯、0.1mL甲醇和0.1mL10%三甲基硅烷基重氮甲烷正己烷溶液,在室温下反应0.5h,反应完毕后在40℃条件下用氮气吹干。
3.2.4 C18柱与Si柱净化
3.2.4.1 样品A
在样品A中加入1mL乙腈/磷酸缓冲液(4∶6,V/V),过SPE-C18柱,然后用4mL上述溶液分4次洗涤,弃去。用4mL乙腈洗脱,洗脱液在40℃条件下用氮气吹干。残余物用0.5mL正己烷/丙酮(9∶1,V/V)溶液溶解后,加到SPE-Si柱上,再用0.5mL上述溶液洗涤。最后用5mL正己烷/丙酮(8∶2,V/V)溶液洗脱。洗脱液在40℃下用氮气吹干。准确加入1mL甲苯,超声波助溶,测定吡草醚母体。
3.2.4.2 甲基化的样品B
净化方法同样品A。用1mL甲苯溶解后,测定吡草醚的降解产物E1。
3.3 气相色谱法测定
检测器 NPD
色谱柱 BP-608,30m×0.53mm×0.5μm
检测温度 进样口230℃;检测器300℃;柱温150℃,20℃/min,230℃,10min
载气 氦气,6mL/min
燃烧气 氢气2.3mL/min,空气60mL/min
进样量 2μL
保留时间 10.45min(吡草醚),11.20min(代谢物E1)
4.结果计算
外标(峰高)-标准曲线法定量
5.灵敏度、准确度和精确度
最小检出量 2×10-11g(吡草醚),1×10-10g(E1)。
最低检测浓度 0.001mg/kg(吡草醚),0.005mg/kg(E1)。
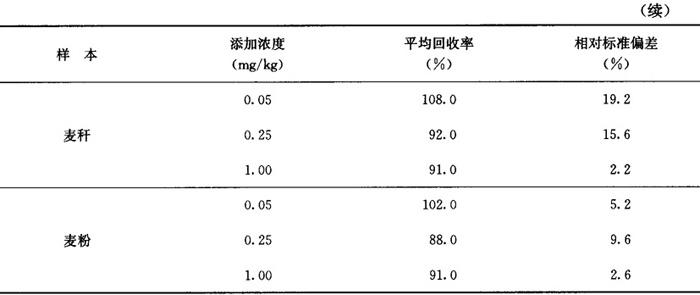
回收率 小麦籽粒、麦秆和土壤中添加吡草醚0.05~1.00mg/kg时,平均回收率分别为88.0%~102.0%、91.0%~108.0%和89.0%~104.0%。见表3-31-1。
相对标准偏差 2.2%~19.2%,见表3-31-1。
表3-31-1 小麦籽粒、麦秆和土壤中吡草醚添加回收率及相对标准偏差实验结果

6.小麦籽粒、植株和土壤中吡草醚气相色谱测谱图
见图3-31-1。


图3-31-1 小麦籽粒、植株和土壤中吡草醚气相色谱测谱法