热力循环及热力学第二定律
出处:按学科分类—工业技术 北京出版社《现代综合机械设计手册上》第213页(1061字)
能够持久地产生机械能的热机,都是按照一定的热力循环工作的。在热力循环中的自然规律,除热力学第一定律外,还有热力学第二定律。
由可逆过程组成的循环称为可逆循环。可逆循环可以用p-v图也可以用T-s图表示,如图1.4-1所示。由图可见,在循环中,工质从高热源所吸取的热量为q1,而向低热源所放出的热量为q2。q1>q2,q1-q2=q0为循环中消失的热量,称为循环的有效热。同时,在循环中,工质向外膨胀所作的功为l1,而被外界压缩所受的功为l2。l1>l2,l1-l2=l。为循环中出现的功量,称为循环的有效功。根据热力学第一定律,q0=l0。 称为循环的热效率。
称为循环的热效率。

图1.4-1 热力循环的p-v图及T-s图
在高热源的温度T1及低热源的温度T2各自相同的条件下,卡诺循环的热效率是最高的。卡诺循环是由二个定温过程和二个绝热过程组成,如图1.4-2所示。卡诺循环的热效率为

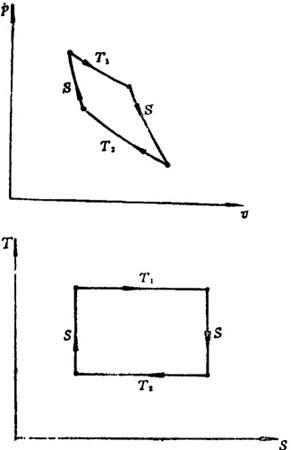
图1.4-2 卡诺循环的p-v图及T-s图
因高热源温度T1不可能达到∞,低热源温度T2也不可能达到OK,所以卡诺循环的热效率ηt不可能达到100%。此外,可以看出,在T1=T2时,ηl=0,这说明没有温度差存在,就不可能持久地把热转变为功。
热力学第一定律说明了能量的形式可以转化,热可以变功,功可以变热,并且建立了热和功之间的当量关系。但是符合热力学第一定律的理想并非都能实现。能量转化除了当量关系外,还有方向、条件及限度等问题,这些则需由热力学第二定律予以解决。热力学第二定律,可归纳为下列几条:
①功可以全部地、无条件地转变为热,而热只能部分地、有条件地转变为功。
②要持久地把热转变为功,至少要有两个热源(一个高热源,一个低热源)。
③在热变功的循环中,从高热源吸收的热量不可能100%地变为功。
④热可以自动地从高温传向低温,但不可能自动地从低温传向高温。