氨的分子结构和性质及制法
书籍:高中数理化公式定理大全
出处:按学科分类—文体、科学、教育 商务印书馆国际有限公司《高中数理化公式定理大全》第389页(1123字)
1.氨的分子结构:

2.氨的物理性质:
无色、有刺激性气味的气体,密度比空气小,易液化为无色液体,同时放出大量热,液氨汽化时,吸收大量的热,使周围的温度急剧下降.氨气极易溶于水,常温常压下,1体积水能溶解700体积的氨气,氨的水溶液叫氨水.
3.氨的化学性质:
①NH3与水反应:
NH3不仅溶于水,且大部分NH3与水结合成NH3·H2O.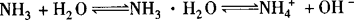
所以氨水是混合物,主要微粒有:H2O、NH3·H2O、NH3、OH—、H+、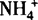 ,呈碱性.
,呈碱性.
注意 ①计算氨水的质量分数和物质的量浓度时,溶质应为NH3,而不是NH3·H2O;②氨水的密度小于1,且随氨水浓度增大,密度减小.
②NH3与酸反应生成铵盐.
如:NH3+HCl=NH4Cl
将NH3通入浓的挥发性酸(如浓盐酸、浓硝酸)中,会产生大量的烟
③NH3与某些强氧化剂反应:

4.氨气的实验室制法:
(1)用铵盐与消石灰混合加热制取NH3:

发生装置: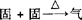 (同实验室制O2的发生装置).
(同实验室制O2的发生装置).
(2)向浓氨水中加强碱或生石灰:

收集:向下排空气法收集.
检验:a.用湿润的红色石蕊试纸检验变蓝.
b.用沾有浓盐酸的玻璃棒接近瓶口产生白烟.
干燥:用碱石灰干燥.不能用浓H2SO4或无水CaCl2干燥.因为NH3与CaCl2反应生成CaCl2·8NH3.