二氧化碳的实验室制法
书籍:初中数理化公式定理大全
出处:按学科分类—文体、科学、教育 商务印书馆国际有限公司《初中数理化公式定理大全》第301页(1045字)
1.药品:稀盐酸跟大理石或石灰石(主要成分是碳酸钙)
2.反应原理:
CaCO3+2HCl=CaCl2+H2O+CO2↑
注意 (1)不能用碳酸钠代替石灰石或大理石,因为它和稀盐酸反应太快,不宜控制.
(2)不能用硫酸代替稀盐酸,因为它和石灰石或大理石反应生成的硫酸钙微溶于水,会覆盖在石灰石或大理石的表面,使反应自行停止.
(3)不能用浓盐酸代替稀盐酸,因为浓盐酸挥发性强,使生成的二氧化碳中混有较多的氯化氢气体.
3.实验装置
因为实验室制取二氧化碳是用固体和液体在常温下的反应,因此可用下图装置.
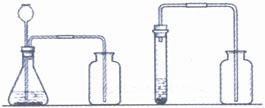
图6-5 制取二氧化碳
注意 (1)长颈漏斗下端管口要伸入液面以下(防止生成的气体从长颈漏斗中逸出).
(2)导管要略出于橡皮塞(导管若伸入过长,则气体不易排出).
(3)导管应伸入接近集气瓶底部(以利于排净空气)
4.收集方法;向上排空气法(因为二氧化碳密度比空气大,且能溶于水,所以只能用向上排空气法).
5.操作:
(1)按图6-5所示连接实验装置,并检查装置的气密性.
(2)加入药品:先加固体,后加液体.
(3)收集二氧化碳
(4)验满:用燃着的木条放在瓶口,若木条熄灭,说明二氧化碳已满,若木条不熄灭,说明未满.
(5)放置:将导管取出,盖紧玻璃片,正放在桌上.
6.检验:将制得的气体通入澄清的石灰水中,若澄清的石灰水变浑浊,证明所制得的气体是二氧化碳.
上一篇:实验室制取气体的思路和方法
下一篇:初中数理化公式定理大全目录