化学键
出处:按学科分类—自然科学总论 天津人民出版社《自然辩证法辞典》第122页(976字)
指当原子结合成分子时,分子中邻近两个或多个原子之间主要的、强烈的相互作用。
多原子分子中原子之间的强烈相互作用只限于邻近两个原子。虽然非邻近的原子之间也有相互作用,但比前者弱得多(大约只有前者作用的百分之几)。所以说,只有邻近两个原子之间才有强烈的相互作用形成化学键。
如H2O分子中的氧原子分别和邻近两个氢原子具有强烈的相互作用形成两个化学键 ,并不是邻近三个原子共同组成一个化学键。
,并不是邻近三个原子共同组成一个化学键。
在多原子分子中,除了邻近两个原子之间具有强烈相互作用之外,还有邻近几个原子之间的强烈相互作用。这时,邻近几个原子之间共同组成一个化学键。
如苯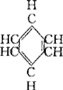 分子中,有相邻两个原子之间组成的碳氢键和碳碳键,又有相邻多原子间组成的六碳苯环一个化学键。
分子中,有相邻两个原子之间组成的碳氢键和碳碳键,又有相邻多原子间组成的六碳苯环一个化学键。
化学键有三种:第一类由金属原子和非金属原子之间结合,金属原子失去电子成阳离子,非金属原子得电子成阴离子。
阳、阴离子靠静电作用形成的化学键叫离子键,或叫电价键。如:NaCl、MgO、CaF2等离子化合物都属于这一类型。第二类:由非金属原子与非金属原子之间的结合,它们依靠共用电子对结合成分子的化学键,叫共价键。以共价键结合的分子在相邻原子之间用短线(-)表示化学键。
如:H-H、O=O、N≡N、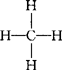 、
、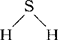 第
第
三类:由金属晶格中金属原子之间的结合,叫金属键。金属双原子分子之间是以共价键结合的。
化学键形成的过程就是吸引与排斥对立统一变化的过程。吸引与排斥是化学键的本质。
化学的吸引与排斥是质点间的相互作用。吸引,对质点间是束缚;排斥,对粒子质点间是伸展。
由于电子运动本身产生电磁力场,所以,化学键性质的本质是电性的。化学吸引作用的实质就是电磁作用;化学排斥作用来自原子核之间、核外电子之间的同电荷电性排斥作用。当然,也表现在自旋平行电子之间的排斥作用。成键过程中原子或原子团的平动、转动、振动所产生的能量也会使电子的排斥作用增大。
总之,吸引与排斥的作用贯穿于整个化学运动中。化学键理论的研究将会引起化学史上第三次大突破。
它将在揭示物质性质及物质结构的本质联系,研制新材料、探索新能源、研究生命现象、模拟生命体内的化学变化过程等各个方面提供较充实的理论根据。