急性白血病
出处:按学科分类—医药、卫生 科学技术文献出版社《血液内科疾病诊断标准》第116页(10828字)
(一)概述
急性白血病(acute leukemia,AL)是获得性造血祖细胞突变而引起的克隆性疾病,特点为骨髓中某系原始、幼稚细胞明显增生而分化受阻,同时抑制正常造血。外周血白细胞有量与质的异常,常伴贫血和血小板减少。临床主要表现为发热、感染、出血及脏器的白血病细胞浸润。
(二)流行病学
20世纪80年代我国22个省、市、自治区的6000余万人群的流行病学调查,发现白血病的发病率为2.71/10万,急性髓细胞白血病(AML)为1.6/10万,急性淋巴细胞白血病(ALL)为0.67/10万,居全部白血病的前2位占83.5%。AML随年龄增长,发病率逐渐上升,50~59岁为高峰。ALL在9岁前为发病高峰,此后逐渐下降,30岁后趋于稳定。男性发病高于女性。
(三)病因
1.化学物质 长期密切接触有机溶剂,尤其是苯类化合物者,其发生AL危险是普通人群的5~6倍。长期应用烷化剂或鬼臼毒素者,发生白血病的危险较正常人高250倍以上。
2.电离辐射 1984年全国26个省、市、自治区调查30年内从事临床X线工作者2万余人,白血病的标化发生率是对照组的3.5倍。日本遭原子弹爆炸辐射影响的人群,白血病发生率是正常人群的4~40倍,且和受辐射的剂量成线性关系。
3.遗传 白血病高危家族中有较高白血病发生率,是正常家族的16倍,同卵双胎之一发生白血病后,其同胞在1年内发生白血病的机会是正常人群的5倍。
4.病毒 1980年首次证实成人T细胞淋巴瘤病毒是成人T细胞白血病淋巴瘤(ATL)的病因,此后美国及我国学者在ATL中找到了同样的病毒。但除ATL以外的白血病尚未发现相关的病毒病因。
(四)发病机理
AL的发病机理也未明确。目前根据同一AL患者有同样异常的细胞遗传学特征及相应的异常融合基因,以及用一种葡萄糖—6—磷酸脱氢酶的同工酶,确定AL是克隆性疾病;了解到AL细胞在体外培养时的生长方式不同于正常造血细胞,并和几种造血生长因子及抑制因子的失衡有关;从细胞动力学研究结果显示,AL时促进白血病细胞周期运行因子占优,而抑制因子处于劣势,从而造成白血病细胞过度增殖。但由于分化、成熟受阻,造成白血病细胞大量堆积,浸润组织和脏器。
(五)分类
AL按国际分类有急性髓细胞白血病(AML)和急性淋巴细胞白血病(ALL)两大类,每一类又分若干亚型。根据AL的临床四大征象即浸润、贫血、出血、发热,外周血白细胞量异常伴数量不一的白血病细胞,骨髓某系白血病细胞≥20%,即可诊断AL。
1976年法、英、美三国制订了FAB分型诊断标准,1985年以后又有多次小的修正。目前FAB的分型诊断标准已为世界各国广泛应用,虽然近年世界卫生组织(WHO)提出了新的分型诊断标准,目前已逐渐被广泛采用(见图3—1、图3—2、图3—3),现介绍FAB分型诊断标准要点如下。

图3—1 ALL—L骨髓象

图3—2 ALL—L骨髓象

图3—3 ALL—L骨髓象
1.ALL(表3—1
表3—1 急性淋巴细胞白血病各亚型细胞特征

2.AML
(1)急性粒细胞白血病未分化型(M1):骨髓中原始粒细胞≥90%(非红系细胞),早幼粒细胞很少,中幼粒细胞以下阶段不见或罕见(见图3—4)。

图3—4 AML—M骨髓象
(2急性粒细胞白血病部分分化型(M2):分为以下两种亚型。
1M2a:骨髓原始粒细胞30%~90%(非红系细胞),单核细胞<20%,早幼粒细胞以下阶段>10%(见图3—5)。

图3—5 AML—M2a骨髓象
2M2b:骨髓中原始及早幼粒细胞明显增多,以异常的中性中幼粒细胞增生为主,其胞核常有核仁,有明显的核浆发育不平衡,此类细胞>30%(见图3—6)。

图3—6 AML—M2b骨髓象
(3)急性颗粒增多的早幼粒细胞白血病(M3):骨髓中以颗粒增多的异常早幼粒细胞增生为主>30%(非红系细胞),其胞核大小不一,胞质中有大小不等的颗粒(见图3—7)。分为以下两种亚型:

图3—7 AML—M3骨髓象
1)M3a(粗颗粒型):嗜苯胺蓝颗粒粗大,密集甚或融合。
2)M3b(细颗粒型):嗜苯胺蓝颗粒密集而细小。
(4)急性粒—单核细胞白血病(M4)(见图3—8):按粒系和单核细胞系比例不同,包括下列4种类型。

图3—8 AML—M4骨髓象
1)M4a:原始和早幼粒细胞增生为主,原始、幼稚单核和单核细胞≥20%(非红系细胞)。
2)M4b:原始、幼稚单核细胞增生为主,原始和早幼粒细胞>20%(非红系细胞)。
3)M4c:原始细胞既具粒细胞系,又具单核细胞系形态特征者>30%(非红系细胞)。
4)M4E0:除上述特点外,还有粗大而圆的嗜酸颗粒及着色深的嗜碱颗粒占5%~30%(非红系细胞)。
(5)急性单核细胞白血病(M5):分为两种亚型。
1)未分化型(M5a):骨髓中原始单核细胞(Ⅰ型十Ⅱ型)(非红系细胞)≥80%(见图3—9)。

图3—9 AML—M5骨髓象
2)部分分化型(M5b):骨髓中原始和幼稚单核细胞Ⅲa(非红系细胞)>30%,原始单核细胞(Ⅰ型+Ⅱ型)<80%。
(6)红白血病(M6):骨髓中红细胞系>50%,且有形态学异常,骨髓非红细胞系原始粒细胞(或原始+幼稚单核细胞)Ⅰ型+Ⅱ型>30%;若血片中原始粒细胞或原始单核细胞>5%,骨髓非红系细胞中原始粒细胞或原始+幼稚单核细胞>20%(见图3—10)。
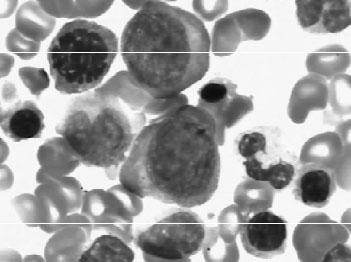
图3—10 AML—M6骨髓象
(7)急性巨核细胞白血病(M7):外周血中有原始巨核(小巨核)细胞;骨髓中原始巨核细胞≥30%;原始巨核细胞有电镜或单克隆抗体证实;骨髓细胞少,往往干抽,活检有原始和巨核细胞增多,网状纤维增加。AML各亚型常和免疫表型、染色体异常及相应的融合基因有对应关系(见图3—11)。

图3—11 AML—M7骨髓象
(六)临床表现
骨髓内白血病细胞大量增殖,致正常造血受抑,同时又广泛浸润全身各器官和组织,构成AL各种临床表现的病理基础。部分患者以发热、出血等表现急性起病;另一部分患者以贫血或浸润缓慢发病。约20%的AML经历数月,甚至数年的贫血—出血倾向,各种血细胞减少及骨髓各系细胞呈病态造血后,逐渐演变为AL,这段病程命名为骨髓增生异常综合征(MDS),又称白血病前期。
1.白血病浸润
(1)淋巴结、脾、肝肿大:淋巴结大多为轻至中度肿大,直径通常<2mm。脾肿大在肋缘下3cm之内,肝肿大程度更轻。肿大的肝、脾、淋巴结质地呈中等硬度,表面光滑,无压痛,肿大程度均以ALL明显;AML大多均为轻度肿大,或无淋巴结及肝脾肿大。
(2)骨关节痛:30%~50%的患者有明显的胸骨中下段压痛,压痛甚剧,提示白血病,有较强特异性。少数ALL患者可诉骨、关节痛,以四肢长骨为主。骨内白血病细胞大量增生,致髓腔压力增高,或侵及皮质和骨膜,是疼痛的原因。
(3)中枢神经系统白血病。
(4)皮肤病损:有皮肤浸润者常伴其他髓外病变,以ALL及AML中的M4、M5亚型多见。皮损可为特异性的白血病细胞浸润所形成的结节甚至肿块,也可为非特异性的斑丘疹、红皮病。少数患者出现疱性脓皮病,可伴溃疡,出现疼痛,镜下为成熟的中性粒细胞浸润,称为Sweet综合征,皮质激素治疗有效。
(5)原粒细胞瘤:主要见于AML,为原始细胞在某一部位集结形成的瘤块,又名“绿色瘤”。肿瘤组织经HE染色在光镜下形态酷似淋巴瘤细胞,易误诊为淋巴瘤。此种细胞的氯醋酸酯酶或抗溶菌酶抗体染色呈阳性,髓细胞单抗荧光染色也呈阳性,借此和淋巴瘤细胞相鉴别。原粒细胞瘤好发于骨膜、硬脑膜,常侵及颅骨,尤其眼眶,造成眼球突出,也可侵及皮肤、淋巴结、乳房、外阴等软组织。多见于M1、M2型,少见于M4、M5型,可作为AML的首发表现。另有文献报道,MDS、骨髓增生性疾病(MPD)时也可并发原粒细胞瘤,预示已发生急性白血病(AML)转化。
(6)牙龈增生:系白血病细胞浸润牙龈所致。常伴继发感染,使牙龈肿胀更明显。严重者其牙龈呈前后分层排列,称为“城墙样”改变,最多见于M4及M5型,也见于其他各型AML,少数伴高白细胞血症的ALL患者也可并发。
(7)其他部位浸润:少数病例回盲部肠壁被浸润,加之因粒细胞缺乏伴发的感染,可导致肠壁坏死,临床出现肠梗阻征象,称为盲襻综合征。肺部浸润少见,常因高白细胞血症,影像学检查显示间质细小结节浸润,或肺纹理明显增多。浸润眼底表现为带白鞘的视网膜静脉扩张,或含“白心”的出血斑,如发生在黄斑及附近区域,可影响视力。浸润内耳可引起眩晕、耳鸣、听力下降。睾丸浸润主要见于儿童ALL患者,但也可见于极少数AML患者,表现为单侧或双侧睾丸肿大,质较硬,无压痛。AML的各种浸润频率及程度均低于ALL,但M4、M5型及伴高白细胞白血症时,浸润也较突出。
2.出血倾向 血小板减少是最主要的原因,部分患者尚可并发血小板功能障碍,或凝血/纤溶异常造成出血。以AML的M3型最为常见,也可见于AML的其他亚型及ALL。自从采用全反式维甲酸诱导治疗AML的M3型后,DIC已大为减少。此外,高白细胞血症时大量白血病细胞在小血管淤滞及浸润血管壁、化疗药物损伤肝脏致凝血因子生成减少,以及因感染引起的高热,均可加重出血倾向。临床上以自发的皮肤、黏膜出血最常见,如皮肤出血点、淤斑、牙龈渗血、鼻出血、眼底出血及月经过多或淋漓不尽。严重者可伴发内脏出血,消化道、泌尿道出血较常见,如并发颅内出血可迅速致死。
3.贫血 红细胞生成减少及红细胞无效生成是贫血的主要原因,以中、重度贫血多见。少数患者可因出血或并发的溶血而加重贫血。主要表现为面色苍白、头晕、乏力、心悸,严重者可发生晕厥或心力衰竭。以贫血为主要临床表现者,AML多于ALL。
4.感染、发热 骨髓正常粒系造血受抑,致中性粒细胞减少或缺乏是感染的主要原因。据北京协和医院资料显示,感染的主要部位依次是肺、口咽、外阴及肛周皮肤、尿道、鼻窦,与国际报道相似。
(1)由于中性粒细胞缺乏,炎症反应不甚典型,缺乏相应的症状和体征,或程度轻。如肺部感染时脓痰少、肺部啰音少、胸部X线片的炎症阴影浅淡,甚至缺如;皮肤、软组织感染时典型的红、肿、热、痛少见或程度轻;肛周感染时形成脓肿者少。
(2)感染局限能力差,易扩散成败血症,来势凶猛,进展迅速,病死率高。
(3)细菌感染以革兰阴性杆菌居多,其中铜绿假单胞菌占有重要地位。部分患者为革兰阳性球菌感染,且近几年有增加趋势,最常见为表皮葡萄球菌,尤其多见于长期静脉插管者;其次为金黄色葡萄球菌感染。
(4)由于不少患者长期使用广谱抗生素,易引起口咽及肠道菌群失调,合并真菌感染的机会增多,并发原虫及病毒感染者也较多。反复输血后常并发丙型或乙型肝炎病毒感染。
(5)白血病细胞广泛浸润及化疗、皮质激素的应用,破坏了黏膜的屏障机理,原来存在于口咽、消化道、呼吸道的微生物及其毒素易通过损伤的黏膜进入循环和组织,故内源性感染占相当比例。
此外,发热也可由白血病本身所致,即肿瘤性发热,但发生率远低于感染,故在原因未明确前应优先考虑感染。某些抗白血病药物,如左旋门冬酰胺酶、阿糖胞苷、高三尖杉酯碱等也可引起药物热,鉴别要点是发热与用药关系密切。
(七)诊断方法
1.病史 证实为贫血引起的症状和(或)出血倾向,即要考虑血液病的可能。如同时并发骨痛和(或)反复发热的病史,则要高度疑似AL。
2.体格检查 皮肤浸润性皮损、胸骨压痛、浅表淋巴结和(或)肝脾肿大是AL浸润所致的主要体征。苍白、皮肤出血点和淤斑、牙龈渗血和(或)口腔黏膜血疱等是贫血及血小板减少造成的结果。发热伴各感染部位发生的相应体检异常是中性粒细胞生成受抑的后果。上述各类体征的组合出现,是AL重要的临床信号,其中以各种浸润表现尤其是胸骨压痛或牙龈明显增生最具诊断价值。
3.实验室检查
(1)血常规:诊断时50%以上的患者白细胞升高,20%的患者可>100×109/L,称为高白细胞血症,50%以下的患者正常或减少。血涂片中出现白血病细胞。少数患者白细胞正常或减少,又无白血病细胞出现于外周血中,称为非白血病性白血病,易误诊、漏诊。ALL时白细胞升高比例明显高于AML。诊断时大部分患者有贫血,属正细胞正色素性贫血。血涂片中可见少数有核红细胞。AML时发生贫血的比例及程度均明显高于ALL。血小板减少见于大多数AL患者,血小板常<50×109/L,严重者可<10×109/L,偶见明显升高者。化疗后血小板逐渐上升者,是AL缓解的先兆信号。部分ALL患者诊断时血小板尚在正常范围内。
(2)骨髓象:多数患者增生明显或极度活跃,原始和幼稚细胞大量增生(20%~90%以上),但少数AML患者骨髓显示增生低下。白血病细胞在各类AL的形态学特征见表3—2。
表3—2 各类AL白血病细胞形态学特征

骨髓中正常的红系及巨核系细胞常明显受抑,但AML的M6型时,异常形态的红细胞系可明显增生,甚至>50%,血小板常少见。部分患者由于骨髓过度增生或增生低下或纤维组织增生,穿刺出现“干抽”现象。此时应以环形针行骨髓活检,活检的骨髓组织制成病理切片有助于诊断。
(3)细胞化学染色:ALL和AML区分,AML各亚型间的鉴别,单靠瑞氏染色的光镜检查常有困难,故每例患者均应常规行细胞化学染色观察,再结合形态进行正确分型。具体各型AL的细胞化学染色特点见表3—3。
表3—3 各型急性白血病的细胞化学染色特点

上述各种细胞化学染色应有针对性地选用。为鉴别AML和ALL,应常规做过氧化物酶或苏丹黑染色;为区分粒系和单核系应做酯酶染色;疑M6型者可行糖原染色;为诊断M7型,则应做血小板过氧化物酶染色,并在电镜下观察。
(4)免疫分型:采用单克隆抗体检测不同系列、不同分化阶段血细胞膜/细胞质的抗原,即为免疫分型。由于至今尚未发现白血病细胞的特异性抗原,免疫分型并不能区分正常细胞或白血病细胞,只能判定细胞的成熟、分化阶段和系列来源,为分型提供依据。目前国际上提出分化群(Clusters of differen,CD)命名法,CD既代表抗原,也表示相应的抗体。用多种抗髓系及抗淋巴系的单抗,可区分90%~99%的AML和ALL的亚型。其中干/祖细胞标志为CD34、CD117、CD38,髓系标志为CD33、CD13、CD14、CD15、CD116及cMPO。淋巴系B细胞标志为CD19、CD20、CD10、HLA—DR及TdT,T细胞标志为CD2、CD5、CD7、CD1及TdT。AML、ALL各亚型的免疫表型见表3—4。
表3—4 AML各亚型的免疫表型

另有一亚型M0,其形态似原始淋巴细胞,但淋巴系相关分化抗原均阴性,而CD34、CD38、CD117、HLA—DR、CD33及CD13阳性。过氧化物酶染色阴性,但电镜下cMPO阳性。
免疫分型的可靠性取决于单抗的质量及检测方法。流式细胞术(FCM)检测,客观、精确、快速,且可同时测定多个参数,已逐渐推广使用(表3—5、表3—6)。
表3—5 ALL B细胞各亚型的免疫表型

表3—6 ALL T细胞各亚型的免疫表型

(5)细胞遗传学:半数以上的AL患者存在非随机获得性克隆性染色体异常。可为单一染色体的增加或丢失,也可为两种或两种以上的染色体异常。部分染色体异常具亚型特异性,如t(8;21)见于AML的M2型,t(15;17)见于AML的M3型,inv(16)、del(16q)见于AML的M4E0型。具上述染色体异常者预后较好,而其他染色体异常多无亚型特异性,预后较差。
(6)分子生物学:由染色体易位致基因断裂,形成新的融合基因,目前已可用分子生物学技术测定,并应用于临床。29%~40%的AML M2型有t(8;21),生成融合基因AML1/ET0;大多数AML的M3型有t(15;17),形成融合基因PML/RARα。少数M3型为t(5;17),形成融合基因NPM/RARα。也可为t(11;17),形成融合基因PLZF/RARα;M4E0有inv(16),形成MYH11/CBFβ融合基因;M5型中部分患者有t(11;9),形成MLL/AF9融合基因,也有为t(11;19),形成MLL/DNL融合基因。
(八)鉴别诊断
1.类白血病反应 大多表现为血白细胞增高、血片中出现中幼粒、晚幼粒阶段的幼稚细胞,酷似慢性髓细胞白血病(CML)的血象。但少数出现以下两种血象:①血白细胞升高,血片中出现原始、早幼粒阶段的幼稚细胞;②血白细胞减少,血片和骨髓中出现原始、早幼粒阶段的幼稚细胞,甚至伴贫血和(或)血小板减少,酷似急性白血病。
鉴别点:①类白血病反应一定有原发病。最常见为严重感染,尤其是播散性结核病,其他为风湿性疾病、药物过敏反应、重症肝病及肿瘤;②血片中性粒细胞碱性磷酸酶染色,阳性率及积分明显升高;③血象及骨髓象改变在短期内有波动,而急性白血病如不治疗,则恶化;④随原发病好转或痊愈,血液学改变逐渐消失。
2.骨髓增生异常综合征(MDS) MDS缓慢发病,以贫血为主,常伴白细胞或(和)血小板减少,血片中出现少量原始细胞,故有和急性白血病相似之处。鉴别点:①MDS发热、浸润征象少见;②骨髓原始细胞<30%,且存在病态造血现象。
近来WHO在AL新分类中已将MDS中的难治性贫血伴正在转变中的原始细胞增多(RAEB—T)划入急性白血病范畴,改变了FAB协作组诊断标准,即将对骨髓中白血病细胞≥30%诊断为急性白血病的标准,更改为≥20%,故RAEB—T无需再和急性白血病鉴别。目前该标准尚未被世界各国接受,我国仍沿用FAB标准。
3.恶性组织细胞病(MH) MH常具急性白血病的4大临床特征。鉴别点:①MH常呈持续高热、进行性衰竭、明显的肝功能损害、化疗反应差,均有别于急性白血病;②骨髓中异常组织细胞呈明显的多形性,占有核细胞比例,常<30%。而急性白血病细胞具高度的均一性,占有核细胞比例均≥30%,其中大多>60%。此外,两者的幼稚细胞组化染色及免疫表型也不同。
4.再生障碍性贫血(AA) 易与低增生性白血病混淆,通过骨髓检查可鉴别。全血细胞减少为AA的特征,而在急性白血病也十分常见。鉴别点:①AA无白血病浸润征象;②血片中成熟淋巴细胞增多明显;③骨髓大多增生低下,也以成熟淋巴细胞为主,常见以骨髓支架细胞组成的再障群。如取材不佳,两者难以区别时,可做骨髓活检排除急性白血病。
5.阵发性睡眠性血红蛋白尿症(PNH) PNH的不发作组常呈全血细胞减少,网织红细胞也不升高,临床既无酱油尿,又无黄疸,故有时需和非白血病性白血病鉴别。①PNH除部分患者脾轻度肿大外,无浸润现象,发热感染、出血也较少见;②反映PNH红细胞膜缺陷的Ham、糖水试验阳性,血CD55、CD59阴性细胞明显增多;③骨髓检查很易将两者区分。
6.巨幼细胞贫血(MA) 部分MA可出现全血细胞减少,骨髓中红系增生伴巨型变,故有时需和急性白血病尤其是M6型相区别。①MA常有明显的营养不良史;②感染及出血少见;③舌如鲜牛肉样,即舌质鲜红,光滑无苔;④血清叶酸或维生素B12降低,或红细胞叶酸降低;⑤血片中性粒细胞分叶过多。⑥骨髓红、粒系均巨型变,无白血病细胞;⑦叶酸、维生素B12治疗反应良好,用药3~4周血象迅速恢复正常。
7.脾功能亢进 患者脾明显肿大,血细胞各系先后或同时减少。和急性白血病鉴别点:①常伴肝病或(和)门静脉高压征象;②除脾肿大外,无其他浸润表现;③少有感染、发热以及出血;④骨髓增生活跃,但无白血病细胞。
8.AML与ALL鉴别 两者的鉴别也有重要的临床意义,因为治疗方案的选择、化疗的持续时间及预后均不同。两者鉴别点:①年龄发病高峰,ALL在儿童期,AML则在50岁后;②白血病浸润,ALL较AML显着,浅表淋巴结及肝脾肿大的频率及程度、髓外浸润病变(如皮肤结节、中枢神经系统白血病、睾丸白血病等)的发生率,ALL均显着高于AML;③血象异常,血白细胞升高的频率、程度,以及高白细胞血症的发生率,ALL也均高于AML。两者最终确诊依据是形态学、细胞化学染色、免疫表型检查,部分病例染色体及基因检测也有助于鉴别。
此外,少数AL同时累及髓细胞及淋巴细胞系,称为急性混合细胞白血病(acute mixed leukermia),需分别和AML及ALL鉴别。急性混合细胞白血病的诊断,需综合考虑形态学、细胞化学、免疫表型及基因重排(如IgH及TcR基因重排)的检验结果。1992年Catovsky提出的积分系统对诊断有重要价值,(表3—7)。
表3—7 1992年Catovsky积分系统

根据上述积分,如同时发现有淋巴细胞系及髓细胞系,总积分≥2.5诊断为急性混合细胞白血病。以往大多将ALL中同时存在B及T细胞表型者,也列入混合细胞白血病,目前国际上已排除。