糖尿病的分型与诊断
出处:按学科分类—医药、卫生 科学技术文献出版社《内分泌科疾病诊断标准》第107页(13770字)
一、糖尿病发展阶段
在不同类型糖尿病之间,其病因和发病机制较为复杂,发展阶段亦不相同。总的来说遗传因素及环境因素共同参与其发病过程。
(一)1型糖尿病
目前普遍认为1型糖尿病的发生、发展可分为6个阶段。
第1期:遗传学易感性。
人类HLA位于第6对染色体短臂上,是一组密切联系的基因群。研究发现1型糖尿病与某些特殊HLA类型有关。70年代发现1型糖尿病中,Ⅰ类等位基因B15、B8及B18出现频率高,而B7出现频率低;以后又发现Ⅱ类基因位点中的DR3和DR4与1型糖尿病呈高度的阳性相关性,与DR2呈阴性相关。随着分子生物学和分子遗传学的发展,通过全基因组筛查研究,确认了两个重要的易感基因,即IDDM1和IDDM2,分别构成遗传因素的40%和10%。易感基因的研究发现只能提示个体对该病的易感性,不能完全解释1型糖尿病家族的聚集性,但可以肯定的是1型糖尿病的发病与多个易感基因的共同作用及环境因素的影响有关。
第2期:启动自身免疫反应。
众所周知,1型糖尿病的发病是受环境因素的影响。目前认为有些环境因素可启动胰岛β细胞的自身免疫反应,至今未完全明了,但病毒感染是最重要的环境因素之一。已知与1型糖尿病有关的病毒有柯萨奇B4病毒、腮腺炎病毒、风疹病毒、巨细胞病毒和脑炎心肌炎病毒等。许多有关报道表明人类对病毒诱发糖尿病的易感性受遗传控制,病毒感染可直接损伤胰岛组织引起糖尿病,也可能损伤胰岛组织后,诱发自身免疫反应,进一步损伤胰岛组织引起糖尿病。
第3期:免疫学异常。
经过WHO认定,1型糖尿病在发病之前常经过一段糖尿病前期,此时患者处于糖耐量正常阶段,但由于自身免疫反应,其体内会出现一组自身抗体,主要有三种:①胰岛细胞自身抗体(ICA);②胰岛素自身抗体(IAA);③谷氨酸脱羧酶自身抗体(GAD),其中以GAD更具敏感性、特异性强、持续时间长,有助于区分1型和2型患者,并提示应及早应用胰岛素治疗。
第4期:进行性胰岛β细胞功能丧失。
不同病例在此期长短不一,通常先有胰岛素分泌第1相降低,以后随着β细胞数量减少,胰岛分泌功能下降,血糖逐渐升高,最终发展为临床糖尿病。
第5期:临床糖尿病。
患者在此期可出现明显高血糖,有部分或典型糖尿病症状。
第6期:一般在1型糖尿病发病后数年,患者多数胰岛β细胞完全破坏,胰岛素分泌第一相及第二相水平均极低,糖尿病的临床表现明显。
(二)2型糖尿病
第1期:遗传易感性。
多年来通过一系列研究,现一致认为2型糖尿病有更明显的遗传基础,虽细节尚未完全明了,但普遍认为它具有广泛的遗传特异性,是多基因疾病,临床表现差别较大。此外,其发病也与环境因素有关,其危险因素包括老龄化,体力活动减少,中心性肥胖(又称腹内型或内脏型肥胖),不健康的饮食习惯等。
第2期:胰岛素抵抗和高胰岛素血症。
胰岛素抵抗(IR)是指机体对一定量胰岛素的生物学反应低于预计正常水平的一种现象。目前一般认为,胰岛素抵抗和胰岛素分泌缺陷是2型糖尿病发病的基础。当胰岛β细胞能够代偿胰岛素抵抗,血糖浓度仍可维持正常。但当机体不能代偿由胰岛素抵抗造成的血糖升高时,血糖水平持续高出正常范围,最终导致2型糖尿病的发生。因此,胰岛素抵抗是贯穿于2型糖尿病整个发生、发展过程中的重要因素。
另一变化是胰岛素分泌异常。糖耐量正常(NGT)静脉注射25g葡萄糖所诱导的胰岛素分泌呈双峰。早期分泌高峰(第一相,即刻相)出现在头10分钟,是一个很高的峰值,但持续时间仅有数分钟。随后迅速下降,接着是第二时相(延迟相),由于血糖水平随即下降,故正常人胰岛素分泌的第二时相曲线较为低平。在从NGT到IGT的演变过程中,其第一时相和第二时相分泌向相反方向发展,最先发生改变的是第一时相胰岛素分泌的减少或消失,接着是第二时相分泌量的增加及分泌峰值的后移,因而有些患者在此阶段可出现餐后低血糖。2型糖尿病患者会出现第二时相无峰值出现,最后第二时相基础分泌也渐消失,此时血糖可逐渐升高。此期间对糖尿病的初级预防很重要,改变危险因素有助于延缓糖尿病的发生,降低患病率。
第3期:糖耐量减低(IGT)。
糖耐量减低(IGT)是葡萄糖不耐受的一种类型,现普遍将其视为糖尿病前期。IGT代表了正常葡萄糖稳态和临床糖尿病高血糖之间的中间代谢状态,表明其稳态受损。目前认为IGT为发生糖尿病的危险因素,也是发生心血管病的危险标志。
第4期:临床糖尿病。
此期血糖肯定升高,并达到糖尿病的诊断标准。可无明显症状,或逐渐出现代谢紊乱症候群,或出现糖尿病并发症的表现。
上述是2型糖尿病发生、发展的4个阶段,但Groop将2型糖尿病的进程划分为3个阶段:
第一阶段:称为“正常葡萄糖耐量阶段”,以胰岛素抵抗、不同程度的空腹高胰岛素血症、肥胖、收缩压升高为主要表现。
第二阶段:是IGT阶段,这一阶段的主要表现是胰岛素抵抗、空腹高胰岛素血症、餐后高血糖大血管病变、微量白蛋白尿。
第三阶段:则是糖尿病阶段。
Groop推荐的这种划分方法更有利于2型糖尿病的流行病普查和临床诊断,以达到早期预防和早期治疗的目的,同时可以帮助我们加深对2型糖尿病的代谢障碍、遗传缺陷和临床表现的理解。
总之,2型糖尿病的出现比我们想像得要早,而且其只是“冰山的一角”,糖尿病患者在诊断时往往已经出现微血管和大血管并发症。胰岛素抵抗和高胰岛素血症的出现可以提示我们早期诊断2型糖尿病。有研究指出,从血糖升高到出现临床症状的期间平均可长达7年,在被诊断为2型糖尿病的患者中,有40%存在大血管并发症,40%存在微量白蛋白尿,15%存在视网膜病变,50%有高血压,50%有高甘油三酯血症,故早期适时减轻胰岛素抵抗是预防和延缓2型糖尿病和胰岛素抵抗(IR)发生和发展的关键。
二、糖尿病的分类分型
目前用于临床的糖尿病分类分型,是世界卫生组织(WHO)糖尿病专家委员会于1985年推荐的。在世界范围内对糖尿病的病因、发病机制、流行病学、预防、治疗和预后等各方面的研究都取得了新的进展,有了很多新的认识,原有的糖尿病分型已不适应新的形势。为此,1997年7月ADA糖尿病诊断及分型专家委员会正式发表报告,对糖尿病分型及诊断标准提出了新建议。本次会议讨论了糖尿病及其并发症的诊断标准和分型,提出了初步建议和草案,并与世界卫生组织(WHO)糖尿病专家委员会达成共识。
1985年WHO分型见表12-1,新分型结合近十余年来的研究成果提出修改和建议见表12-2。
表12-1 糖尿病及其他类型糖耐量异常的分类(WHO,1985)


表12-2 关于糖尿病分型新建议(ADA,1997)



新分型与1985年WHO分型比较有以下特点:
(1)保留了1985年WHO分型的基本格局,但侧重从病因学角度进行分型。
(2)取消过去沿用的IDDM(胰岛素依赖型糖尿病)和NIDDM(非胰岛素依赖型糖尿病)名称,并建议用阿拉伯字1和2取代过去Ⅰ型和Ⅱ型糖尿病中的罗马字Ⅰ和Ⅱ。因为IDDM和NIDDM的分型是依据治疗而不是基于病因,这一更改,在临床上可解除给患者带来的误解,有利于合理和有效使用胰岛素治疗。
(3)1997年分型中的1型糖尿病也包括既往的IDDM,是指有β细胞破坏,引起胰岛素绝对缺乏,但不包括因非自身免疫的特异性原因引起的β细胞破坏。
(4)2型糖尿病:包括有胰岛素抵抗和胰岛素分泌缺陷的糖尿病患者,其病因还不完全清楚。一般大部分患者有超重或肥胖。
(5)保留妊娠糖尿病,本型是在确定妊娠后发现的糖尿病,包括各种程度的糖耐量减低,不包括已诊断糖尿病后妊娠者,此种情况为糖尿病合并妊娠。
(6)取消营养不良相关性糖尿病,将之归类于特殊类型中胰腺外分泌疾病所致的糖尿病。
(7)提出特殊型糖尿病,其中包括1985年WHO分型中所有继发性糖尿病,同时还包括归属了病因或发病机制已明和新近发现的糖尿病,以及由于原发性缺陷引起的糖尿病。
(8)不将糖耐量减低作为一个亚型,而是糖尿病发展过程中的一个阶段。
总之,现在对1型和2型的病因尚未完全明了,所以新的分型不是最后分型,今后随着新的认识和发现,糖尿病的分型必将进行不断的修改。
三、糖尿病的诊断标准
1980年以来,国际上通用WHO的糖尿病诊断标准,而美国糖尿病协会(ADA)在1997年提出修改糖尿病诊断标准的建议如下。
1.有糖尿病症状并且随机血浆葡萄糖浓度≥11.1mmol/L(200mg/dl)或空腹血浆葡萄糖浓度≥7.0mmol/L(126mg/dl)或OGTT 2小时血浆葡萄糖浓度≥11.1mmol/L(200mg/dl)即可诊断糖尿病。如症状不典型者,需另外1日再次证实。
2.空腹血浆葡萄糖(FPG)的分类
(1)FPG<6.0mmol/L(110mg/dl)为正常FPG水平。
(2)FPG≥6.0mmol/L(110mg/dl)并且<7.0mmol/L(126mg/dl)为空腹血糖过高(IFG)。
(3)FPG≥7.0mmol/L(126mg/dl)并需另外1日再次证实,可诊断为糖尿病。空腹血糖的定义是至少8小时没有热量的摄入。
3.OGTT中2小时血糖(2hPG)的分类
(1)OGTT 2hPG<7.8mmol/L(140mg/dl)为正常的葡萄糖耐量。
(2)OGTT 2hPG≥7.8mmol/L(140mg/dl)并且<11.1mmol/L(200mg/dl)为葡萄糖耐量低减(IGT)。
(3)OGTT 2hPG≥11.1mmol/L(200mg/dl)并需另外一天再次证实,可诊断为糖尿病。
在ADA新的糖尿病诊断依据中,将FPG由7.8mmol/L降为7.0mmol/L的依据是因为①OGTT-2hPG≥11.1mmol/L诊断的糖尿患者中,约30%以上的患者FPG<7.8mmol/L,故不做OGTT,则约有1/3患者会漏诊;②国外研究表明FPG≥7.0mmol/L对糖尿病的诊断与OGTT-2hPG≥11.1mmol/L的符合性较好;③FPG≥7.0mmol/L时小血管并发症的危险性已有增加。
现取消糖耐量减退(IGT),提出空腹血糖过高(IFG)的新概念,如果FPG在6.0mmol/L(110mg/dl)~7.0mmol/L(126mg/dl)即可诊断为IFG。并认为IGT和IFG是介于正常血糖和糖尿病之间的一个代谢阶段,IGT不是独立的临床疾病,而被视为糖尿病进程中的一个中介阶段,并作为糖尿病心血管疾病的危险因子。
4.诊断时应注意
(1)血糖为葡萄糖氧化酶法测定的静脉血浆葡萄糖。
(2)对于无症状的患者,必须有两次血糖异常才能诊断。
(3)随机血糖不能用于诊断IGT和IFG。
(4)存在应激状态(感染、创伤、手术等)时,严重的高血糖是短暂的,不能作为糖尿病的诊断,需以后复查血糖。
四、几种糖尿病类型的鉴别
(一)成人隐匿性自身免疫糖尿病(LADA)
1.定义 成人隐匿性自身免疫糖尿病(latent autoimmune diabetes of adults,LADA)是从2型糖尿病(DM)患者中筛选出来的1型DM,是T淋巴细胞介导自身免疫性疾病。
这类患者有以下特点
(1)疾病性质属自身免疫性,为1型糖尿病。
(2)起病晚、成年方出现。
(3)起病方式缓慢,有较长阶段,至少半年呈非胰岛素依赖状态,以区别于一般认识的多在儿童或青少年急性起病、迅速呈胰岛素依赖状态的1型糖尿病。
LADA与经典的1型DM一样具有HLA易感基因、胰岛自身抗体和胰岛素分泌缺乏等特点,不同之处在于LADA的胰岛β细胞所受免疫损害呈缓慢性发展,使得患者在早期临床表现与2型糖尿病相似,具有一定的胰岛功能,可以在相当一段时间内不依赖胰岛素治疗。
研究提示LADA在病程的某一阶段胰岛功能以不同速度进行性减退,直至成为胰岛素依赖。而且其发病年龄越轻、BMI越小者其胰岛功能下降得越快,年轻发病者β细胞功能呈线性、快速衰竭而年长者其进展速度明显减慢;BMI亦呈类似规律,这也是英国前瞻性糖尿病研究(UKPDS)的研究结果所提示的。
2.临床表现及诊断
(1)临床表现:LADA多表现为口服降糖药无效,C肽水平逐渐降低,需依赖胰岛素治疗才能生存,谷氨酸脱羧酶抗体(GAD-Ab)和(或)胰岛细胞抗体(isletcell antibody,ICA)阳性。
(2)诊断:对于LADA的诊断,目前尚无统一标准,可从临床代谢特征、免疫病理标志和易感基因三方面加以探讨。我们观察到,患者就诊时多有多饮、多食、多尿、消瘦或低体重(BMI<21kg/m2)、发病半年后自发酮症、较早出现磺脲类降糖药继发性失效、空腹血C肽<0.3nmol/L和(或)胰升糖素刺激后6分钟(或餐后2小时)血C肽<0.6nmol/L等临床代谢特点,但其独立诊断LADA的准确概率也只有0.3~0.5,这说明上述临床代谢特点只提供LADA诊断的线索,不能作为诊断的依据。
3.至于易感基因,国内外均报道LADA患者1型糖尿病易感基因频率较高,这些人类易感基因决定了1型糖尿病患者的遗传易感性,易感个体对环境因素,特别是病毒感染或化学毒性物质刺激的反应异常,直接或间接通过自身免疫反应,引起胰岛细胞破坏,以致胰岛素不足,遂发生1型糖尿病。但LADA的HLA基因型呈现种族差异,与儿童期起病的典型1型糖尿病不完全相同,且与正常人群有重叠,因此易感基因也不能作为LADA诊断的独立指标,仅起辅助作用。
目前认为最具诊断价值者为血清胰岛细胞自身抗体测定。1型糖尿病是一种以免疫异常为主的疾病,在临床发病前多年已存在自身免疫性胰岛炎。在1型糖尿病高危人群和1型糖尿病早期均可检出多种抗体,如谷氨酸脱羧酶抗体(GAD)和胰岛细胞抗体(ICA)等,这些免疫标志物的检测对1型糖尿病的诊断有重要价值,其联合检测具有互补性,可大大提高了阳性率,这对1型糖尿病早期发现,指导干预治疗与糖尿病分型等有重要意义。LADA是成人迟发性自身免疫性糖尿病,早期在临床表现上与2型糖尿病无明显差异,借助于GAD和ICA的检测有利于及早从2型糖尿病中识别。
这些免疫学标志中,诊断LADA测定GAD抗体要优于ICA。GAD-Ab不仅为临床分型提供重要依据而且可用来预测患者未来对胰岛素的依赖情况。ICA在初发1型糖尿病患者中的检出率约70%,并且随病程的延长而降低。一般20年后阳性率约8%,这可能随疾病发展抗原刺激减少有关。2型糖尿病患者ICA阳性说明以后可能产生严重的胰岛细胞损害,因此ICA被认为无糖尿病或2型糖尿病向1型糖尿病发展的一个标志。
综上所述,我国周智广教授综合提出LADA早期(非胰岛素依赖阶段)诊断依据供参考:
(1)发病年龄>15岁而发病6个月内无酮症发生。
(2)发病时非肥胖。
(3)伴甲状腺或胃壁细胞等器官特异性自身抗体。
(4)具有1型糖尿病易感基因。
(5)胰岛β细胞自身抗体[GAD、ICA和(或)胰岛素自身抗体等]阳性。
(6)排除线粒体基因突变糖尿病及MODY。
具备第1点加上(2)、(3)、(4)点中任何一点则疑诊,具备(1)、(5)、(6)可确诊。起病年龄暂划为>15岁,是基于国际上有将<15岁或≥15岁起病的IDDM称为儿童起病型或成年起病型IDDM的惯例,且糖尿病患者ICA或GAD-Ab阳性率有随增龄而降低的趋势,因此这样划分可早期发现和处理更多的病例。暂提出发病后至少6个月内无酮症发生,是为了与成年急性起病的自身免疫性1型糖尿病区别,而在WHO糖尿病分型新建议中并无明确的时间界限。
鉴于LADA患者的胰岛β细胞功能在早期诊断后3~5年呈相对稳定状态,可尽早行干预治疗以延缓胰岛功能的衰退速度。在临床工作中选择不同的治疗方案对LADA患者β细胞功能减退的速度将会产生不同影响,一般高滴度GAD-Ab、发病年龄轻、病程长及男性是LADA患者胰岛功能衰减的危险因素,故对于这类患者应积极采取适当的干预治疗。
(二)年轻起病成人型糖尿病(MODY)
1.MODY的含义 年轻起病成人型糖尿病,缩写为MODY(maturity onset diabetes of the young)。
1975年由Fajans和tattersall依据1950年以来系列报道分析,将此型具有发病年龄早、以常染色体显性遗传为共同特点的2型糖尿患者命名为MODY。1985年WHO的分类属2型糖尿病的一种亚型。近来随着分子遗传学的进展以及对糖尿病病因和发病机制的深入研究,1997年ADA和1999年WHO糖尿病专家报告,对临床高血糖疾病提出了新的病因学分型,将其归类为特殊型,属染色体显性遗传的单基因遗传病,占2型糖尿病的2%~5%,主要是由于胰岛β细胞中葡萄糖刺激的胰岛素分泌功能障碍所致,β细胞功能常随着病程的延长而逐渐衰竭,而胰岛素抵抗不是其致病因素。
2.MODY的诊断及其鉴别
(1)诊断标准:MODY的临床表现,与一般2型糖尿病相似:葡萄糖刺激后的胰岛素-C肽反应较低;肥胖比同龄普通人多,而比一般2型糖尿患者少。
以其诊断指标,按Mohan等人提出的根据为:
1)诊断糖尿病的年龄<25岁。
2)至少5年内不需用胰岛素控制。
3)无酮症倾向;血浆C肽水平≥0.3nmo1/L,葡萄糖刺激后≥0.6nmo1/L(为该中心NIDDM的均值)。
4)有三代或三代以上显性遗传家族史。
主要诊断指标是1)和4)两条。尤其是第4条是区别2型糖尿病的关键。
(2)鉴别诊断:与常见的2型糖尿病的区别(见表12-3):
表12-3 MODY与1型和2型糖尿病(DM)的区别
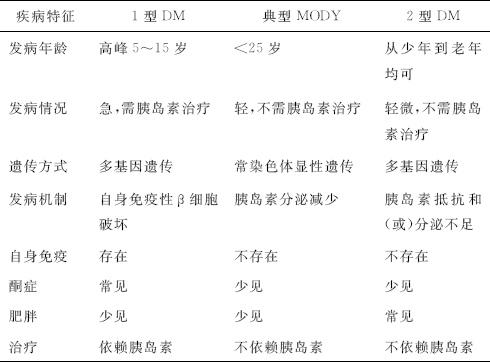
1)发病年龄:前者(MODY)年轻,为青少年(<25岁),后者中老年多>40岁。
2)家族三代遗传史:前者常有,后者罕有。
3)基因变异:前者为单基因缺陷,后者为多基因异常,尚未完全阐明。
4)病理生理:前者为β细胞功能缺陷,后者为胰岛素抵抗和(或)β细胞功能异常。
5)环境因素:前者不明显,肥胖者少见,后者明显,肥胖者多见。
6)糖代谢障碍:前者一般较轻,随病型而异;后者明显,随病情轻重而异。遇可疑病例应做基因诊断鉴别。
3.MODY的遗传变异类型及临床特点 各型MODY共同表现主要是发病年龄早(<25岁)和均有胰岛素分泌异常。而由于基因变异部位不同,即遗传基因的异质性又导致各型临床表现不同。
(1)MODY1:MODY1是1991年确认位于染色体20q12~13.1上的肝细胞核因子HNF-4α基因突变所致。HNF-4α在肝脏、肾脏和肠中有很高的表达,在胰岛细胞和胰岛素瘤中也有表达。HNF-4α是肝脏基因表达的重要调节因子,而且对HNF-1α的活化有重用,HNF-1α反过来对大量肝脏特异性基因的表达有活化作用,其中包括涉及葡萄糖、胆固醇和脂肪酸代谢的基因。HNF-4α在肾脏、肠和胰岛细胞的表达提示它在这些组织基因表达的特异性调节中同样起着重要作用。
其最早报道见于美国RW家系,发生频率美国报道占5%,发病年龄较晚(年青人)。临床特点是糖尿病一般较轻(餐后高血糖为主,此与MODY2不同),但有相当患者由于β细胞对血糖上升刺激分泌反应进行性降低,导致进行性糖代谢障碍,30%~40%常需要胰岛素治疗。可伴脂代谢异常,约有50%的患者出现血清甘油三酯下降,25%的患者血清载脂蛋白AⅡ、CⅢ和脂蛋白(a)水平下降,以及血管并发症,尤以微血管并发症,特别是视网膜和肾脏病变最常见。
(2)MODY2:MODY2是一种高外显率的常染色体显性遗传病,是MODY中最常见的疾病,几乎所有的人种和种族中都有发现,为葡萄糖激酶基因(GCK)突变有关。1992年首先在法国MODY家系中确定,突变基因位于染色体7p13-15的7号外显子无意义突变。GCK是调控糖代谢的关键酶,在β细胞起“葡萄糖感受器”作用,基因突变致GCK活性减低,β细胞对葡萄糖刺激的胰岛素分泌反应降低以及餐后肝内糖原合成减少,从而发生空腹高血糖。发生频度为12.5。
GCK基因突变点至今约有不同130种被发现与MODY2有关,但其临床表现相似。高血糖发生早(儿童期),有者出生后即可发现,诊断最小年龄为1岁。病情多不严重(血糖一般为6.1~8.0mol/L,很少>10mol/L)。病程经过良好,甚至终身无糖尿病症状,这可能是由于轻度高血糖引起β细胞内野生型GCK等位基因的表达增多,使胰岛素分泌增多。且很少合并血管并发症,大多不需特殊治疗,约2%用胰岛素治疗。
(3)MODY3:属转录因子HNF-1α基因突变,1996年在法国非GCKMODY家族中确认,突变基因位于染色体12q24区域。HNF-4α与HNF-1α同属一类转录因子,故MODY1和MODY3的病理生理机制非常相似,其临床表现也相似。但不同的是,研究报道显示,MODY3也是MODY中较常见的类型,为欧州白人最多见的遗传突变型。MODY3患者的有肾小管回吸收糖功能障碍,肾糖阈降低,故患者早期即有明显多尿、多饮。此外,HNF-1α转录因子可改变一些其他基因在不同组织(肝、肾和胰)的表达,可累及胰外器官。
(4)MODY4:MODY4有位于13号染色体上的胰同源区转录因子IPF-1基因突变。该基因也是一种转录因子,是调控胰岛素和生长抑素基因的转录,胰腺早期发育起重要作用,并调节β细胞特异性基因,主要导致胰岛素的基因表达障碍。
临床特点是纯和突变者可出现先天性胰腺发育不全,导致新生儿糖尿病。杂和突变者发病年龄较晚,平均35岁(青年人),葡萄糖钳夹试验提示胰岛素分泌功能严重受损。糖尿病较轻,无酮症和其他胰岛素缺乏表现。罕有并发症。一般用饮食调控和口服降糖药治疗。
(5)MODY5:系HNF-1β基因突变,突变基因位于染色体12q,也是一种移码基因突变(frame shift mutation)。1998年Horikawa和Nishigori等在日本首先报道。
临床表现:在MODY中较少见,发病年龄<35岁,发生频率在英国为2.5%。其高血糖轻重程度不一,治疗酌情施行。特征性表现为同时存在糖尿病和肾囊肿(发育不良性肾小球囊性病变),甚至出现非糖尿病性肾功能不全。女性患者还可出现生殖器异常,如阴道发育不全、子宫未发育或双角子宫。
(6)MODY6:系由NeuroD1/BETA2基因突变,突变基因位于染色体2q,是转录因子6HLH(basicHelix-Loop-Helix)家族的组织特异性成员,在胰岛、小肠和脑表达。是已知的胰岛素基因转录的调控因子,且受高度特异性机制调控,是胰岛β细胞形态发育或分化所必需。目前有关NeuroD1/BETA2基因突变引起2型糖尿病的报道仅有2个家系,是由2个不同突变位点引起。一个突变(R111L)引起NeuroD1蛋白与胰岛素基因启动子区的结合障碍;另一个突变(206+C)是单碱基插入产生移码突变,影响NeuroD1蛋白正常形成,阻断胰岛细胞分化,并使有功能的胰岛β细胞数目减少。
研究者发现R111L突变的糖尿病临床表现较206+C突变者轻。R111L突变者体型较胖,血清胰岛素水平相对较高。而206+C突变者无肥胖,血清胰岛素水平较低。故MODY6患者糖尿病轻重不一,其发病年龄为青年,发生频度在英国为2%,可发生糖尿病并发症(肾病、视网膜病)。
除上述6种MODY外,随着研究的不断深入,可能有更多MODY及其相关基因突变被发现,近来有报道日本学者在一DM家族中发现了Islet-1基因突变,即Q310X无义突变,并认为该基因突变可能是MODY7发生的原因。Islet-1也是一转录因子,是惟一与胰岛素基因增强子结合的转录因子,在胰岛细胞形成过程中起重要作用。此外HNF23β和HNF26可能也是MODY的候选基因。
总之,MODY是有别于1型和2型DM的一种异质性单基因疾病,属β细胞功能异常的遗传缺陷性特殊类型DM。MODY从发病年龄、临床表现到治疗有其自身特征。上述6种是迄今为止所报道的MODY遗传变异型,但并不是所有调控胰岛素基因的转录因子突变都能引起MODY。临床上,疑诊MODY者可进一步做基因鉴定来确定诊断及分辨与其相关的基因突变类型。
(三)内分泌疾病
糖尿病或糖耐量异常在许多内分泌疾病中均可能出现,其中由嗜铬细胞瘤和肢端肥大症引起的糖尿病相对较重,而甲状腺机能亢进和库欣综合征引起的糖尿病一般相对较轻,有时不易与原发性糖尿病区别。
1.生长抑素瘤及醛固酮瘤诱发的低血钾可引起糖尿病,部分可能为胰岛素分泌抑制所致。
2.嗜铬细胞瘤主要是过多的儿茶酚胺抑制胰岛素的分泌引起糖代谢异常,促进高血糖素的分泌。过多的儿茶酚胺也引起游离脂肪酸增加,肝脏磷酸化酶活性增加。
3.甲状腺机能亢进引起的糖代谢异常,主要是在甲状腺机能亢进状态下增加了糖从消化道的吸收,应用糖皮质激素或柯兴氏综合征引起的糖尿病,主要是由过多的糖皮质激素刺激糖异生,抑制糖的利用,降低肌细胞糖的磷酸化。同时,糖皮质激素使脂动员增加,糖代谢被增加的游离脂肪酸阻碍。这些被认为是末梢组织对胰岛素利用降低,特别是胰岛素受体后的障碍。
4.肢端肥大症时,糖利用障碍是由生长激素升高引起的,造成脂肪动员增加,对胰岛素敏感性降低,这些也可引起胰岛素抵抗,胰岛素受体后障碍。
(四)胰腺疾病
急、慢性胰腺炎,胰腺损伤,胰腺切除,胰腺肿瘤,涉及胰腺的肾上腺瘤,既有胰岛的破坏,又有胰外分泌障碍。由于胰腺储备能力较大,当胰腺有广泛病变时才可引发糖尿病。囊性纤维化,血色病也可损伤β细胞及胰岛素的分泌。纤维钙化性胰腺病可有腹痛,并向背部放射。
(五)肝脏疾病
慢性肝炎,肝硬化时引起的糖耐量异常的较为常见,急性肝炎时引起糖耐量异常的较少,肝脏疾病时,肝对糖的摄取减少,对胰岛素感受性低下,糖处理能力低下。此外,其他由肝脏疾病引起的有关糖代谢激素的异常也是引起糖代谢异常的因素。