血清学诊断技术
出处:按学科分类—农业科学 中国农业出版社《禽病手册》第83页(18272字)
血清学方法目的有二:一是用已知血清鉴定待检病原的种类乃至型别,二是由病鸡采集血清标本,用已知抗原,测定待检病鸡血清中的抗体,或进一步比较病鸡急性发病期和恢复期血清中的抗体效价,了解抗体是否有明显的增长,从而判定感染的存在。
一、快速全血平板凝集反应
快速平板凝集反应又称血滴法,是在玻板上(或白瓷板)用诊断抗原检查未知鸡血液中的抗体,如果抗原与被检鸡血清,在玻片上混匀后,在2分钟内出现凝集反应,说明鸡血清中具有该抗原相应的抗体,从而检查出阳性反应鸡。
快速平板凝集反应操作简单、设备要求不高,而且快速、准确、微量,特别适用于大群鸡的检疫,是鸡白痢、支原体等鸡病检疫净化的重要手段。
1.操作方法 取洁净玻璃板一块,用玻璃铅笔划成约4厘米2的小格,每列5格。将鸡白痢诊断抗原充分振荡均匀,用滴管吸取抗原一滴(0.05毫升),于玻板的小方格中央。将待检鸡编号,与玻板上的编号一致。翻开待检鸡翅膀,经酒精棉消毒后用针头刺破翅静脉,使之出血,用铂耳环蘸取一满环全血或分离的血清(约0.02毫升),立即与玻片上的诊断抗原混匀,并涂成1~2厘米直径的圆形。倾倒转动玻板数次,以助混匀,并促进凝集,2~3分钟内观察结果,若为阳性鸡,即可出现白色聚片状的凝集块。
2.结果的判定 每次检验时,都要设抗原与标准的阳性血清和标准的阴性血清反应的对照。应出现典型的阳性或阴性反应,目的是论证抗原是否有效。反应结果判定如下:
-玻片上的混合物保存原来的均匀混浊状态为阴性反应。
+3分钟以上出现少数细砂粒状凝集,常趋聚于中央,底液仍呈一致浑浊者为弱阴性反应。
++3分钟左右抗原凝集成小颗粒状,有时分布在边缘,底面仍浑浊者为可疑反应。
+++2~3分钟内抗原凝集成很多大小不等的块状凝集,底面略有浑浊者为阳性反应。
#数秒钟至1分钟内出现很多大块或小块凝集,底液澄清者为强阳性反应。
二、血凝和血凝抑制试验
血凝(HA)和血凝抑制(HI)试验是鉴定病毒和诊断病毒性疾病的重要方法之一。
许多病毒能够凝集某些种类动物(如鸡、鹅、豚鼠和人)的红细胞。正粘病毒和副粘病毒是最主要的红细胞凝集性病毒,其他病毒如披膜病毒、细小病毒、某些肠道病毒和腺病毒等也有凝集红细胞的作用。禽病实践中,目前最常用作鸡新城疫、禽流感和减蛋综合征的诊断。
1.材料准备
器材:V型96孔微量滴定板、微量混合器、塑料采血管、50微升移液管。
稀释液:pH7.0~7.2磷酸缓冲盐水(PBS)(NaCl,170克;KH2PO4,13.6克;NaOH,3.0克;加蒸馏水至1000毫升高压灭菌,4℃保存,使用时作20倍稀释)。
浓缩抗原:由指定单位提供,也可用弱毒苗作检测抗原。
红细胞:采成年鸡血,用20倍量洗涤3~4次,每次以2000转/分离心3~4分钟,最后一次5分钟,用PBS配成0.5%悬液。
血清:标准阳性血清,由指定单位提供。被检血清,每群鸡随机采血20~30份血样,分离血清。先用三棱针刺破翅下静脉,随即用塑料管引流血液至6~8厘米长。将管一端烧融封口,待凝固析出血清后以1000转/分离心5分钟,剪断塑料管,将血清倒入一块塑料板小孔中。若需较长时间保存,可在离心后将凝血块一端剪去,滴融化石蜡封口,于4~8℃保存。
2.操作方法
(1)微量血凝试验:“V”型血凝板的每孔中滴加PBS0.05毫升,共滴4排。吸取1∶5稀释抗原滴加于第1列孔,每孔0.05毫升,然后由左至右顺序倍比稀释至第11列孔,再从第11列孔各吸0.05毫升弃之。最后一列不加抗原作对照。于每孔中加入0.5%红细胞悬液0.05毫升。置微型混合器上振荡1分钟,或以手持血凝板绕圈混匀。放室温下(18~20℃)30~40分钟,根据血凝图像判定结果。以出现完全凝集的抗原最大稀释度为该抗原的血凝滴度,每次4排重复,以几何均值表示结果。
计算出含4个血凝单位的抗原浓度。计算公式为:
抗原应稀释倍数=血凝滴度/4
(2)微量血凝抑制试验:在96孔V型板上进行,用50微升移液管加样和稀释。先取PBS0.05毫升,加入第1孔,再取浓度为4个血凝单位的抗原依次加入3~12孔,每孔0.05毫升,第2孔加浓度为8个血凝单位的抗原0.05毫升。用稀释器吸被检血清0.05毫升于第1孔(血清对照)中,挤压混匀后吸0.05毫升于第二孔,依次倍比稀释至第12孔,最后弃去0.05毫升。置室温(18~20℃)下作用20分钟。用稀释器滴加0.05毫升红细胞悬液于各孔中,振荡混匀后,室温下静置30~40分钟,判定结果。每次测定应设已知滴度的标准阳性血清对照。
3.结果判定 在对照出现正确结果的情况下,以完全抑制红细胞凝集的最大稀释度为该血清的血凝抑制滴度。
三、琼脂免疫扩散试验
琼脂免疫扩散试验(AGID)又称为琼脂免疫扩散,或简称为琼脂扩散、琼扩(AGP),是基于可溶性抗原与可溶性抗体的分子均可在琼脂网状基质中移动、扩散并形成肉眼可见沉淀线的原理而建立的诊断方法。抗原和抗体在琼脂凝胶中的扩散过程,由近及远形成浓度梯度。当抗原、抗体的特异性互相对应时,它们在琼脂基质中适当比例下相遇,便可相互结合,而产生抗原、抗体的结合物,分子量相应增大,颗粒变大,故在琼脂凝胶中不再扩散,在抗原、抗体比较适合的位置上形成白色可见的沉淀线。
琼脂扩散试验分为单相扩散和双相扩散两个基本类型。将抗体或抗原一方混合于琼脂凝胶中,另一方(抗原或抗体)直接接触或扩散于其中者,称为单相扩散;使抗原和抗体双方同时在琼脂凝胶中扩散而相遇成线者,称为双相扩散。禽病诊断实践中,双相扩散更为常用,如鸡传染性法氏囊病、鸡马立克氏病、禽流感、鸡传染性脑脊髓炎等病的诊断。
AGP的主要优点是简便、微量、快速、准确,根据出现沉淀带的数目、位置以及相邻两条沉淀带之间的融合、交叉、分枝等现象,即可了解该复合抗原的组成。AGP可以用于病原体的抗体监测和病原感染的流行病学调查。
1.材料准备
器材:1毫升注射器,6~9号针头,10×100毫米小试管,直径6~8毫米、长度16厘米的玻璃棒,微量移液器及滴头,烧杯和磁缸,直径85毫米培养皿,孔径4毫米和3毫米的打孔器。
琼扩抗原:可向相关单位购买,系冻干制品,使用时用蒸馏水或PBS恢复到原分装量。
阳性血清:可向相关单位购买,系冻干制品,使用时用蒸馏水或PBS恢复到原分装量。
琼脂凝胶平板:用含8%氯化钠的磷酸盐缓冲液(0.01摩/升、pH7.4)配制1%琼脂溶液,水浴加温使充分溶化后,加入培养皿,每皿约为20毫升。平置,在室温下凝固冷却后,将琼脂板放在预先画好的七孔形图案上(如图2-2),用打孔器按图形准确位置打孔,中心孔孔径为4毫米,周边孔孔径为3毫米,孔距为3毫米。小心挑出孔内琼脂,勿破坏周围琼脂,而后倒置放入普通冰箱,保存3~5天备用。
图2-2 琼脂扩散试验常用的梅花图案与AGP试验结果
2.操作方法
(1)检测血清抗体(被检血清):用微量移液器分别将各被检血清按顺序在周边孔中每隔一孔加一样品。向中心孔内滴加琼扩抗原。向余下的周边孔内加入阳性血清。将加样完毕的琼脂板加盖后,平放于带盖的湿盒内,置37℃温箱中,24小时内观察记录结果。
(2)用阳性血清检测病毒抗原:以马立克氏病诊断为例,选拔含羽髓丰满的翅羽或身体其他部位的大羽数根(幼鸡8根,中、成鸡3~5根),剪下羽根部分,并按编号分别收集于相应的小试管内。向每管内滴加2~3滴蒸馏水(羽髓丰满时也可不加),然后用玻璃棒挤压羽根,以适当的压力转动玻璃棒,倾斜试管,并用玻璃棒导流,使羽髓浸流至管口,另一人用加样器将其吸出,间隔滴加到周边孔内。以同样操作浸提其他样品。用加样器向中心孔内滴加标准阳性血清。以同样的操作向空下的周边孔内滴加标准抗原。将加样完毕的琼脂板加盖后,平放于带盖的湿盒内,置37℃温箱中,24小时内观察记录结果。
3.结果判定 被检材料形成清晰的沉淀线,并与标准的阳性血清的沉淀线相融合,则判为阳性反应;不出现沉淀线的则判为阴性反应。标准阳性孔所产生的沉淀线末端弯向被检样品孔内,则该被检样品判为弱阳性。有的受检材料可能会产生一条以上的沉淀线,仍属于阳性反应。
4.注意事项 琼扩试验所用琼脂必须是优质的,如用普通琼脂应预先进行净化精制,精制的简易方法是,取条状琼脂2.4克加100毫升无离子水或蒸馏水,在沸水中融化,趁热倒入搪瓷盘中,待冷却后,切成1厘米2大小的琼脂块,用蒸馏水或无离子水浸泡2~3天,每天换水4~5次,将处理好的琼脂块在沸水浴上融化后,加入等量的所需的配用液体和1%硫柳汞1毫升,融化均匀,即成1%的琼脂液。有条件的实验室用琼脂糖凝胶作琼扩试验效果会更理想。
制备琼脂板应在水平台上进行,防止厚薄不均匀。板的厚度要求一致,浇制时防止产生气泡,培养皿浇制的琼脂板在冰箱内可保存半个月。
琼扩试验用的打孔器有标准打孔器,可以购买。无条件的实验室可用牙膏皮或收音机天线自制。打孔的孔径、孔距力求准确、合适。
打好孔后,在加样前,为防止样品从孔底漏掉,可将平皿置酒精灯火焰上封底。加滴孔中的抗原和血清时,孔内必须加满,切勿外溢,加样时不带进小气泡。
在浸提和滴加每份待检样品时,须把玻璃棒洗净拭干,加样器滴头每样一换。
对幼鸡羽根和羽髓含量较少的标本,需加少许蒸馏水浸提,水量不宜过多,以免抗原过稀而影响反应结果。
琼脂平板最好提前几天(3~5天)预先做好并打好孔,放入冰箱备用;如果现做现用,应在打好孔后,打开盖在37℃温箱中放置30~40分钟,使孔内的渗出水蒸发掉,以免影响样品扩散。
标准抗原和阳性血清在用后若有剩余,则应冻结保存,但阳性血清应避免多次(一般不超过3次)反复冻融,以防抗体效价降低而影响反应结果。
加样时对每个培养皿的起始孔和每组的起始孔分别作记号,以便于查找。
四、免疫荧光试验
免疫荧光试验是利用荧光素标记抗体,对被检材料进行荧光染色,借助荧光显微镜对相应抗原进行示踪定位的诊断方法。
根据染色方法的不同,免疫荧光试验可分为直接法和间接法两种,主要用于细菌、病毒和其他病原体的快速诊断、病毒抗原的定位和细胞表面抗原的检测。间接荧光法还可用于抗体的检测。
1.常用荧光素
(1)异硫氰酸荧光素(FITC):最大吸收波长为490纳米,与抗体结合后则为495纳米,呈草绿色荧光,荧光效率高。
(2)罗丹明荧光素(RB200):主要为异硫氰四甲基罗丹明,最大吸收波长为554纳米,最大发射光波长为620纳米,呈橘红色荧光,易与组织自发绿色荧光相区别。荧光效率为5%,猝灭慢。由于以上两种荧光素的发射光波长差别较大,颜色上不同,因而,二者可以进行双重染色,对同一标本中不同抗原进行测定。
荧光素分子上的异硫氰酸(FITC)和磺酸基(罗丹明)可以通过共价键,结合到抗体分子上,这一反应在碱性条件下(pH9.5以上)完成。结合了的荧光素与游离的未结合的荧光素,通过分子筛很容易分开,故易于制备标记抗体。用于标记荧光素的抗体应具有高度特异性和较高的亲和力。
2.免疫球蛋白提纯 由于血清中的白蛋白、α-球蛋白和β-球蛋白所带的负电荷较多,这些蛋白质与荧光素的结合力比免疫球蛋白强,标记后,易通过静电作用与组织发生非特异性反应,故必须用提纯抗体进行标记。
免疫球蛋白的提纯一般采用盐析法粗提和层析法纯化两个步骤。
(1)盐析法粗提:抗血清先用生理盐水稀释一倍,边搅拌边滴加等体积的饱和硫酸溶液(到达50%饱和),置4℃下,静置30分钟,4000转/分离心40分钟,弃上清,沉淀用等体积的生理盐水溶解后,边搅拌边加入1/2容积的饱和硫酸铵溶液(33%饱和),置4℃下30分钟,4000转/分离心40分钟,弃上清,将沉淀重新溶解,如此重复3次,将沉淀溶于少量生理盐水中,装入透析袋,置生理盐水中透析2~3天,每天换液数次,直至无铵离子或硫酸根离子。此粗提的IgG即可用于标记。
(2)层析法纯化:上述制备的免疫球蛋白,可以通过葡聚糖G-200(Sephadex G-200)或DEAE-纤维素离子交换层析进一步纯化。
Sephadex G-200凝胶过滤方法如下:
预先将Sephadex G-200用蒸馏水浸泡3天,使其充分膨胀形成凝胶,将其装入2×50厘米或2×100厘米的玻璃层析管内,调节静水压力为20厘米H2O,流速为5毫升/15分钟,待凝胶沉淀后,用0.01毫升PBS(pH7.2)平衡1小时,加样量与凝胶之比为1∶20。待柱上液体剩下至一个硬币厚时锁住下口。沿管壁加入粗制免疫球蛋白溶液(先在PBS中透析平衡),当样品全部进入凝胶后,轻轻在凝胶柱上部加入PBS进行洗脱,部分自动或人工收集下口流出液,每部分收集液均用20%磺基水杨酸检测蛋白质的出现,并用紫外光分光光度计测260纳米和280纳米处各部分的吸光度值(A)。描记洗脱曲线,在洗脱曲线上,IgM在第一峰,但量少,IgG在第二峰,浓度高。
将含IgG的各部分合并,以聚乙二醇(PEG)6000或超滤浓缩至原体积,并根据公式计算蛋白质含量:蛋白质含量(毫克/毫升)=(1.47×A280-0.74×A260)×稀释倍数
3.荧光抗体标记
(1)FITC标记:有两种方法。
方法一:称取FITC结晶型粉末(Ⅰ型),用少量0.025摩尔/升碳酸盐缓冲液(CBpH9.0~9.5)溶解。FITC与抗体的比值为每毫克IgG中加15~20微克FITC。溶解后,迅速加入抗体液(pH9.0~9.5)中,充分混合,混合液中蛋白质含量不应低于20毫克/毫升。用0.1摩尔/升CB调整pH3.95,然后置于4℃下搅拌12~18小时,经Sephadex G-25凝胶过滤除去结合的荧光素。
方法二:将FITC(1毫克/毫升)溶于0.15摩尔/升Na2HPO4(pH9.0)溶液中,按100毫克抗体溶液加入1毫升FITC溶液与抗体溶液(至少不低于25毫克/毫升)混合,用0.10摩尔/升Na2HPO4调节pH9.5,置室温下搅拌,维持60分钟,经Sephadex G-25除去游离荧光素。
(2)RB200标记:常用的是异硫氰α甲基罗丹明(TMRITC)要求在低蛋白含量(4毫克/毫升)进行,罗丹明与蛋白含量比例为每毫克IgG加30微克无定型粉末或12.5微克纯结晶。无定型粉末的反应条件为冰浴作用1小时,再在0℃作用18小时,游离色素必须通过阴离子交换层析方法可纯化。
4.荧光抗体纯化
(1)层析法纯化:在20×1厘米的层析柱内,加入已膨胀的SephadexG-25或G-50,去掉上层过量溶液,再加凝胶使柱床长为16厘米,在柱床表面再加上一张滤纸片。用0.01摩尔/升PBS(pH7.2)平衡1或2小时后,在表面滴加标记物溶液,并用PBS进行洗脱。收集第一含色素峰,此即为荧光抗体,通过此法,可以去掉未反应的荧光色素。
(2)沉淀法纯化:用50%饱和硫酸铵或18%Na2SO4盐析一次经4000转/分离心20分钟,取沉淀,用少量生理盐水将沉淀溶解并对生理盐水透析24小时。
5.荧光抗体免疫学鉴定 荧光抗体的免疫学特性鉴定包括特异性最佳工作浓度和特异性等的测定。
(1)染色滴度的测定:以倍比稀释的荧光抗体与标准阳性标本作系列染色,出现明亮荧光的最大稀释倍数,即为该结合物的特异性染色滴度,同时以不含抗原的阴性对照测定非特异性染色滴度,实际应用时应取低于特异性染色而高于非特异性染色的滴度的稀释度,如特异性滴度为1∶64,非特异性滴度为1∶8,则该试剂的工作浓度以1∶32为合适。
(2)特异性鉴定:通常以抑制试验和吸收试验以鉴定其特异性,吸收试验是在荧光抗体中加入过量的对应抗原,然后以此染阳性标本,应无明显荧光。抑制试验是将标本先用未标记的抗血清作预处理,再用荧光抗体染色,结果反应应被抑制,荧光强度降低或消失。
6.标本制备 染色标本的制备方法随材料类型而异,主要有切片法,包括冰冻切片和石蜡切片,组织培养小盖玻片及组织压、印片等。
(1)冰冻切片和石蜡切片:保证冷台与冷刀温度适中是切好冰片的关键之一。温度太低,组织片易碎裂,温度过高,也切不好。因此,温度以-20~-30℃为宜。此外,组织块要小,约3毫米见方,切片刀锋利。切片厚度要求在4~6微米之间,超过6微米时,自发荧光增强,视野模糊。操作时,预先使冷台、冷刀制冷,达-25℃左右,然后将新鲜速冻处理过的组织块用少量糨糊或生理盐水溶于组织块底部,使其与冷台接触,粘牢,调节切片厚度,切好的组织片贴于洁净的载玻片上,并用电吹风器冷风吹干(20~30分钟),即可进入固定液。
冰冻切片的优点是能保证组织内抗原最大限度地免疫活性。但因冻融后使结构破坏,背景荧光较强。
(2)涂片、压印片:涂片、压印片是快速诊断时的常用方法。用锋利刀片切除动物脏器(肝、脾、淋巴结、肾等)小块,切面整齐。用滤纸将切面污血吸净,将组织块压印或涂于载玻片上即可。
涂片、压印片可用于脏器、血液、细菌培养物及其他体细胞悬液中抗原或抗体的染色分析。
(3)组织培养物:对于组织培养物中病毒抗原的鉴定所用的荧光抗体染色,多采用小盖玻片法,在分装细胞时,预先将灭菌无毒的小盖(1/3盖玻片)放入组织培养瓶内,使细胞长成单层。接毒后经一定时间培养,用亨克氏液或PBS(0.01摩尔/升pH7.2~7.4),洗净三次后即可进行固体染色。亦可在聚苯乙烯微孔板上作微量细胞培养,培养病毒直接在板上固定,染色观察,效果很好。
(4)固定:固定的目的是防止标本脱落,除去脂类以利抗原-抗体结合和降低本底荧光。固定剂与固定条件应根据被检对象而定。常用的固定剂有丙酮、乙醇、甲醇、四氯化碳、甲醛和戊二醛,其中丙酮和75%乙醇最为常用。
固定温度和时间要凭反应效果而定,一般病毒和细菌抗原用室温5~10分钟或4℃30分钟,某些病毒最好用冷丙酮-20℃固定60分钟,固定后旋即用PBS反复冲洗,干后即可用于染色。
7.免疫荧光抗体染色试验 常用的免疫荧光抗体染色试验方法主要有直接法、间接法两种。
(1)直接法:直接法主要是用制备的荧光抗体直接染色标本片,以检测相应的禽病细菌或抗原。直接法的基本程序如下。
①将固定的标本置于PBS(0.01摩尔/升,pH7.2~7.4)中洗浸3次,每次3分钟,习惯上是通过三杯PBS液,最后至蒸馏水中5~10分钟脱盐。
②将标本于室温中空中干燥或用吸水纸印干。
③于标本上滴加适量最佳工作浓度的荧光抗体,置湿盒中(37℃)作用30分钟。
④用PBS将荧光抗体溶液轻轻冲洗后,将其通过三杯PBS溶液。
以上整个过程一般需1~2小时完成,用吸水纸吸干。
⑤封片。将磷酸甘油液(9份甘油+1份0.01摩尔/升PBS)滴在标本上,轻轻盖上一片洁净的盖玻片。制备标本的载玻片和涂片不宜太厚,否则,不利观察,发出荧光也不亮。
直接法应设立标准阳性标本对照、阴性标本对照,必要时还需做抑制试验,以确证其特异性。直接染色法特异性高,操作简单快速,适于快速诊断。
(2)间接法:间接法是用荧光素标记抗球蛋白抗体,制成荧光抗抗体。先将阳性抗体(若检测抗体,则为待检血清)加到标本片上,与相应抗原结合,再加荧光抗抗体,形成抗原-抗体-抗抗体复合物,在荧光显微镜下即可见荧光。
间接法的基本操作程序为:标本片(细菌涂片、切片、细胞单层盖片)→加待检血清(或阳性血清)→置湿盒内,37℃30分钟→洗涤(0.01摩尔/升pH7.4PBS)→加荧光素标记的抗抗体→37℃30分钟→洗涤→封片→镜检。
8.荧光显微镜检查 将带有荧光染色的标本片置荧光显微镜下观察结果,用FITC标记时,发现有亮绿色或黄绿色荧光细胞,轮廓清楚者为阳性。
标本检查时如需用油镜,可用无荧光镜油、液体石蜡或缓冲甘油代替柏木油,放载玻片时,需先在聚光器镜面上加1滴缓冲甘油,以防光束散射。标本涂布区可用红蜡笔划一记号,先以此对光,然后移入标本区观察。先用低倍镜找出观察部分,再换高倍镜或油镜观察,在同一标本区不宜连续观察3分钟以上,以免荧光猝灭。
五、酶联免疫吸附试验
酶联免疫吸附试验(ELISA)是免疫酶标记技术中的一个类型,广泛应用于鸡病的血清学诊断。免疫酶标记技术是利用酶的高效催化作用,将抗原抗体反应的特异性与酶促反应的敏感性相结合而建立起来的,将酶分子与抗体结合,形成稳定的酶标(或酶标抗抗体)结合物,当酶标抗体与相应的抗原结合时,即可在底物溶液的参与下,产生肉眼可见的颜色反应,颜色的深浅与抗原或抗体的量成比例关系,通过酶联免疫检测仪测定其吸收值可做出定量分析。
近几年来,ELISA已取得很大的发展,被广泛用作鸡病监测的常规手段。国内外已有多种鸡病的ELISA试剂盒用于相应的诊断和监测。该技术具有简便、敏感、安全而且快速的优点,用于鸡群抗体监测有利于了解和掌握鸡群的抗体水平和抗体动态,从鸡群抗体动态情况分析获得的信息便于及时做出有关鸡群防疫等保健的管理措施。
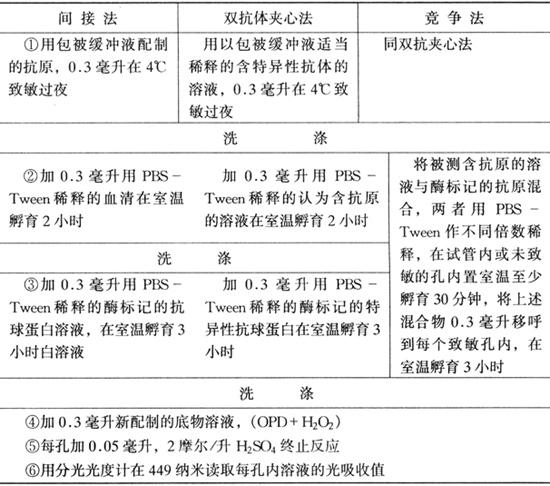
1.分类和操作原理
(1)间接方法:将已知抗原吸附(或称包被)于固相载体,孵育后洗去未吸附的抗原,随后加入含有特异性抗体的被检血清,感作后洗除未起反应的物质,加入酶标记的抗球蛋白抗体和酶标兔(或羊)抗鸡球蛋白,感作后再经洗涤,加入酶底物,底物被分解,出现颜色变化。颜色变化的速度及程度,与样品中的抗体量有关,即样品含有的抗体愈多,颜色出现的愈快、愈深。
(2)双抗体夹心法:是检测抗原的方法。将特异性免疫球蛋白吸附于固相载体表面,然后加入含有抗原的溶液,使抗原和抗体在固相表面上形成复合物。洗除多余的抗原,再加入酶标记的特异性抗体,感作后冲洗,加入酶的底物,颜色的改变与被检样品中的抗原量成正比。
(3)竞争法:利用酶标记抗原和未标记抗原共同竞争有限量抗体的原理,测定样品中的抗原。操作时需要有只加酶标记抗原的系统作为对照。将抗体吸附于固相载体表面,孵育后冲洗,加入待检抗原样品和酶标记抗原(也可先加待检样品,稍后再加酶标记抗原)。对照则只加酶标记抗原。感作后冲洗,加入酶的底物溶液。仅含酶标记抗原的对照系统出现颜色反应。而在待测系统中,由于样品中未标记抗原的竞争作用,相应抑制颜色反应。待检抗原含量高时,其对抗体的竞争能力强,所形成的不带酶的抗原-抗体复合物量亦多,带酶复合物的形成量相对减少,从而使酶催化底物时产生有色产物的量也少。反之,待检抗原含量低时,其对抗体的竞争能力强,形成不带酶的复合物量少,而带酶复合物量却相对增多,酶催化底物时产生有色产物的量也增多。因此,待检系统中颜色变化的程度与其中抗原的含量成反比。
(4)斑点ELISA(Dot-ELISA):Dot-ELISA是由ELISA发展而来的一种免疫酶标记新技术,其原理及步骤与常规ELISA基本相同,不同之处在于,一是将固相吸附载体用硝酸纤维素滤膜、硝酸、醋酸纤维素混合滤膜,重氮苄氧甲基化纸等固相化基质膜代替,用以吸附抗原或抗体;二是显色底物为不溶性的3.3-二氨基联苯胺(DAB)或4-氯-4-荼酚。结果以在基质膜上出现有色斑点来判定。Dot-ELISA既可以检测抗原,也可检测抗体。该法具有敏感性高、特异性强、样品用量少、节省材料、不需特殊设备、结果便于长期保存等优点。
2.ELISA所需的器材及设备 ELISA所需设备随建立的试验系统、采用的试验方法不同而有差异。一般需具备以下设备方可满足试验要求。
①制备ELISA抗原的设备:制备ELISA抗原的第一步是在鸡胚、细胞培养或培养基中繁殖病原,从中提取病毒或细菌,因此需要较大容量的高速或超速离心机,一次可供500~1000毫升液体材料离心的转头可满足大批和小批抗原制备的要求。一般密度梯度超速离心可完成抗原提纯,分子筛层析、离子交换层析、饱和硫酸铵和聚乙二醇沉淀及有机溶剂抽提等方法均可用于抗原的制备。
②微量加样器:ELISA整个过程通常需用单个或多个加样器,用于1~200微升溶液的加样。
③聚苯乙烯微量滴定板(酶标板)或固相化基质薄膜:这是ELISA操作的固相载体。
④酶联免疫检测仪:虽然ELISA结果可以经肉眼观察和判定,但对于更准确和快速测定,则需要酶联免疫检测仪。
3.ELISA试验条件
(1)ELISA试验所用的试剂和溶液配制:pH7.4PBS溶液、包被液(0.025摩尔/升pH9.6碳酸盐缓冲液)、洗涤液(于pH7.4PBS中加吐温-20使最终为0.05%即成)、封闭液(于洗涤液内加入牛血清白蛋白,使其最终浓度为0.1%即成)、pH5.0碳酸盐-柠檬酸盐缓冲液[0.1摩尔/升柠檬酸(19.2克/1000毫升)24.3毫升,0.2摩尔/升Na2HPO4(28.4克/1000毫升)25.7毫升,蒸馏水50毫升、底物溶液[邻苯二胺(OPD)-H2O2(pH5.0磷酸盐-柠檬酸盐缓冲液100毫升,邻苯二胺40毫克,30%H2O20.15毫升,临用前新鲜配制,配后立即使用。)]、终止剂(2摩尔/升H2SO4)。
(2)洗涤:在ELISA的整个操作过程中,需要进行多次洗涤。目的是防止重叠反应,以免发生非特异反应。因此洗涤必须充分和确实。洗涤液中可以加入助溶剂,如吐温-20。
(3)抗原:包被聚苯乙烯微量板用的抗原,可用物理或化学方法提取,例如感染组织或细胞培养物的提取物。用前检查抗原能否吸附固相载体,随后测定其最适浓度。
(4)抗体:用于包被微量滴定板的抗体应为提纯的IgG,并应具有较高的免疫活性。酶标记用的抗抗体(第二抗体)须是高效价的提纯制品,在与1毫克/毫升浓度的抗原(第一抗体)作琼脂扩散试验时,效价应在1∶32以上。
(5)待检样品:待检血清需要进行适当稀释,才能获得满意结果。待检病料,则应按病原种类进行适当的预处理。
(6)酶结合物:良好的结合物必须含有高效价的免疫活性以及酶反应性(一般用辣根过氧化物酶标记)。使用前需先测定最适使用浓度。配好的使用液要在12小时内用完。
(7)底物和终止剂:过氧化物酶的底物是H2O2,常用的供氧体是邻苯二胺(简称OPD)。OPD的反应产物呈橙色,可溶,敏感性高,易被浓硫酸终止反应。但对光敏感,故应避光进行显色反应。底物显色以室温20~30分钟为宜。
(8)结果判定:
肉眼判定:当只需回答“阳性”或“阴性”时,可用肉眼判定。目前许多商品试剂盒的应用就是按使用说明书测定后,用肉眼判定结果。
酶标仪判定:可按吸收光绝对值或被检样品吸收值/阴性对照样品吸收值的比值表示。常用比值判定法,即比值高于一定数值,如2~3(随样品种类而不同),判为阳性。
4.酶联免疫吸附试验测定流程 ELISA试验在正式试验前必须进行预备试验,以确定酶结合物和抗原的最适浓度,以及底物的最适时间等。
(1)预备试验:
①酶结合物最适浓度的测定。以pH9.6的碳酸盐缓冲液将IgG稀释至100微克/毫升,于酶标板的每一小孔中加入200微升,置湿盒中在4℃过夜。取出反应板用洗涤液洗涤3次。将酶标记的抗球蛋白作1∶100,1∶200,1∶400等一系列稀释,依次加入各小孔中,每孔200微升,并在室温中放置5小时。反应板用洗涤液洗涤3次。加入底物溶液,每孔200微升,在室温中放置30分钟。加入终止液终止反应。读取结果,以能产生光密度为1.0的稀释度为结合物的最适浓度。
②抗原最适浓度的测定。在ELISA试验中,酶结合物浓度确定后,应测定抗原包被载体的最适浓度。步骤如下:将抗原以pH9.6的碳酸盐缓冲液作1∶10、1∶20、1∶40、1∶80……一系列稀释,然后加到酶标板的小孔中,每个稀释度抗原加1个小孔,剂量为200微升。将酶标板置湿盒内,于4℃吸附18小时。取出板,用洗涤液洗涤3次。每孔加1∶200稀释的阳性参考血清200微升,并在室温下放置2小时。反应板用洗涤液洗涤3次。每孔加200微升最适稀释的酶结合物,在室温下作用3小时。反应板用洗涤液洗涤3次。每孔加200微升底物溶液,室温下作用30分钟(可根据底物选择合适时间)。用终止液终止反应。判读结果,以能产生光密度为1.0的稀释度作为抗原的最适浓度。
③底物的最适时间测定。以最适稀释度抗原和酶结合物进行试验,加入底物后在不同时间终止反应,即可确定最适时间。
(2)正式试验:在以上预备试验基础上,进行正式试验。由于测定的对象和方法不同,流程也不完全一样,现将Voller等(1976)总结的用酶标板做试验的测定流程介绍于表2-5。
表2-5 抗体和抗原的ELISA测定流程
5.斑点酶联免疫吸附试验(Dot-ELISA) 斑点酶联免疫吸附试验(Dot-ELISA)可采用直接法、间接法、双抗体法等,现以间接法检测抗体为例将其具体操作方法介绍如下。
(1)试验材料:固相载体硝酸纤维素滤膜(0.22~0.45微米),硝酸、醋酸混合纤维素滤膜(0.22微米)和重氮苄氧甲基化纸均可用作Dot-ELISA的固相载体。国内多家化工厂(如浙江黄岩人民化工厂)均有产品,应用效果甚佳。试剂包括包被液、洗涤液、样品稀释液(用含1%牛血清白蛋白的0.01摩尔/升pH7.2PBS)、固相载体封闭液(可用下列溶液:含3%~5%牛血清白蛋白的PBS,含3%明胶、0.1%Tween-20的PBS)、底物溶液(0.05摩尔/升pH7.5Tris-HCl100毫升,3.3-二氨基联苯胺50毫克,溶解后过滤,4℃避光保存,临用前按0.03%浓度加入H2O2)。
(2)试验方法:样品数量剪取一片硝酸纤维素滤膜,用直径为0.3~0.5毫米圆形打孔器在膜的光滑面压上点样圈,也可用铅笔轻轻划格,作为点样部位。然后将滤膜置于蒸馏水中浸湿(也可不浸湿)。取出滤膜,稍加干燥。用微量加样器取1~2微升一定浓度的抗原溶液,依次点于圈内,点样完毕,将滤膜置4℃过夜或37℃室温干燥。将滤膜置于盛有封闭液的平皿中,37℃封闭15~60分钟。用洗涤液冲洗滤膜3次。将抗原圈剪下(若检测抗原,可用待检材料直接点样,则不必剪下)置于微量反应板孔中,加入一定稀释度的血清样品,37℃反应1~2小时。设阳性血清与阴性血清对照。洗涤膜片3次。加入酶标抗抗体,(每孔50~100微升,37℃反应30~60分钟)。洗涤膜片3次。加入底物溶液,每孔50~100微升,染色反应10~20分钟。用蒸馏水漂洗膜片,终止反应。
(3)结果判定:若待检样品颜色比阴性对照深,即为阳性,反之为阴性。也可将血清样品作倍比稀释测定血清效价。
六、中和试验
特异性的抗病毒血清(中和抗体)与病毒作用,能够抑制病毒对敏感细胞的吸附、穿入和脱壳,从而阻止了病毒的繁殖,失去了感染力。这一反应不仅表现为质的方面,即一种病毒只能被相应的免疫血清所中和;而且也表现在量的方面,即中和一定量病毒的感染力,需要一定效价的抗体。
中和试验以检测病毒的感染力为基础,结果的判定以比较病毒受免疫血清中和后残余感染力为依据,这就决定了此项试验必须在病毒的敏感动物、鸡胚或组织培养内进行,并需设严格对照试验。
1.试验材料
(1)病毒:用于中和试验的病毒要求能在敏感动物、鸡胚或组织培养内能稳定传代培养,并且有较高的滴度,制成新鲜的病毒悬液,试验前,测定感染滴度(LD50、TCID50或EID50)。
(2)血清:用于中和试验所用的血清应无菌(可过滤除菌),不含任何化学保护剂(如甲醛等),需经56℃30分钟灭活,以破坏对热敏感的非特异性病毒抑制物。阴性对照血清一般用SPF鸡血清。
(3)稀释液:可以是细胞培养液、灭菌Hanks液或其他不损害病毒或宿主的液体。
(4)感染模型:动物通常用不含有待试病毒或相应抗体的健康鸡(或SPF鸡),应根据不同病毒感染、致病的特异性,选择适宜品种、日龄、体重及健康状况的鸡。在孵化器内孵育一定天数的健康鸡胚,一般不应有待试病毒的抗体。选择对所试病毒敏感的原代或传代细胞组织培养,细胞繁殖旺盛,无病毒、细菌或支原体污染。
2.试验方法 病毒中和试验有固定病毒-稀释血清法(β法)和固定血清-稀释病毒法(α法)两种。
(1)固定血清-稀释病毒法(α法):
①病毒滴度测定。
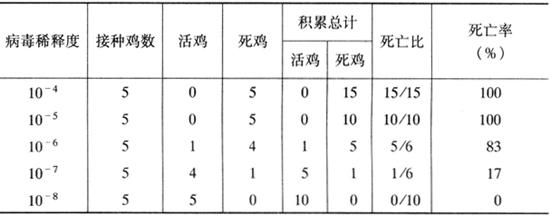
a.LD50(半数致死量)滴定(以鸡新城疫病毒为例):取鸡新城疫病毒悬液(或尿囊液),以10倍递次稀释法稀释成不同稀释度,分别接种1月龄小鸡,每只肌肉注射0.1毫升,每个稀释度病毒接种5只,每个稀释度病毒接种的小鸡饲养在一个隔离器内,写明稀释度标记。逐日观察记录鸡死亡数。死亡百分率计算参照表2-6。
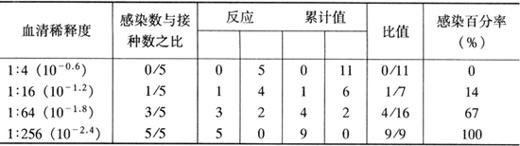
表2-6 LD50的计算
LD50计算:先按下列公式计算出距离比例
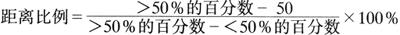
再将>50%死亡率稀释度的对数(Log)与距离比例相加,即为LD50数。将表2-6中结果代入以上公式LD50=6+(83-50)/(83-17)=6+0.5=6.5。
b.EID50(鸡胚半数感染量)滴定(以鸡传染性支气管炎病毒为例):取病毒尿囊液,以10倍递次稀释法稀释成不同稀释度,分别接种9~10日龄鸡胚尿囊腔,每只胚接种0.1毫升,每个稀释度接种5只胚,以蜡封口,留5只不接种作对照。置37℃孵育5天。打破鸡蛋取出小鸡称重,凡体重比对照组最小体重小2克以上的判为阳性。
c.TCID50(组织培养半数感染量)滴定(以致细胞病变的病毒为例):取新鲜病毒悬液,以10倍递次稀释法稀释成不同稀释度,分别接种经亨克氏液洗3次的组织培养细胞板的孔内,每孔接种0.1毫升,每个稀释度接种8个孔(一列),放37℃吸附1小时,以亨克氏液洗3次,加入细胞维持液,放37℃培养(细胞板一般需放含5%CO2培养箱内培养),逐日在普通显微镜下观察记录细胞病变情况,一般观察4~6天。阳性百分率和TCID50计算方法同上。
②中和试验。先将病毒作2×10稀释,然后按10倍递次稀释法稀释,使之成为2×10-2,2×10-3,2×10-4……中和试验选择的病毒稀释范围,要根据病毒滴定的结果判定。如病毒的滴度为10-6,则试验组选用2×10-2~2×10-8,对照组选用2×10-4~2×10-8。将选定的稀释度病毒分别定量加入两排无菌试管内。一排每管加入与病毒等量的被检血清作为试验组,另一排每管加入SPF血清作为对照组。充分摇匀后放37℃水浴作用1小时。从被检血清组最低浓度的病毒液开始,经适当的接种途径接种动物(鸡胚或组织培养),以同法计算试验组及对照组的LD50(EID50或TCID50)。
③结果计算。对照组(SPF血清组)LD50(EID50或TCID50)减去试验组LD50(EID50或TCID50)差数的反对数,为被检血清的中和指数。中和指数<10判为阴性,10~50为可疑,>50判为阳性。
(2)固定病毒-稀释血清法(β法):
①病毒滴度测定。方法同上。
②中和试验。将试验血清作系列倍比稀释,使之成1∶2,1∶4,1∶8……将病毒稀释成每只动物(鸡胚或细胞培养瓶)1/2接种量中含100LD50(EID50或TCID50)。不同稀释度血清与等量病毒相加,摇匀放37℃水浴作用1小时,接种动物(鸡胚或组织培养)。设阳性血清对照、阴性血清对照和病毒滴度测定对照。
③结果计算。固定病毒-稀释血清法中和试验的结果计算,是计算保护50%动物(鸡胚或细胞培养)不死亡(不感染)的血清稀释度。计算方法如表2-7。
表2-7 50%血清中和终点计算

50%中和终点或半数保护率=距离比例×血清稀释倍数+用于计算距离比例的低稀释度的对数=0.67×(-0.6)+(-1.2)=-0.4+(-1.2)=-1.6
-1.6的反对数=1/40
即该血清的中和效价为1∶40。