溴
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第14页(5257字)
一、物理性质
溴分子由两个原子组成,分子量159.81。为深红棕色发烟液体,在室温下挥发,生成红棕色蒸气。溴蒸气为空气重量的5.515倍。微溶于水,易溶于乙醇、乙醚、苯、氯仿、二硫化碳等有机溶剂,溶液呈褐色,也易溶于盐酸,氢溴酸和溴化物溶液中。在低温时,则固化为带有金属光泽的暗红色针状晶体。溴水是溴的饱和水溶液,棕黄色,在-20℃时也不冻结,温度低于5.84℃时,游离溴不稳定,而其水合物为稳定相。在接近水的冰点时,溴则生成带有7.8或10摩尔的溴水合物。溴水的蒸气压,由于溶解盐而降低。加热时,溴蒸气即从溶液中逸出,溴蒸气压与温度的关系见图1-1-3。在日光的作用下,能形成氢溴酸。溴蒸气强烈地刺激眼睛及呼吸器官,能引起流泪、咳嗽、喉痛、头晕、头痛和鼻出血,浓度较高的还会引起窒息和支气管炎,溴素溅到皮肤上,能引起严重灼伤。其他物理数据为:
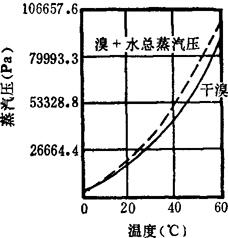
图1-1-3 溴蒸汽压与温度关系图
气体密度,对空气15℃ 5.5140g/cm3,102.6℃ 5.7280g/cm3,175.58℃ 5.6040g/cm3,227.92℃ 5.5243g/cm3
液体密度  3.1396g/cm3,
3.1396g/cm3, 3.1226g/cm3,
3.1226g/cm3, 3.1055g/cm3,
3.1055g/cm3, 3.0879g/cm3
3.0879g/cm3
固体密度 0~123°K 4.17~4.05g/cm3
饱和溴水溶液的相对密度 0℃ 1.028
膨胀系数 α 20~30℃ 0.0011/℃
压缩系数 20℃,10~100MPa,6.25×10-6
溴水相对密度:

液体粘度η:-4.3℃1.31×10-3Pa·s,0℃1.241×10-3Pa·s,12.6℃1.07×10-3Pa·s,16℃1.0×10-3Pa·s,19.5℃ 0.995×10-3Pa·s,28.9℃ 0.911×10-3Pa·s
气体粘度η:12.8℃ 151×10-7Pa·s,65.7℃ 170×10-7Pa·s,99.7℃ 188×10-7Pa·s,139.7℃ 208×10-7Pa·s,179.7℃ 227×10-7Pa·s,220.3℃ 248×10-7Pa·s
表面张力(液体):25℃0.000398N/cm
蒸气压:

每个晶包中分子数,5.84℃时为4克分子
结晶水克分子数:0℃,为7、8、10克分子
晶格常数:a=0.448nm,b=0.667nm,c=0.872nm
结晶半径0.195nm,共价半径0.1142nm
气态溴在水中溶解度:

溴的饱和水溶液:101.325kPa,20~25℃,含溴3.22~3.41%
水在溴中的溶解22℃,0.046%
液态溴在水中的溶解度

注:在0℃时的数据是不同作者所得结果。
在不同盐溶液中的溶解度(25℃)

注:①20.6℃,②20.8℃
水解平衡常数 利用下式计算 ,0℃ 0.7×10-9
,0℃ 0.7×10-9
20℃ 5.2×10-9
35℃ 11.3×10-9
熔点 -7.2℃; 沸点58.78℃; 解离常数1000℃ 8×10-3
解离度 800℃ 0.16%, 850℃ 0.20%, 900℃ 1.48%,
950℃ 2.53%, 1000℃ 3.98%, 1050℃ 6.3%,1284℃ 18.3%
临界温度 315℃, 临界压力10,335,15Pa; 临界密度1.26g/cm3;
气体导热系数 273~700K 1.20~1.52×10-4
溴水相对密度

液体热导系数 283~323K 3.04~2.52×10-4;
气体热容 83~228℃ 0.2314J/(g·℃);
液体热容 25℃ 0.4729J/(g·℃);
固体热容 -23.15℃ 0.3707J/(g·℃);
熔融热 ΔH熔融-7.25℃ 66.11J/g;摩尔热 25℃气体 30.71J/(mol·℃);
气化热 ΔH气化59℃ 187.44J/g;离子化热 ΔH离子化 1046kJ/mol;
解离热 ΔH解离 238.1kJ/mol;熵 S°25℃ 245kJ/(mol·℃);
气化熵 S°气沸点时 88.89kJ/(mol·℃);液体折射率  、1.6083;
、1.6083;
固体折射率  1.6475;电阻率 25℃ 6.5×1010Ω/cm;
1.6475;电阻率 25℃ 6.5×1010Ω/cm;
气体介电常数ε标准状态下 1.0047;液体介电常数 273~303°K 3.255~3.080;
电导率λ液体 17.2℃ 1.3×10-13S/cm;气体磁化率×10-6-73.5c.g.s制电磁单位;
液体磁化率×10-5-56.4c.g.s制电磁单位;电离势10.54±0.03电子伏特
电极标准电位  Br2+2e=2Br-+1.0652V;电负性2.8。
Br2+2e=2Br-+1.0652V;电负性2.8。
二、化学性质
溴的化学性质特别活泼,位于氯、碘之间,几乎能与所有元素起反应,生成相应的化合物。除贵金属外,溴能与所有金属化合,放出大量的热。
氧化反应 溴是强氧化剂,许多反应起因于它的强氧化性。在有水分存在时,能把二氧化硫氧化成硫酸,并生成溴化氢,在碱性介质中,氨、尿素等氮化物,被氧化产生氮气。
溴与镁、银、铅和镍起反应,先生成溴化物外层,可以阻止进一步向内部反应,这种保护层,使铅成为容溴的有用器具。在溴腐蚀金属过程中,湿气起了重要作用,原因是溴水解溴化氢和溴氢酸,在水量低于40%的情况下,可用镍容器装运溴素。干燥溴与铁反应比较慢,可生成溴化铁保护层。
溴元素很容易加入不饱和化合物中,如二溴化乙烯的生产,即加溴到乙烯中,Br2+C2H4→BrCH2·CH2Br。
取代反应 溴与芳香族体系接触,则起吸电子取代反应。这种反应的进行,须有吹化剂,最普通催化剂是溴化物离子或氯化物离子或者是铝。溴对氢的均裂取代,是生产几个溴化物的一般反应。与烧基芳香族化合物产生这个反应是很容易的,从甲苯的苯基溴化生产溴化苯,可以说明这个问题。
溴与烧碱或纯碱起反应,可生溴化钠,与氨起反应可生产溴化氨,向液态溴中通氯气可生产氯化溴。
三、用途
溴是制取溴的有机、无机化合物的主要原料,广泛地用在各有关方面:
(1)石油工业 溴的最大用途在石油工业中是生产二溴化乙烯,它与四乙基铅合成乙基溶液,可作飞机,汽车等内燃机抗爆剂,近年来由于铅的污染问题,虽用量减少,但还占总消耗量的一定比例。由溴生产的溴化钙,可作一种填充液,用在油井钻探和维修方面。
(2)杀虫灭菌 溴的杀虫灭菌力很强,在农业上用薰蒸剂、杀虫剂。近年来有些溴化物,用作植物生长激素,可增产10%左右,溴的比重大,毒性比氯小,适于上下水道杀菌之用。
(3)医药 用溴可生产氯霉素、金霉素,合霉素、甲种维生素种激素的中间体等。此外,还可用于镇静剂、麻醉剂、抗生素等药物合成方面。
(4)印染纺织 溴及溴化物用于制造靛系染料及酸性染料中间体,可使色泽鲜明,增进着色力和牢固性。特别是亚溴酸钠,可作还原性硫染料的氧化剂,既可避免环境污染,又可减少各种原料消耗。在纺织品上浆、退浆、印染漂白方面、大量使用。
(5)化学试剂 主要作氯化剂、溴化剂、催化剂指示剂等。
(6)阻燃剂 溴系有机阻燃剂功效高,用量少,对聚合物加工使用不良的影响也少,因此,大量用于建材、交通、电器、家具制品中。
(7)化学工业 主要用作催化剂、致冷剂及有机合成反应的中间体等等。
(8)摄影及感光材料 溴的银、钾、钠、氨、锌等化合物是摄影感光材料上必需的化学药剂。
(9)消防及国防工业 溴蒸气是毒性强、相对密度大、有刺激性恶味的气体,可作军事上的催泪剂,还可用于火箭,宇宙飞船耐热罩的制造。溴化锌用于制造核反应器的观测窗、X射线的屏罩。溴的氧化物、氯化物,可用作火箭的推进剂。在消防上可制造高效低毒灭火剂,如“1211”灭火剂,有强大的灭火性能。
1985年,全世界共用溴35万吨,其中:石油工业11.5万吨,农业7万吨,阻燃剂8万吨,染料4万吨,照相2万吨,药品1.5万吨,其他方面1万吨。随着溴的二次、三次产品不断增加,对溴的需要量,也将相应上升。
四、质量标准
我国轻工业部1982年颁布的标准(QB-349-82)见表1-1-10。
表1-1-10 1982年部颁标准

苏联、日本、美国溴的国家标准见表1-1-11、表1-1-12。
表1-1-11 前苏联溴的国家标准(ГОCT 454-76)

表1-1-12 日本、美国溴的国家标准
