工艺原理及控制条件
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第1610页(10566字)
(一)原料液的酸化及氧化
用转子流量计计量,向原料液中加入工业硫酸,将pH调到适当数值,与氯气一并送入氧化塔,在塔中进行氧化,反应式同前。
生产实践表明:用海水为原料时,pH值调3.5左右,配氯率160%,氧化率可达到95%以上;用10~12°Bé卤水(含溴量0.2~0.8kg/m3)为原料时,pH值调到3.8~4,配氯率120%,氧化率可达到90~95%;用14~14.5°Bé卤水时(含溴量0.3~0.35kg/m3),pH值调到4~4.5,配氯率105~115%,氧化率也可达90~95%。说明原料液中溴含量较多,配氯率可适当降低,减少氯气消耗。
(二)空气吹出
1.气-液相的平衡关系及传质过程 在空气吹出塔中,溴吹出率的高低,空气消耗量的大小,都与溴在气液两相的平衡关系有密切关系,是重要的生产工艺指标。
液态澳在水中的溶解度见表6-3-14。
表6-3-14 液态溴在水中的溶解度

气态溴在水中的溶解度见表6-3-8。
因原料液中溴含量较少,可用亨利定律来表示溴在气液相的平衡关系。
CBr=H′·PBr (6-3-8)
或PBr=HXBr (6-3-9)
式中 CBr——溴在原料液中的浓度(公斤分子/m3)
PBr——溴在平衡的气相中的分压(Pa)
XBr——溴在原料液中的克分子分数
H′——溶解度系数,〔公斤分子/(m3·Pa)〕
H——亨利系数(单位与PBr相同)
H与温度的关系见表6-3-15。
表6-3-15 澳-水体系的亨利系数与温度的关系

由表可知,亨利系数随温度的升高而增大。故当原料液含溴量一定时,高温下与原料液平衡的气相溴分压要比低温时为高,北方海盐区冬季溴的吹出率要明显地低于夏季。
吹出塔内溴由液相转变到气相的传质过程见图6-3-14。
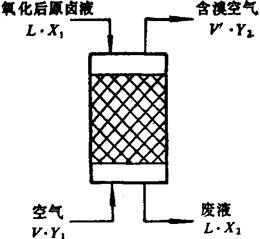
图6-3-14 空气吹出塔传质示意图
吹出塔在单位时间解吸的溴量G为:
G=Kl·S·△Xm (公斤分子/h) (6-3-10)
G=Kg·S·△Ym (公斤分子/h)
或:G=LX1-L′X2 (公斤分子/h) (6-3-11)
G=V′Y2-VY1 (公斤分子/h)
式中 G——单位时间内吹出塔内所解吸出的溴量(公斤分子/h)
S——吹出塔内有效的气液接触面积(m2)
Kl——液相总传质系数〔公斤分子/(m·h)〕
Kg——气相总传质系数〔公斤分子/(m·h)〕
△Xm——吹出塔内液相传质推动力(公斤分子/m3)
△Ym——吹出塔内气相传质推动力(公斤分子/m3)
L——氧化后含溴原料液流量(m3/h)
V——单位时间内进入吹出塔的空气量(m3/h)
V′——单位时间内排出吹出塔的含溴空气量(m3/h)
L′——单位时间内排出吹出塔的废液量(m3/h)
X1,X2——进出吹出塔原料液及废液的含溴量(公斤分子/m3)
Y1,Y2——进出吹出塔新鲜空气及含溴空气的含溴量(公斤分子/m3)

式中 X1′——与含澳空气组成Y2呈平衡的液相组成(公斤分子/m3)
X2′—-与新鲜空气呈平衡的液相组成(公斤分子/m3)
Y1′——与氧化后原料液组成X1呈平衡的气相组成(公斤分子/m3)
Y2′——与废液组成X2呈平衡的液相组成(公斤分子/m3)
若忽略热效应及压力变化而引起的体积变化和雾沫夹带损失时,L≈L′,V≈V′。
则 G=L(X1-X2)=V(Y2-Y1) (6-3-14)
2.溴的吹出率 影响吹出率的因素主要有温度、气液比及塔的操作条件。
温度低时,溴的亨利系数小,平衡分压降低,传质推动力相应减小;为了保持一定的吹出率,必须增大气液比。温度、气液比及吹出率的关系见图6-3-15。
由图6-3-15可见,在夏季气温较高、气液比为50∶1时,吹出率可达95%以上。

图6-3-15 在不同温度下,吹出率与气液比的关系
操作条件主要是指吹出塔的空塔气速及喷淋密度。适当地提高空塔气速及喷淋密度可强化传质过程,增加吹出率。但空塔气速必须低于液泛速度,否则吹出塔不能稳定地操作。
3.空气消耗量 空气消耗量可由吹出塔的物料衡式导出,按公式(6-3-14),L(X1-X2)=V(Y2-Y1)
即

式中 符号同式(6-3-13)
实际生产中要有相当过量的空气。空气过量系数η通常取2~4.5。原料液中溴含量增加时,空气消耗量相应增加。不同原料液生产1kg溴的空气耗量,见表6-3-16。
表6-3-16 各种不同原料液,每制1kg澳空气的消耗量

注:取过剩系数η=3.2
以海水为原料时,气液比以50~60∶1为好;以10~14°Bé的低度卤水为原料时,较适宜的气液比是120~170∶1。喷淋密度15~50m3(m2·h),空塔气速0.5~0.8m/s。
4.吹出塔的直径和高度塔径可根据空气用量及选定的空塔气速算出,即:

式中 D——吹出塔直径(m)
V——空气用量(m3/h)
u——空塔气速(m/s)
填料高度可由填料总体积及塔径算出。填料总体积用量可由传质速率方程及填料性质导出。按公式(6-3-10):
G=Kl·S·△Xm=Kg·S·⊿Ym
则

式中 符号用公式(6-3-10)。

式中 Z——填料层高度(m)
α——单位体积填料的有效表面积(m2/m3)
要增加溴的吹出率,必须增加吹出塔内填料层的高度。工业生产中填料层的高度多为6~10m。
5.填料层的阻力 与空塔气速的平方成正比,随喷淋密度增加而增加。在不同喷淋密度的条件下,1m高填料层的阻力与空塔气速的关系见图6-3-16。
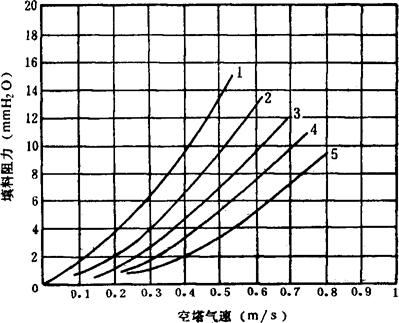
图6-3-16 1m填料层(50×50×5)的阻力与空塔气速的关系
1-喷淋密度50m3/m2时 2-喷淋密度30m3/m2时 3-喷淋密度15m3/m2时 4-喷淋密度10m3/m2时 5-干填料
当空塔气速低于载点气速时,可用以下经验式计算填料层的阻力:

式中 △P——每米填料层的阻力(kg/m2)
A及B——液体及气体的重量流量〔kg/(m3·h)〕
r2及YG——液体及气体的重度(kg/m3)
α及β——实验常数,其值随填料种类而不同,由表6-3-17查取。
表6-3-17 不同填料时实验常数α和β的值

注:1in=25.4mm
正常操作时,吹出塔的阻力应基本稳定;若阻力突然升高,通常是由于喷淋密度过大、填料破碎或填料层结垢堵塞所致,应及时处理,保证正常操作。
(三)化学吸收
解吸后的含澳空气中,每米3仅含溴几克,甚至在1g以下,一般采用化学吸收法提取。
溴的吸收剂很多,有属于还原性的,如铁屑、二氧化硫、碱的氨溶液等;有属于碱性的,如苛性碱(钾或钠)、碱金属的碳酸盐与碳酸氢盐、石灰乳等;还有可从含溴空气中直接吸收溴的,如活性炭等。目前广泛应用的有纯碱或烧碱溶液、二氧化硫、铁屑及低温澳盐溶液。
1.碱液吸收 配成一定浓度的纯碱溶液与含溴空气在吸收塔中的填料表面进行逆流接触,游离溴被碱吸收,发生下列反应:
3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑
3BrCl+3Na2CO3=NaBrO3+2NaBr+3NaCl+3CO2↑
有氯气存在时,还有以下反应:
Br2+5C12+6Na2CO3=10NaCl+2NaBrO3+6CO2↑
用纯碱溶液吸收溴时,有碳酸氢钠生成,它在溴化物-溴酸盐溶液中溶解度较小,为了避免填料被沉淀堵塞,在吸收过程的最初阶段,应采用5~10%的纯碱溶液。为了得到较高浓度的NaBr、NaBrO2溶液,可在吸收过程中补充固体纯碱烧碱溶液。碱液吸收法的工艺设备流程见图6-3-13。
Na+//Br-,BrO3-,HCO3--H2O体系的溶解度见图6-3-17。

图6-3-17 Na+/Br-,BrO3-,HCO3--H2O体系平衡相图
根据,И.Σ.Лyrин,Σ.C.Жyиapкцн,B.И.Жceмreнкo,К·Л·Σpoфeeкa等的研究,在一定的浓度范围内,吸收速度仅取决于气体界面层的阻力,即吸收速度与气相的传质推动力成正比,可按下式计算:
G=KF°τ△Cg (6-3-20)
式中 G——吸收的溴量(kg)
K——化学吸收系数(m/h)
F——气液接触面积(m2)
°τ——接触时间(h)
△Cg——气相传质推动力(kg/m3)
B·И·Кceиeнкo和К·Л·Σpeocpecкa的试验结果表明,吸收系数K只与空塔气速有关,而与气体混合物中溴的浓度、吸收剂的化学吸收容量及喷淋密度无关。K值与气体速度的关系可用下列方程表示:

式中 ωg——空塔气速,(m/s)
在不同空塔气速下,化学吸收系数K值见表6-3-18。
表6-3-18 不同空塔气速下的化学吸收系数K值

我国以碱液作为吸收剂的厂家,多采用两个吸收塔。新配制的碱液在Ⅱ塔加入,不断用泵循环,吸收来自Ⅰ塔的尾气,并将部分循环碱液不断泵入Ⅰ塔的缓冲槽。新解吸出来的含溴空气进入Ⅰ塔,与来自Ⅱ塔的碱液逆流循环吸收。
新配制的碱液浓度为1~1.5N。当Ⅰ塔内的碱液含溴量达100kg/m3左右,碱度降至0.3N以下时,称为吸收完成液,可泵出去加酸蒸馏工序。Ⅱ塔的排空尾气中含溴量为0.05g/m3以下,溴的吸收率可达95%以上。
碱液吸收塔一般采用填料塔,结构与吹出塔类似。用两个吸收塔组成逆流吸收,效果较好。空塔气速一般为0.5~1m/s,喷淋密度为10~30m3/(m2·h),原料液含溴量高时可适当取高值。
纯碱液吸收法工艺成熟,生产稳定,易于控制;但碱的利用率仅60~70%,吸收完成液中澳含量较低,蒸馏前需加酸中和,增加物料消耗。
也可用烧碱液作为吸收剂,反应式为:
Br2+2NaOH=NaBr+NaBrO+H2O
当温度较高时,反应为:
3Br2+6NaOH=5NaBr+NaBrO3+3H2O
2.SO2吸收 在有水存在的情况下,SO2与溴发生下列反应:
Br2+SO2+H2O=H2SO4+2HBr
二氧化硫气体可由熔融的硫磺或燃烧的黄铁矿(FeS2)产生。
在吸收塔内,HBr和H2SO4的混合物呈微小液滴及雾沫状,被循环的混合酸液吸收。尾气捕沫后,封闭返回吹出塔,重新解吸氧化后的原料液。
SO2加入量需过量5~10%。吸收完成液为含HBr10~20%、含H2SO48~18%、含HCl1%以下的混合酸,通入氯气可使溴离子氧化成为游离溴,再用蒸馏制得成品溴。蒸馏废液含HCl4.5~9%,含H2SO45~10%,可用于酸化原料液。
用二氧化硫作吸收剂时,常用钢筋混凝土塔,内衬耐酸塑料板,塔内填料为玻璃棉或瓷质拉西环或鞍形填料。吸收塔后应设捕沫器,以便回收尾气中没有反应的二氧化硫和游离溴,并减少对环境的污染。
也可用亚硫酸溶液作吸收剂,效果相同。
Br2+H2SO3+H2O=2HBr+H2SO4
美国还采用溴,硫和水直接进行放热反应:
S+3Br2+4H2O=6HBr+H2SO4
在90~100℃时,该反应进行得相当快。硫与溴先反应生成S2Br2,再进一步同溴和水反应生成HBr和H2SO4。
美国道化学公司空吹法制溴(亚硫酸吸收)工艺流程见图6-3-18。

图6-3-18 美国道化学公司空气吹出法制溴流程示意图
3.低温溴盐溶液吸收法 如以溴化钠溶液为吸收液,其反应式为:

溴盐溶液浓度越高,所吸收的溴越多。25℃时不同浓度的NaBr溶液可吸收的溴量见表6-3-19。
表6-3-19 25℃不同浓度的NaBr溶液可吸收的澳量

加热吸溴后的溶液,可使被吸收的溴很容易地蒸馏析出,冷凝后成为液溴。脱溴后的溴盐溶液可循环用作吸收剂。
以色列死海制溴有限公司用此法制溴的工艺流程见图6-3-19。

图6-3-19 死海咸水空气吹出法流程示意图(溴化钠低温吸收法)
1-氧化塔 2-吹出塔 3-脱氧塔 4-吸收塔 5-蒸馏塔 6-澳水分离器 7-冷冻系统 8-冷凝器
该公司以浓度为35g/L的NaBr溶液作为吸收剂,用死海咸水提钾后的母液(含溴1~1.2%)为原料,氧化后引入吹出塔。吹出的含溴空气含溴量高达200g/m3(即15%)。含溴空气经脱氯塔用原料卤水脱除氯气后,再进入吸收塔,以冷却到-18℃的NaBr溶液喷淋吸收。吸收完成液由最后一个吸收塔出来时,温度已升至10℃,含溴量为35%左右。吸收完成液在蒸馏塔中用蒸汽间接加热蒸馏,蒸馏釜中加热蒸汽温度达110℃时,溴即由溶液中析出。脱溴后的NaBr溶液引入氨冷冻系统,冷却后再返回系统作吸收剂用。由吸收器排出的冷空气作为氨的冷却剂用。
采用这种方法,含溴空气必须脱氯,否则所含的杂质氯进入吸收塔会取代NaBr而生成NaCl,使吸收液中含溴量降低,从而降低吸收液对溴的吸收量。
此法蒸汽耗用量仅为水蒸汽蒸馏法的1/15,但电能耗量较大。用于含溴较高的原料较经济,所制得的液澳质量高,含氯量仅为0.01~0.02%。
4.铁屑及澳化亚铁吸收法 含溴空气与铁屑能迅速地发生下列反应:
Fe+Br2+aq=FeBr2·aq
2Fe+2Br3+aq=2FeBr3·aq
溴化铁又同新的铁屑按下列反应相互作用:
2FeBr3+Fe=3FeBr2
结果生成含少量溴化铁(约5%)的溴化亚铁溶液,含溴量为400~700g/L。另外,溶液中还含有少量的氯化铁及很细的氧化铁水合物,使杂质沉淀困难,或形成胶状溶液。
为了除去溶液中的三价铁离子,可将溶液加热,存放在装有铁屑的槽子里,使Fe+3还原成Fe+2。
铁屑吸收塔用砖、钢筋混凝土或木材制成。砖塔需以耐酸砖衬里。塔内铁屑层高4m,含溴空气在吸收塔内停留10~12s以上保证吸收完全。溴空气由吸收塔的上部进入,溴化亚铁循环液也由塔的上部喷淋而下,采用顺流吸收;若含溴空气从塔底部进入,则生成很多溴化铁,而溴化铁对设备腐蚀性很强。
铁屑通常是车床的下脚料,进塔前需进行焙烧,再以1~1.5%的硫酸洗涤除锈,每吨铁屑耗用0.05~0.07t酸。酸洗后用清水洗涤,并立即装入塔内,以免铁屑氧化。铁屑装入量与空气中的含溴量有关,可间断装入,每装一次使用20~60天。
铁屑吸收塔在使用初期阻力较小,当空塔气速为0.3~0.5m/s时,阻力仅有294~392Pa,以后铁屑表面被逐渐氧化,阻力可增至2940~3920Pa,此时为了保持一定的吹出率,需相应降低吹出塔的生产能力。
吸收完成液中含溴量为400~700g/L,蒸发此溶液至沸点132~134℃时,溶液含溴49~51%(FeBr2为70.2%),冷却后生成6水与4水混合晶体。FeBr2-H2O体系的溶解度图见图6-3-20。

图6-3-20 FeBr2-H2O体系溶解度图
1一冰晶区 2-FeBr2 9H2O结晶区 3-FeBr2·6H2O结晶区 4-FeBr2·4H2O结晶区 5-FeBr2·2H2O结晶区
在真空下蒸发溴化亚铁溶液可转变成熔块。在0.089MPa的真空下其沸点仅为55℃,因而腐蚀性降低,可以达到安全操作的要求。
由溴化亚铁熔体制取液溴的过程分二步进行,首先用氯气把二价铁氧化成三价铁,其反应为:
2FeBr2+3Cl2=FeCl3+3Br2
2FeBr2+Br2=2FeBr3
再进一步氧化得元素溴,其反应为:
2FeBr2+3Cl2=2FeCl3+3Br2
在设有蒸汽夹套的密闭的搪瓷反应器内,元素溴很快被蒸馏出来,冷凝后得液溴。含有氯化铁的残液流入结晶器,析出FeCl3·6H2O晶体。
用溴化亚铁的浓溶液从含溴空气中吸收溴,比铁屑吸收法可增大吸收率2~3%。吸收塔内装50×50×5的拉西环,高3~4m溴化亚铁溶液不断循环,塔内喷淋密度为1.5~3m3/m2时,逐渐为溴所饱和。
2FeBr2+Br2=2FeBr3
直到80~95%的Fe2+转化为Fe3+为止。
(四)吸收完成液蒸馏法制液溴
碱液吸收法得到的吸收完成液,碱度为0.2N左右,含溴量为80~100kg/m3,按理论加酸量的120~130%加入硫酸(浓度为20%),使Br-被氧化成游离溴,其反应如下:
5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
蒸馏后的废液pH值通常控制在2以下,并按此调节加酸量。
酸化后的吸收完成液经水蒸汽蒸馏、冷凝及溴水分离等工序,制得成品溴。控制工艺条件如下:
蒸馏塔出溴口温度:75~85℃
蒸馏塔内压力(表压):4904~9807Pa
蒸馏塔内喷淋密度:约为4m3/(m·h)
(填料为25×25瓷环)
蛇管冷凝器冷却水温:24~27℃
以海水为制溴原料时(25℃),空气吹出法制溴总收率为80%左右。