食品中乳酸及其盐类的测定方法
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第9页(6262字)
化学名:2-羟基丙酸;丙醇酸(Lactic Acid)
结构式

分子式:C3H6O3
相对分子质量:90.08
一、乳酸的鉴别
取本品的水溶液,加高锰酸钾试液,加热,即发出乙醛的臭气。
二、乳酸含量的测定
1.试剂和溶液
1.1 1mol/LNaOH溶液。
1.2 0.5mol/L( H2SO4)滴定液。
H2SO4)滴定液。
1.3 酚酞指示液。
2.测定方法
取本品约1g,精密称定,加水50mL,准确加入1mol/LNaOH溶液25mL,煮沸5min,加酚酞指示液2滴,趁热用硫酸滴定液(0.5mol/L)滴定,并将滴定的结果用空白试验校正,即得。每毫升氢氧化钠滴定液(1mol/L)相当于90.08mgC3H6O3。
乳酸盐类
化学名:乳酸铁(Ferrous Lactate)
结构式:

分子式:C6H10FeO6·3H2O
相对分子质量:288.04
化学名:乳酸钙(Calcium Lactate)
结构式:

分子式:C6H10CaO6·5H2O
相对分子质量:308.04
化学名:乳酸钠溶液(Sodium Lactate Solution)
分子式:C3H5NaO3
相对分子质量:112.06
乳酸钠溶液为乳酸的40%~60%的溶液。
食品中的乳酸及其盐类,采用气相色谱法或乳酸脱氢酶法进行定量测定,乘以相对分子质量比,求得各种盐含量。测定值为食品天然和添加的乳酸总量。
三、食品中乳酸及其盐类的测定
(一)气相色谱法
1.试剂
乳酸,特级品。
2.仪器
2.1 带氢火焰检测器的气相色谱仪。
2.2 实验室常规仪器。
3.操作步骤
3.1 样品溶液的制备。
3.1.1 液体食品:准确称取含50~500mg乳酸的样品(乳酸浓度在0.1%以下时,减压浓缩成0.1%~1%),加水至50mL,即为样品溶液。
3.1.2 固体食品:准确称取含50~500mg乳酸的样品,按1g样品加3mL水的比例,加水均质20min,减压过滤,每次用10mL水洗容器3次,通过过滤器过滤,合并滤液和洗液,必要时减压浓缩至约40mL,加水至50mL,过滤,即为样品溶液。
3.1.3 油脂食品:准确称取含50~500mg乳酸的样品,按1g样品加3mL水的比例,加水均质20min,移入刻度离心管中,冷冻高速离心分离(10000r/min,离心10min),分取上清液。离心管中残渣,按1g样品加5mL水比例加水,同样冷冻高速离心,重复3次。合并全部上清液,减压浓缩至约40mL,加水至50mL,必要时过滤,即为样品溶液,但是,如果离心后,上清液分为油层和水层,或有明显的混浊,则应进行脱脂处理。
脱脂操作是将全部上清液转移于分液漏斗中,用30mL乙醚与正己烷混合液(2∶1)振摇脱脂,重复3次,定量地分取水层,减压浓缩至约40mL,加水至50mL,必要时过滤,即为样品溶液。
3.2 标准液的制备 准确称取3g乳酸(90%),加水至270mL,加热回流约15min后,冷却至室温,即为标准液。准确吸取20mL标准液,置于200mL的烧杯中,加酚酞指示剂,用0.1mol/LNaOH溶液滴定,按式(1-5)计算出标准液的乳酸浓度:

式中 F——0..1mol/LNaOH溶液的因数
a——消耗0.1mol/LNaOH溶液的体积,mL
b——取标准液的体积,mL
准确取标准液1mL,5mL,10mL,各加水至10mL,即为标准曲线用标准液(此液分别含乳酸0.1×c′mg/mL、0.5×c′mg/mL、1.0×c′mg/mL)。
4.测定方法
4.1 测定条件 用带氢火焰检测器的气相色谱仪(FID-GC),按以下条件进行测定。
填充剂:60~80目的含10%聚乙二醇6000的对苯二甲酸担体
柱:玻璃柱,内径3mm,长50cm
柱温:160℃
检测器及进样口温度:200℃
载气:氮气,50mL/min
4.2 标准曲线 准确各取1μL标准曲线用标准液,注入气相色谱仪中,由所得乳酸的峰高,绘制标准曲线。
4.3 分析结果的表述 准确吸取1μL样品溶液,注入气相色谱仪中,测得峰高,查标准曲线得样品溶液中乳酸的浓度(mg/mL),按式(1-6)计算出样品中乳酸的含量(%)。

式中 ρ——样液中乳酸浓度,mg/mL
m——取样量,g
乳酸钙质量分数(%)=乳酸质量分数(%)×1.711
乳酸铁质量分数(%)=乳酸质量分数(%)×1.599
乳酸钠质量分数(%)=乳酸质量分数(%)×1.244
(二)比色法
1.原理
乳酸在乳酸脱氢酶的作用下,进行如下反应:
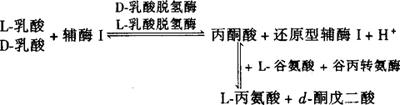
按需要乘以系数,分别求出盐类的量,食品中存在天然乳酸,所以测定值应为食品中天然和添加的乳酸总量。
2.试剂和溶液
2.1 甘氨酰替甘氨酸 特级。
2.2 甘氨酰替甘氨酸缓冲液 溶解4.75g甘氨酰替甘氨酸及0.88gL-谷氨酸于约50mL水中,用10mL/LNaOH溶液调节pH至10.0,再加水至60mL。
2.3 谷氨酸丙酮酸转氨酶(GPT) 分析纯。
2.4 L-谷氨酸 特级。
2.5 β-辅酶I二钠(酵母制) 生物化学纯。
2.6 聚酰胺 市售品。
2.7 聚乙烯吡咯烷酮 市售品。
2.8 谷氨酸丙酮酸转氨酶(GPT)液 将2mLGPT混悬液(10mg/mL)离心分离(4000r/min),离心10min),吸1.0mL上清液,弃去,此混悬液保存于4℃,可稳定1年。
2.9 D-乳酸脱氢酶(D-LDH)液 市售品(D-LDH,活力1500U/mL,保存于4℃,可稳定1年。
2.10 L-乳酸脱氢酶液 市售品(L-LDH,活力2250U/mL)。
2.11 NAD液 β-烟酰胺腺嘌呤二核苷酸(酵母制)900mg,加30mL水溶解,保存于4℃,3周内使用。
3.仪器
紫外分光光度计。
4.操作步骤
4.1 样品溶液的制备。
4.1.1 液体食品:一般含乳酸2~35mg的样品,准确称取1g以内。澄明无色或淡色样品[1],加水至100mL,即为样品溶液。混浊样品[2],加50~60mL水,过滤,用20~30mL水分数次洗容器及残渣,合并滤液和洗液,加水至100mL,即为样品溶液。深色样品,约加入样品量的1/10的聚酰胺粉末或聚乙烯吡咯烷酮,必要时加20~30mL水,剧烈搅拌1min,过滤,用40~50mL水分数次洗容器及残渣,合并滤液和洗液,加水至100mL,即为样品溶液。
4.1.2 固体食品:一般含乳酸2~35mg,准确称取1g以下样品。不含或几乎不含脂肪、蛋白质的样品,置于捣碎器中,加50~60mL水,均质5min,过滤,用20~30mL水分数次洗容器及残渣,合并滤液和洗液,加水至100mL,即为样品溶液。含脂肪、蛋白质样品(如干酪等)移入预先加温的捣碎器中,加40~50mL60℃的水,匀浆5min后,于40~60℃保温约10min,再于冰箱中放置15min,过滤,用50~70mL水分数次洗容器及残渣,合并滤液和洗液,加水至100mL,即为样品溶液。
4.2 标准液的制备 准确称取0.1067g于105℃干燥4h的乳酸锂[3],加水溶解至1000mL,作为标准液(此液1mL含0.1mgL-及D-乳酸混合物)。准确吸取标准液2mL、5mL、10mL、20mL、35mL,各加水至100mL,即为标准曲线用标准液(此液分别含乳酸2μg/mL、5μg/mL、10μg/mL、20μg/mL、35μg/mL乳酸)。
5.测定方法
5.1 测定条件 用紫外分光光度计,于波长340nm处测定吸光度。
5.2 测定 用2支试管,标明A和B,各加入1mL甘氨酰替甘氨酸缓冲液,0.2mL游离辅酶Ⅰ(NAD)液,0.02mL谷氨酸丙酮酸转氨酶液及1.4mL水,A管加0.1mL样品液,B管加0.1mL水,混合,放置5min,A管为样品测定液,B管为空白测定液,于波长340nm处,用1cm杯,以水调零点,分别测定A、B管的吸光度EA和EB,再于A、B管中准确各加入0.02mLL-乳酸脱氢酶液,混匀,10min后按同样条件测定吸光度E′A和E′B。
求出EA与E′A之差△EA,EB与E′B之差△EB,再计算出△EA与△EB之差△ET。
5.3 标准曲线 准确吸取标准曲线用标准液各1mL,按5.2代替样品溶液放入S1、S2……S5比色杯中,按5.2同样步骤操作,分别算出△Es1、△Es2……△Es5,绘制标准曲线。
5.4 分析结果的表述 根据样液的△ET,查标准曲线得样品溶液含乳酸浓度(μg/mL),按式(1-7)计算出样品中乳酸质量分数(%)。
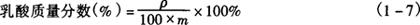
式中 ρ——样液中乳酸浓度,μg/mL
m——取样量,g
乳酸钙含量(%)=乳酸含量(%)×1.711
乳酸铁含量(%)=乳酸含量(%)×1.599
注:[1]指果汁类、啤酒等,果酒不一定要稀释。果酒中的游离乳酸虽可用本法测定,但含有多元酚或花色苷的乳酸酯等结合性乳酸,测定乳酸应增加下述加水分解前处理:
加水分解操作:果酒20mL,加2mol/L,NaOH2mL,回流15min,冷却后,用2mol/L( H2SO4)中和。
H2SO4)中和。
[2]盐腌甘兰的汁液、酸乳酪、牛乳等。
[3]一定纯度的游离乳酸不易获得,不适于作标准物。利用乳酸盐中乳酸锂的稳定性,作为标准物,D-、
DL-的大概组成是1∶1。
(三)高压液相色谱法
同本章第二节“三、食品中柠檬酸及其盐类的测定方法(三)”。