氯化钙
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第51页(5001字)
一、物理性质
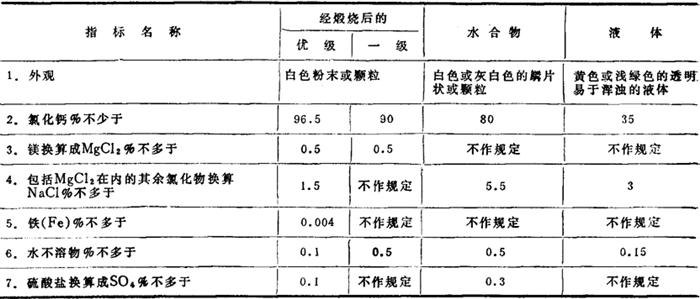
氯化钙的化学成分,按重量计算,由63.94%的氯和36.06%的钙组成。由图1-1-8可以看出,除无水物外,还有6水物、4水物、2水物和1水物。图中-50.66℃是冰和CaCl2·6H2O低共熔点,全部固相化;-50.66℃~29.9℃、29.9℃~45.3℃、45.3℃~176℃、176℃~187℃、187℃~782℃,分别是CaCl2·6H2O,CaCl2·4H2O,CaCl2·2H2O,CaCl2·H2O和CaCl2无水盐结晶区。在常温下6水物或4水物是稳定的。
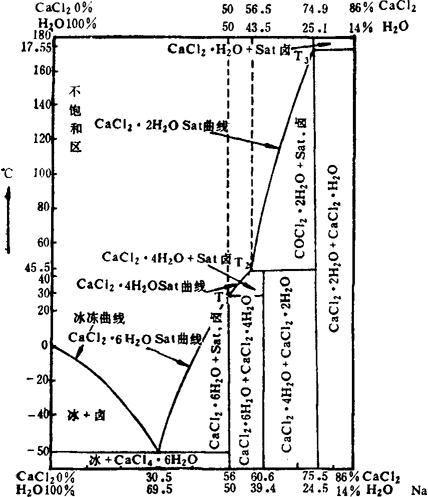
图1-1-8 CaCl2-H2O体系相图
E-低共熔点 T1,T2,T3-水合物转化点
我国氯化钙资源来自制碱废液,浓度约15°Bé,其成分为:CaCl2约10%,NaCl2约4%,H2O约86%。氯化钠和氯化钙之间的理化关系,见图1-1-9。图中A点是体系组成点,位于不饱和区。因此需先在盐场内利用自然蒸发浓缩,到B点时,溶液浓度约为29°Bé,NaCl先饱和析出;进一步蒸发,到达C点,浓度约为35°Bé,NaCl已析出85%以上。再移到室内加热蒸发,液相点接近NaCl与CaCl2水合物共饱点D点,NaCl大部分析出,所剩很少;继续蒸发,液相点到达终止点E时,仅剩CaCl2成分,可采取控制水量、保温分离、冷却结晶方法,析出市场所需要的氯化钙水合物。
图1-1-9 Na+、Ca/C1-H2O 25~125℃
氯化钙从空气中吸收水分的速度,决定于空气中水蒸汽分压超过氯化钙蒸汽的大小。例如空气中相对湿度为40%、95%情况下,1g二水氯化钙分别吸水1g和14g,1g无水氯化钙分别吸水1g和17g。无水物和四种水合物的物理性质如下:
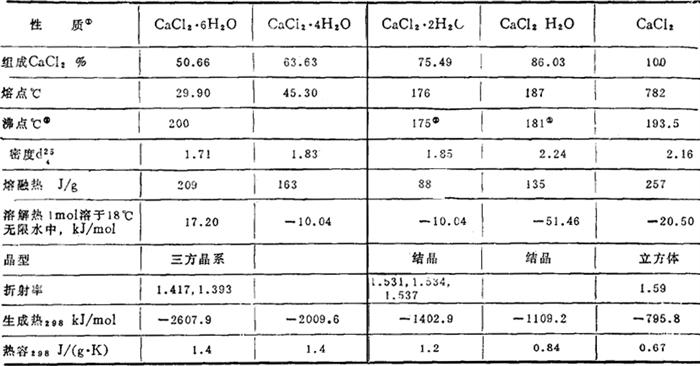
注:①来源于道化学公司,②解离大气压为101.3Pa
再将氯化钙无水物、2水物其他物理性质,择述如下。
(一)无水氯化钙
为白色或灰白色固体(粉状、块状或粒状),味微苦无嗅。易溶于水,同时放出大量的热。在常温下由水溶液中结晶析出的常为6水物。把这种6水盐渐渐加热到30℃,则溶于结晶水中;继续加热、渐渐失水,到200℃时,变为二水物;再加热到260℃,则变为白色多孔的无水氯化钙。这时因水与无水氯化钙作用,亦有CaO生成。氯化钙水溶液凝固点低,在冷藏工业中有很大用途。氯化钙潮解性强,类似氯化镁。氯化钙也溶于醇、丙酮、醋酸、甲酸、肼、吡啶、乙酰胺。
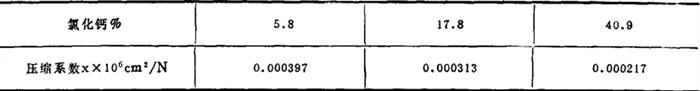
压缩系数:
体膨胀系数:固体 20~15℃ 0.67×10-4;
40.9%水溶液 20℃ 0.458×10-3;
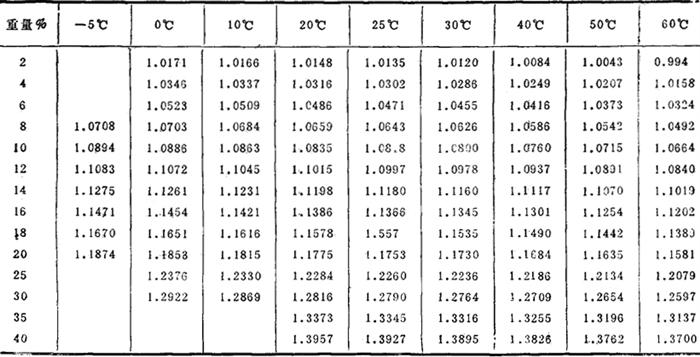
水溶液相对密度:
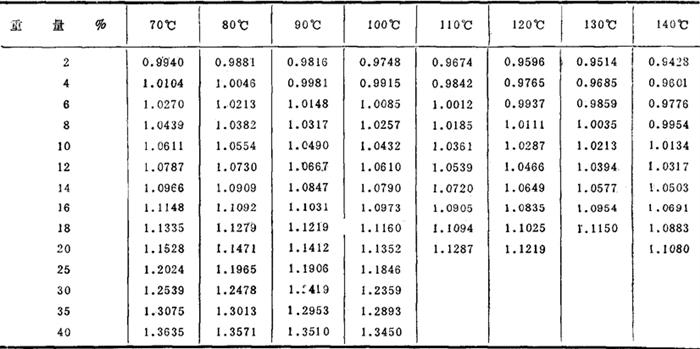
固体相对密度:
生成自由能298 -748.1kJ/(mol·K);熵298 104.6J/(mol·K);
磁化率 -54.7×10-6c.g.s.制电磁单位;
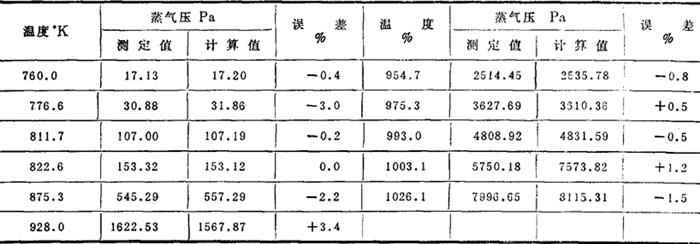
蒸气压:
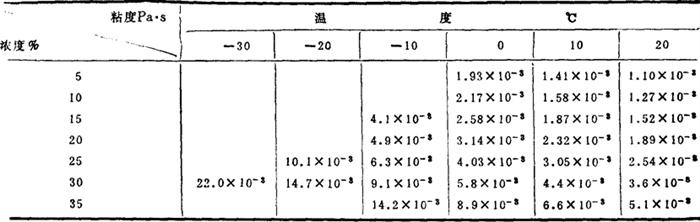
水溶液粘度:
熔融物粘度η 800℃ 0.0425P
850℃ 0.0365P
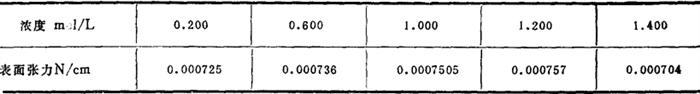
水溶液表面张力:25℃与空气接触时
熔融盐表面张力 熔点下与空气接触时 0.00152N/cm;
摩尔体积 50.3cm3/mol;
晶格常数 a=0.621,b=0.64,c=0.413nm;
氯化钙在盐酸中的溶解度: 0℃时

在有机溶剂中的溶解度:
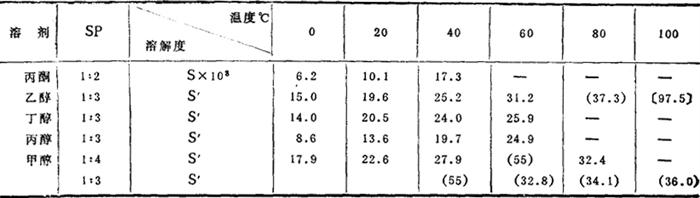
注:SP 溶液平衡时溶质与溶剂的摩尔比
S 100g溶剂溶解溶质的最大克数
S′ 100g饱和溶液中含溶质的重量(g)
( ) 表示在固相转移点下的溶解度值
〔 〕 表示在熔点下的溶解度值
熔点 772℃;
沸点 1600℃以上;
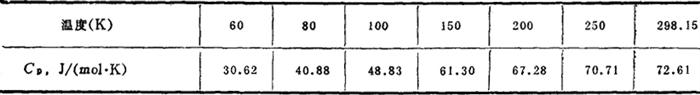
比热:
熔融物比热:
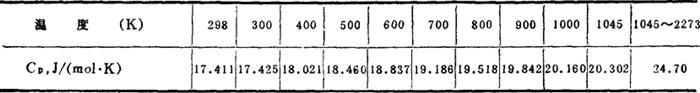
溶解热 25℃ -82.84kJ/mol;
熔融热 28367±335J/mol;
生成热(元素) 795kJ/mol;
升华热 0.018托尔,661.4℃ 226kJ/mol;
水合热 90.79J/mol;
折射率 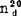 1.52;
1.52;
介电常数 5.85;
熔融盐电导率:

(二)2水氯化钙
白色颗粒状结晶,味苦涩,潮解强,易溶于水,能溶于醇,但不易溶于醚。水溶液呈中性或微碱性反应,具有腐蚀性。其他物理数据如下:
蒸气压
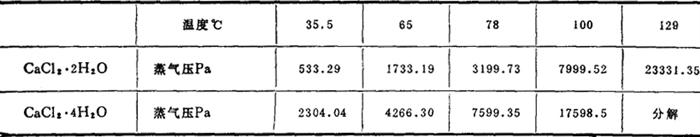
溶解热 18℃lmol CaCl2·2H2O溶于400mol水,41.84kJ/mol;
水合热 1水物水合成2水物,8.37kJ/mol;
生成热 标准条件下元素,1403.73kJ/mol;
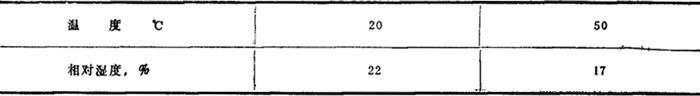
相对湿度:
相对密度: 1.385
蒸气压:
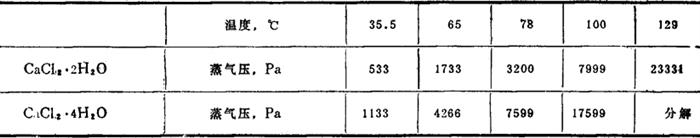
水中溶解度:

水溶液的冰点(CaCl2·2H2O含CaCl275%):
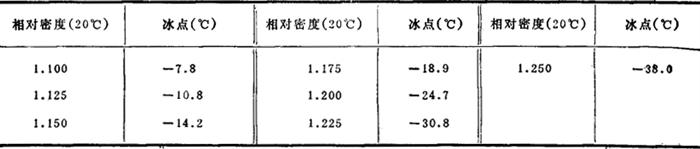
溶解热 18℃,1mol CaCl2·2H2O溶于 400mol水 -41.84kJ/mol;
生成热 标准条件下,元素 1404kJ/mol;
水合热 1水物水合成2水物 8.37kJ/mol;
相对湿度
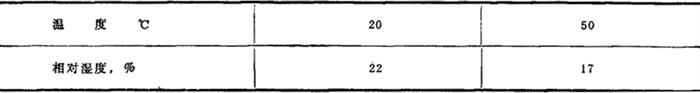
折射率 nα=1.531,nβ=1.534,nγ=1.537
二、化学性质
氯化钙与各种盐类化学反应,前已提及很多,如除硫、除硝等。关键问题是把这些反应如何结合起来,在盐碱工业精制卤水方面取得更大的经济效果。
氯化钙与乙醇和氨作用,分别生成CaCl2·4C2H5(OH)和CaCl2·8NH3。还有一些不常见的化学反应,如:氯化钙加入溴水中,即生成氯二溴化钙:CaCl2+2Br2→Ca(C1Br2)2;氯化钙加热到赤热时,与过量水蒸汽作用,即产生氯化氢和氢氧化钙;
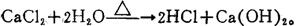
氯化钙与硫酸钡和煤在770~1100℃高温下进行反应,则生成氯化钡:BaSO4+4C+CaCl2→BaCl2+CaS+4CO
三、用途
国外冬季气温低的国家,氯化钙的最大用途是公路溶冰、溶雪,控制尘埃、稳定土壤;其次是用在生产混凝土产品以及石油井钻建维修运转等方面;氯化钙冰点低,加入水泥中可防止结冻,加速硬化,无水氯化钙可用作干燥剂。此外,加入下列物质中,其作用为:
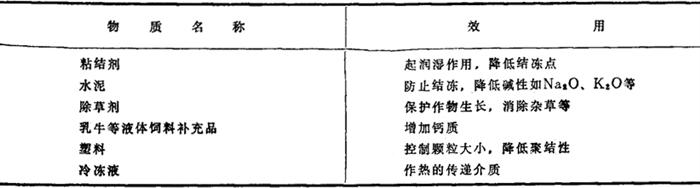
食品级氯化钙,可用于加工乳酪和其他乳制品以及药物的生产。在橡胶制造上,可作凝析剂,混合淀粉糊作上胶剂;还可用于有色金属冶炼,电解制金属钙,处理锅炉水,作灭火剂,防止木材、煤炭、纺织品等火灾事故。
美国年用氯化钙约近百万吨。各方面所占比例:冰雪除去30%,灰尘控制、道路稳固25%,工业用15%,石油天然气钻井液10%,混凝土5%,铺路用碴4%,其他11%。
四、质量标准
我国的质量标准见表1-1-34,美国和前苏联的质量标准见表1-1-35~1-1-37。
表1-1-34 我国氯化钙企业标准
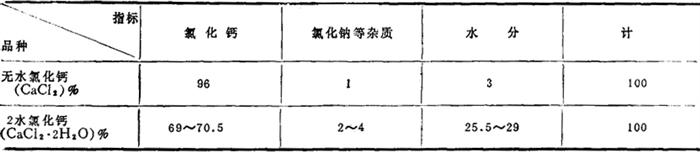
表1-1-35 美国军用国家标准Mil-C-51511A-85,工业规格
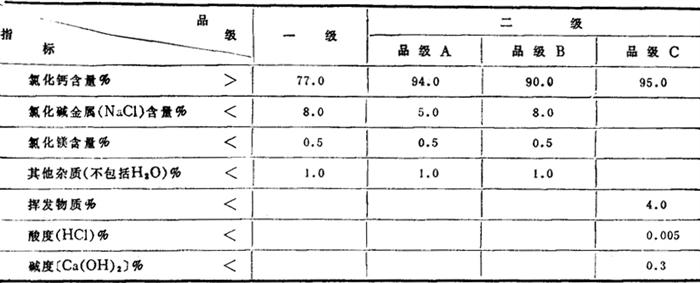
表1-1-36 美国联邦电信委员会(F.C.C.)食品CaCl2·2H2O标准Ⅲ-81
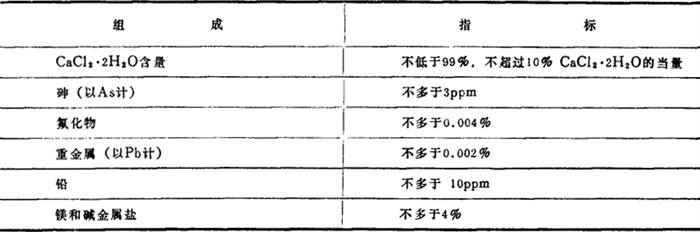
表1-1-37 前苏联氯化钙国家标准ГОCТ450-77