原理
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第1633页(1919字)
盐田卤水中含有丰富的NaCl、MgCl2、MgSO4、KCl和MgBr2等强电介质盐类。这些盐在卤水中都被电离成相应的阴阳离子(Na+、Mg2+、K+、C1-和SO42-)。在NaCl饱和前,KCl和MgBr2含量都很少,故此时卤水可看成是Na+、Mg2+//Cl-,SO42--H2O四元交互体系。NaCl和MgSO4在卤水中可发生下面的复分解反应:
2NaCl+MgSO4=Na2SO4+MgCl2
控制一定的温度、浓度、可使复分解反应向有利于生成Na2SO4的方向进行,并使其以Na2SO4·10H2O的形式自卤水中结晶析出。这一过程可由Na+、Mg2+//Cl-,SO42--H2O四元交互体系水盐相图进行分析。有关相图数据见表6-4-1。
表6-4-1Na+、Mg2+//Cl-,SO42--H2O体系相平衡数据
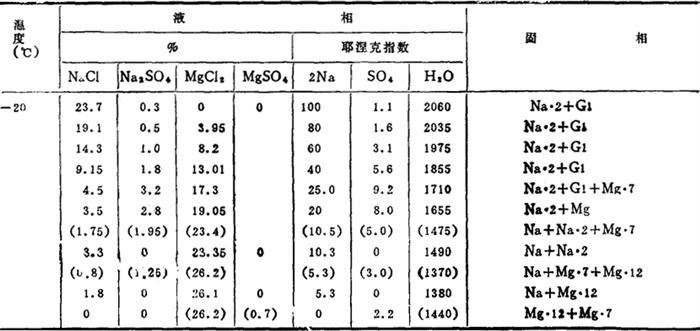
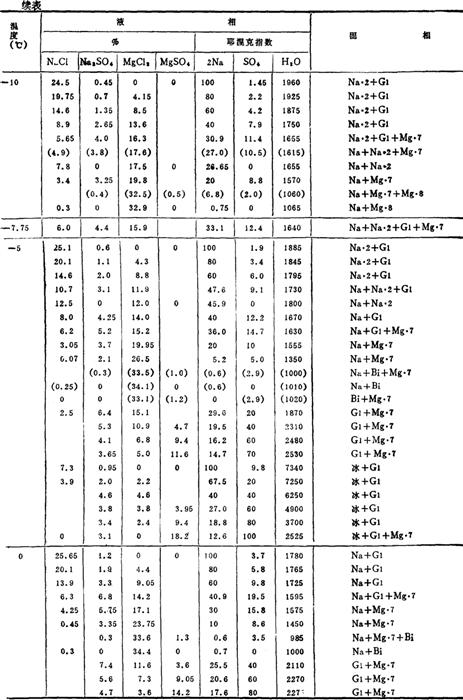

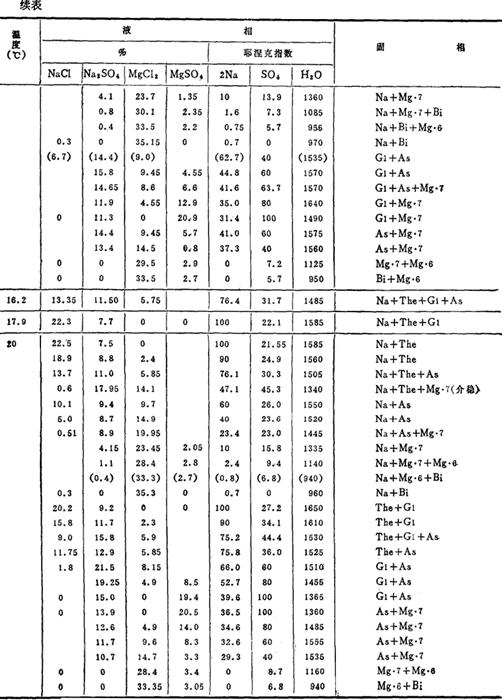

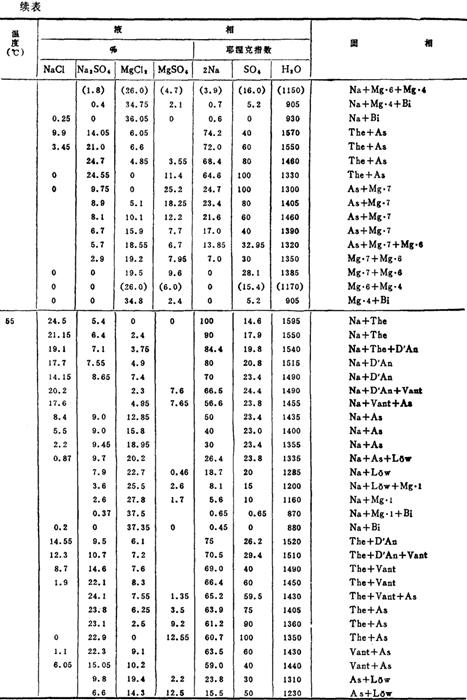


注:Na:NaCl
Na·2:NaCI·2H2O Mg·8:MgCl2·8H2O
The:Na2SO4 Mg·12:MgCl2·12H2O
Gl:Na2SO4·10H2O Bi:MgCl2·6H2O
Mg·1:MgSO4·H2O As:Na2SO4·MgSO4·4H2O
Mg·4:MgSO4·4H2O D′An:9Na2SO4·MgSO4·3NaCl
Mg·5:MgSO4·5H2O Vant:3Na2SO4·MgSO4
Mg·6:MgSO4·6H2O LÖw:Na2SO4·MgSO4· H2O
H2O
Mg·7:MgSO4·7H2O
根据表6-4-1的部分数据绘制图6-4-1A和图6-4-1B。

图6-4-1A Na+,Mg2+//Cl-,SO42--H2O体系平衡图
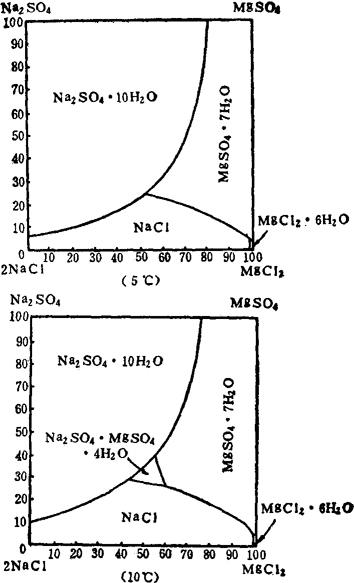
图6-4-1B Na-,Mg2+∥Cl-,SO42--H2O体系平衡图
例如,某卤水组成为:
°Bé NaCl MgCl2 MgSO4
24.3 218.81 49.14 23.91 (g/L)
换算成耶涅克指数为:
2Na:72.3
SO4:7.7
H2O:1956.5
将此体系点标在-10℃的Na+、Mg2+//C1-,SO42--H2O的平衡图上,见图6-4-2,在干盐图上体系点为M,在水图上体系点为m4。体系含水量在n点以上时为Na2SO4·10H2O和冰共同析出。体系含水在K0K1区间时为Na2SO4·10H2O单独析出阶段,越近K1点,Na2SO4·10H2O析出量越大。体系含水在K1K2之间时为Na2SO4·10H2O和NaCl·2H2O共析阶段。m4恰在K0K1之间,而且靠近K1点,说明该体系冷却到-10℃时只有Na2SO4·10H2O析出,而且析出量较大。