植物细胞固定化技术
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第302页(10511字)
近年来研究培养的植物细胞的固定性以生产生化产物(Brodelius,1983)。以阐明是否有可能减或免除植物细胞培养体,代之以新开发的技术学。
最近20年广泛研究了固定化酶和微生物细胞之类生物催化剂,利用它的优点是:高价生物催化剂的再利用;连续作业;控制过程简单化;产物与催化剂自动分开,生化催化剂稳固性。当用固定化的整个细胞,可望实现:在自然环境中更固定的酶(诸酶);利用整体生物合成途径可能性,辅酶再生;用生活细胞时可就地活化。当今在固定化生物催化剂基础已有约10种不同操作过程,为商品生产广泛采用,包括生产高果糖糖浆,6-氨基青霉酸和各种氨基酸。
(一)技术
这项技术是将生物催化剂(植物细胞或原生质体)经吸着、共价连锁或裹束于固定在基质上或内。最适用方法是把大的敏感的植物细胞和原生质体囊束于多聚体网状物里。这些细胞物理性束缚于胶体结构中,基质和产物可向固定化细胞扩散和排出。
固定化技术应用于植物产品形成与非生长相伴的情况。因此,可把悬浮体内生长的细胞经增殖后固定化并用于各种目的。其制作程序,图14-4所示。在固定化系统中,植物细胞能长期反复利用,当产生细胞内产物时,可用连续包束处理,产物可从生物反应器自动排出。非固定化设施,则相反,植物细胞不能再利用。至于贮存产物,可间歇释放法处置之。

图14-4 以植物细胞为材料的加工方案系统图空白=游离悬浮细胞;阴影=固定化细胞和细胞外产物;黑区=固定化细胞和细胞内产物。
关于植物细胞固定化兹仅就囊束法述之。囊束植物细胞的多聚体列于表14-2中。
表14-2 各种基质囊束中有生活力的植物细胞

1.褐藻酸 是海草灰分离产物,最先采用的多聚体。其水溶液经多聚体链的离子交叉链而形成凝胶。是当今最温和的囊束法之一,广泛采用于固定化各类细胞。其优点是:加Ca2+螯合剂(如EDTA,柠檬酸钠,或磷酸缓冲剂)使固化作用倒转的可能性。因此处于固定状态一定时间后,可能使细胞再悬浮。但为了保持固定化制品完整无损,培养基中必须加钙离子(2-5mM)。褐藻酸可大规模应用于工业生产,如日本乙醇生产工厂,装设有每反应器2000L小珠的二个反应器(Nagashima等1983)。
2.琼脂和琼脂糖 二者在特定多聚体浓度下,凝胶温度低于溶胶温度,产生滞后作用(hystersis)。把细胞与温暖琼脂水溶液相混合,冷却时形成含有细胞的胶囊。最适用20-25℃凝胶温度的琼脂粉。固定化细胞制备法:最简单的把植物细胞悬浮体放入琼脂粉,冷却形成凝胶块。用适宜网孔的筛,压凝胶片过筛,分成小粒。但粒形大小不一。可改用预制板型制粒,但制品量减少。Nilsson等(1983)设计制备大小一致的琼脂粉球形小珠法,在凝胶形成前,把细胞-多聚体悬浮物分散在惰性疏水相内。在分散过程中,调整搅动速度以调节小珠大小。
3.Kappa-carragenan 这是海草提取物。除钠盐外不溶于冷水。放入冷水后,将吸涨形成粗分散物,需加热溶解多聚体。凝胶温度视多聚体浓度、正离子数和类型(例如K+, 和Ca2+)而有异。制小球法如琼脂粉。在制取前,加K+(0.3M)可使凝胶稳定。
和Ca2+)而有异。制小球法如琼脂粉。在制取前,加K+(0.3M)可使凝胶稳定。
4.植物原生质体稳定化 植物原生质体是极度敏感细胞。应采用最温和囊束法,易于掌握制取。Bornman等(1982)把原生质体吸着在微载体上。
囊束整体细胞方法与上述方法相同(表14-3),但需将多聚体溶于低渗培养基。
表14-5 各种多聚体固定化的原生质体

(二)固定化植物细胞成活力测验
原则上,可用游离悬浮细胞成活力测验法用于固定化植物细胞成活力测验。
成活力染色 各种染色技术可用于研究培养的植物细胞成活力。荧光素二醋酸(FDA)对凝胶球无干扰,在分析前把固定化制品切成薄片较好,苯番红也能适用,死细胞染成红色。用荧光增白剂研究新细胞壁合成,用荧光显微镜观察。利于用小球薄片(含固定的细胞)进行。
1.质壁分离 质壁分离为测定质膜完整性的方法。加质壁分离剂(例如甘油或山梨醇)后,在显微镜下观察,也可加苯番红(超渗培养液)以利观察。
2.呼吸作用 把小球悬浮在培养液中,测定培养时间与耗氧量关系,由于固定化细胞制品是异质催化剂,各种营养分扩散受到局限,因此其呼吸率显然低于游离悬浮细胞。如将固定化材料切成小颗粒后,加以测定可克服上述困难。或把褐藻酸或凝胶溶化,测定呼吸数量变化。Catharanthus roseus细胞的相对呼吸率,随培养时间增长而相应增高。培养当天Alginate囊束的固定化细胞相对呼吸率约30%以下,4天30%左右,6天50%以下,而除去Alginate后相应为30%以下,60%,100%(图14-5)。

图14-5 Catharanthus roseus细胞的保温时间与相对呼吸率之间的函数关系
3.细胞生长 以相对干重表示,大豆悬浮细胞培养一天干重下降,2天后直接增重,Alginate囊束的7天达100%;游离悬浮细胞5天增加到90%,然后下降;琼脂粉囊束的上升缓慢,5天30%(图14-6)。

图14-6 大豆细胞的相对干重
增加率随保温时间的函数圆圈=游离悬浮细胞;方块=琼脂囊束细胞;三角=褐藻酸囊束细胞。
4.细胞分裂 琼脂粉囊束的细胞的有丝分裂指数,与游离悬浮细胞的相似,可以固定化对细胞分裂并无影响(图14-7)。

图14-7 有丝分裂指数(Ml)
随保温时间的函数白圈=游离悬浮细胞;黑圈=琼脂囊束的细胞。
5.32P核磁共振(NMR) 活体32P核磁共振是研究生命系统生物能学和代谢的很有用的方法。囊束细胞于基质内,有可能阻碍氧的适宜供给,转而影响细胞生存力或代谢。比较研究了好气和嫌气条件下Catharanthus reseus细胞的31PNMR谱(图14-8,14-9,14-10),指出在嫌气条件下酸化了0.5pH单位和糖磷酸盐浓度下降。游离悬浮细胞与固定化细胞的类同比较,未见差异。固定化细胞适度地氧化,固定化对细胞代谢无严重影响。

图14-8 Catharanthus roseus细胞的31P核磁共振图谱(103.2MHz)

图14-9 Catharanthus roseus 细胞在好气和嫌气条件下P核磁共振的比较谱

图14-10 各种制备的Catharanthts roseus细胞的31P核磁共振谱(103.2MHz)
A.Algjnate囊束细胞经72h保温B.琼脂囊束细胞72h保温C.游离悬浮细胞经48h保温。
上述关于测定固定化细胞生存率的影响,指出固定化本身对细胞并无任何影响。
(三)固定化细胞的生物合成能力
许多典型研究证实了固定化植物生存细胞的生物合成能力,见表14-4。由此可得出结论,固定化细胞能进行与相应的游离悬浮细胞相同生物合成反应。事实上高生产力的可达100倍(表14-5)。由于“固定化细胞在代谢上与完整植株内“固定化”细胞的关系比,液体悬浮细胞更为接近,后者是它们发生之源。”
表14-4 采用固定化的植物细胞生产生化化合物


表14-5 固定化植物细胞产量增高之例

同一个细胞的制品曾用于生产达220天。每生物学产量单位的总生产额有相当大增高。为了长期利用,需要控制固定化细胞的过度生长。为此可采用用有限度的营养培养基(例如磷酸和硫酸盐)或改变培养基的荷尔蒙浓度,以限制生长,否则会引起渗漏或破坏小球。培养基成分如能调整到使固定化细胞长期保持在稳长状态,为发展这种技术很重要。这将有可能稳定这些固定化细胞,改进单位产量。
多数生物合成试验是用单组反应器(振荡三角瓶进行的。但已发展到包装床反应器或气泡柱反应器的连续作业。这种连续反应器类型用于细胞外产物。
(四)产品释放
固定化生物催化剂的优势是一种程序的连续作业。为了同样用于细胞内产物,要研究引导从固定化细胞释放产物。
1.自发释放 某些典型研究,观察到正常储存在细胞里的产物,向培养基渗漏。其机制虽属不知,但很有可能不是由于细胞的溶解。
2.诱导释放 为了释放细胞内产物,必需找出能保持细胞生存状态的柔和方法。其中以造成间歇地可渗透性的固定化细胞使产物得以释放。次生产物常储存于液泡内,这就要求同时使质膜和液泡膜处于可渗透状态才行。
质膜的渗透性可测定细胞质酶活性以表示,这种酶需要不能透入完整膜的基质,如ATP和NADP。经渗透剂处理后,测定依赖核苷酸的酶活性,如己糖激酶-葡萄糖-6-磷酸脱氢酶。实验装置如图14-11。曾测验了一些渗透剂(表14-6)。最常用的是DMSO。DMSO用量因细胞种类而不同(表14-7)。
表14-6 Catharanthus roseus细胞内己糖激酶-葡萄糖-6-磷酸盐去氢酶经渗透剂处理后的相对活性

表14-7 各种固定化植物细胞内异柠檬酸去氢酶活性达到100%所需DMSO浓度

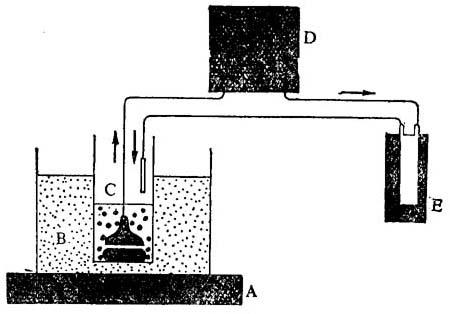
图14-11 测定渗透化固定的植物细胞内部酶活性的装置
A.磁性搅拌器B.恒温水浴C.反应容器盛有酶测定混合液,固定化细胞,磁棒和过滤器D.蠕动泵E.分光光度计内流通杯
C.roseus液泡膜渗透性,Lund berg等(1985)曾用31PNMR研究无机磷酸盐共振现象,有可能区分细胞内胞液和液泡。随着DMSO用量增高,经处理,30min的细胞,液泡磷酸盐峰大小降低(图14-12)。这是由于液泡膜的渗透作用,引起无机磷酸盐渗漏入周围培养液在洗时除去了。由此可知,DMSO处理使质膜和液泡膜都产生渗透作用。以C.roseus细胞为例,5%DMSO已足以使储存于液泡中的物质放出。经处理后,细胞仍然有生存力,经短时期停滞后(修补过程?),细胞生长速度回复到未处理细胞一样。采用这种方法,典型研究alginate和琼脂粉囊束的C.roseus细胞,从前导物色胺和secologanin产生阿吗灵(Ajmalicine)(图14-13)。由于试验期间小珠内细胞团量不断增加,每个细胞周期的产量有所增高。与用有机溶剂相比,经渗透透性作用方式,至少有90%细胞内储存产物得以释放。

图14-12 各种浓度DMSO处理的C.roseus的31P核磁共振谱
A.未处理细胞B.1%DMSOC.2%DMSOD.5%DMSOE.1o%DMSO

图14-13 Catharanthus roseus固定化
细胞的Ajmalicine产生情况
细胞间断渗透性化(箭头)以释放产物;条棒=琼脂囊束细胞;黑棒=alginate囊束细胞。每次实验中最初产物提取量为i00%。
(五)操作程序
本节将描述用各种凝胶囊束细胞和原生质体的标准方法。
1.囊束整体细胞 凝胶里的细胞浓度可有相当大差异。作者曾各种多聚体囊束高达50%(w/w)植物细胞(鲜重)。下列程序能用于各种植物细胞培养物,最适浓度达20%(w/w)。全部程序在无菌条件下进行。
(1)褐藻酸盐 褐藻酸盐浓度视其制品而异,其粘度(室温下)不应过高。可用褐藻酸实业公司产品〔ManucblDH:2-5%(w/w)最后浓度〕和ProtanalA/S〔ProtanalLF,3-5%(w/w)和ProtanalHF,2-3%(w/w)最后浓度〕。
①经加热和搅拌,把褐藻酸盐(例如2gProtanal HF溶于适宜生长培养液中(98ml)。
②高压蒸气121℃20min消毒褐藻酸盐溶液。
③过滤,收集已被囊束的细胞。
④室温下混合细胞(2g鲜重)与褐藻酸盐溶液(8g)。
⑤连续搅拌下,把褐藻酸盐-细胞悬浮体装满塑料吸移管,然后让其滴入装有培养液(50ml)的瓶,用50mM CaCl2强化。
⑥让其形成小球(30min),过滤收集。
⑦用培养液加5mM CaCl2洗小球。
⑧制成囊束细胞备用。
成熟过程中,小球会相当收缩(视所用褐藻酸盐类型和浓度而异),使得小球内细胞浓度增高。如果进行数量化试验,可用下列程序。
①把褐藻酸盐-细胞悬浮体加入凝胶形成培养液前,测定并加培养液的总重。
②加入褐藻酸盐-细胞悬浮体后,再称之。其增重量等于加入的褐藻酸盐-细胞悬浮体。几乎不可能把制备的多聚体-细胞悬浮体全部加入。
③小球洗过后(上述第7步),称重。
④最后制品内细胞浓度可用下式计算:
C=Co
C=小球内细胞浓度(w/w);C0=褐藻酸盐-细胞悬浮体(w/w)浓度。上法取得的小球相对大(直径3-5mm),可用皮下注射针(小于1mm)在注射器上减小之。囊束前应除去大细胞团块。用图14-14设施,可将褐藻酸盐小球减小到直径0.5-1mm。用无菌空气喷管克服褐藻酸盐-细胞悬浮体的粘性,改变空气压,可得不同大小的小球。

图14-14 制备褐藻酸盐小球用的设计示意
A.褐藻酸盐-细胞悬浮体入口B.无菌气流入口C.浓缩褐藻酸盐-细胞悬浮体和空气出口
(2)琼脂糖
①加热和搅拌把琼脂粉(5g)溶于适宜培养液。
②高压蒸气琼脂121℃20min消毒粉溶液。
③琼脂粉溶液平衡,35℃下。
④过滤收集细胞。
⑤取2g细胞(鲜重)与琼脂粉溶液(8g)混合,35℃。
⑥将琼脂粉-细胞悬浮体倒入装有菜油40ml的100ml烧杯,搅拌,35℃。
⑦搅拌直至形成适当大小的小滴。
⑧把装有混合液的烧杯放入冰浴,10-15℃冷却,直至琼脂粉固化。
⑨把油-小球悬浮体放入50ml Falcon离心管,装有培养液10ml,100×g离心2min。
⑩用吸引器除去油相和大部分液相,用容器收集油。
⑾将小球再悬浮在15ml培养液中,100×g离心2min。
⑿重复步骤10和11,直至制品无油存在。
⒀制成囊束细胞备用。
把小球制品过筛(适当网孔的金属筛)使之分小。
(3)角叉藻胶(Carrageenan)制法同琼脂糖。
①加热和搅拌 将角叉胶(5g;例如NJAL798)溶于0.09%NaCl(95ml)中。
②高压蒸气121℃消毒Carrageenan角叉胶溶液20min。
③35℃下平衡角叉胶溶液。
④过滤收集细胞。
⑤取2g(鲜重)细胞与角叉藻胶溶液(8g)混合,35℃。
⑥将角叉胶-细胞悬浮液倒入含菜油40ml的100ml烧杯,搅拌,35℃。
⑦搅拌直至形成适当大小的小滴。
⑧将装有这种混合液的烧杯放入冰浴,冷却到10-15℃,直至角叉藻胶固化。
⑨把油-小球悬浮体装进50ml Falcon离心管含培养液10ml,用0.3M KCl强化,离心100×g2min。
⑩用吸引器除去油相和大部分水相。
⑾将小球再悬浮在含0.3M KCl的15ml培养液中,100×g离心2min。
⑿重复步骤10和11,直至小球不再有油。
⒀制成囊束细胞备用。
大多数植物细胞培养基含有足量钾离子,以使角叉胶小球在长时间内利用能保持完整。用金属筛过筛使小球分小也是有益的。
2.囊束原生质体
(1)取角叉藻胶5g溶于0.09% NaCl(95ml)含有与制取原生质体培养基相同的渗透剂(例如0.5M山梨醇)。
(2)高压蒸气121℃20min消毒角叉藻胶溶液。
(3)35℃下平衡角叉藻胶溶液。
(4)调节原生质体浓度为每毫升2.5×107原生质体,35℃下平衡这种悬浮液。
(5)35℃下轻轻混合原生质体(2ml)与角叉藻胶溶液(8g)。
(6)把角叉胶-原生质体悬浮液倒入含菜油40ml的100ml烧杯,搅拌,35℃。
(7)搅拌,直至形成适当大小的小滴。
(8)将装有混合液烧杯放入冰浴,冷却到10-15℃,直至角叉藻胶固化。
(9)将油-小球悬浮液倒入含高渗培养液10ml的二个50ml Falcon离心管,加0.3M KCl强化,离心100×g2min。
(10)用吸引器除油相和大部分水相。
(11)将小球再悬浮在15ml高渗培养液中,含0.3M KCl,离心100×g2min.
(12)重复步骤10和11,直至小球不再有油。
(13)制成囊束原生质体备用。
用Alginatee时,必须把钙离心浓度降低到1-2mM。凝胶内原生质体浓度有不同。通常每克小球囊束106-107原生质体。为了用于再生试验,以低浓度更为相宜。
囊束植物细胞是相对新技术。本节讨论了采用这类制品生产生化产品与游离悬浮细胞相比,其优点:
(1)增高生产力。
(2)延长生产(稳定阶段)。
(3)基质保护敏感细胞。
(4)在某些情况下,自发释放产物。
(5)用渗透作用诱导产品释放的可能性。
囊束培养的植物细胞和原生质体,将最有可能广泛应用于植物细胞技术学。细胞尤其原生质体经囊束后,较易掌握。这类制品,将可用于研究生化和细胞的过程,以及生物转变和生产代谢产物。
【参考文献】:
〔1〕Constabel,F.,Gamborg,O.L.,Kurz,W.G.W.,and steck,W.1974 Prodtiction of secondary metaboliteS in plant cell cultures.Planta Med.25∶158-165.
〔2〕Dougall,D.K.1980 Production of biologicals by Plant Cell Culture.In:Advances in Experimental Medicine and Biology(J.C.Petricciana etal.eds.)pp.136-151.Plenum,New York and London.
〔3〕Fujita,Y.,Hara,Y.,Ogino,T.,and suga.C.1981 Production of Shikonin derivatives by Cell Suspension Cultures of Lithospermun erythrorhizon.Plant Cell Rep.1∶59-63.
〔4〕Watanable,K.and Yamada,Y.1982 The selection of Cultured plant cell lines producing high levels of biotin.Phytochemistry 21∶513-516.