花生
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第423页(12981字)
植物细胞开创了诱导遗传变异性和选择需要突变型的几种新可能性。有些离体培养方法应用于花生,包括:(a)无病植株的克隆和产生,(b)消除有性不亲和性,(c)体细胞杂交和遗传工程,(d)产生单、三和多倍体,(e)选择抗盐、旱、除莠剂,病和虫突变体,和(f)种质深冻保存。由于花生是自花授粉作物人工培养产生单倍体,继而染色体加倍,能缩短谱系和回交方法取得纯合同质系所需时间。加之,单倍体能用于诱变试验。分生组织培养可用于取得无病毒植株,这是大量生产优质种子所必需。为了把需要性状从野生种转移给栽培作物,可用胚培养或原生质融合,完成远缘杂交。能用各种诱变剂处理细胞培养体,也能取得需要的突变体、变异体。
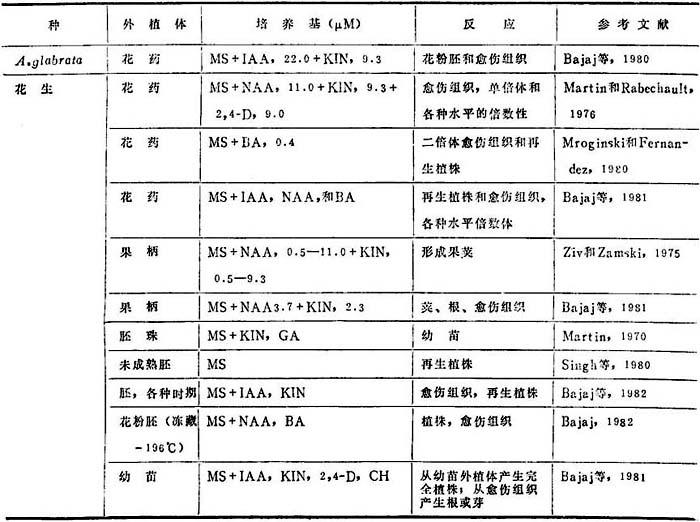
近十年来,花生属的原生质、细胞、组织和器官培养,证实着离体培养技术经组织培养再生植株,和对花生改良的潜势和期望(表19-2)。
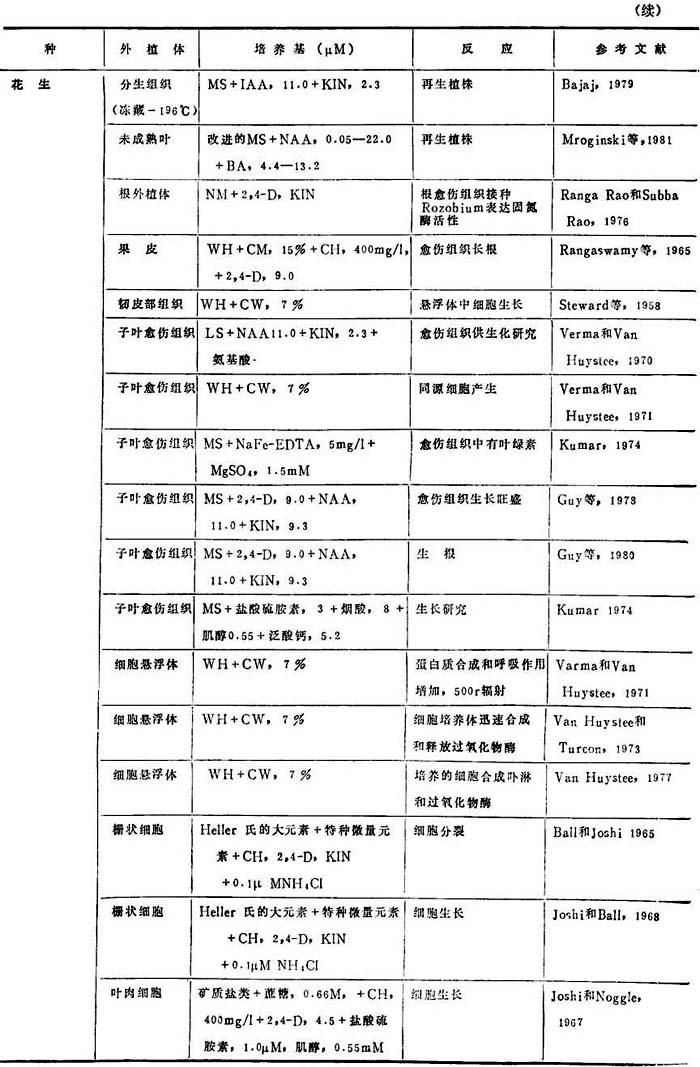
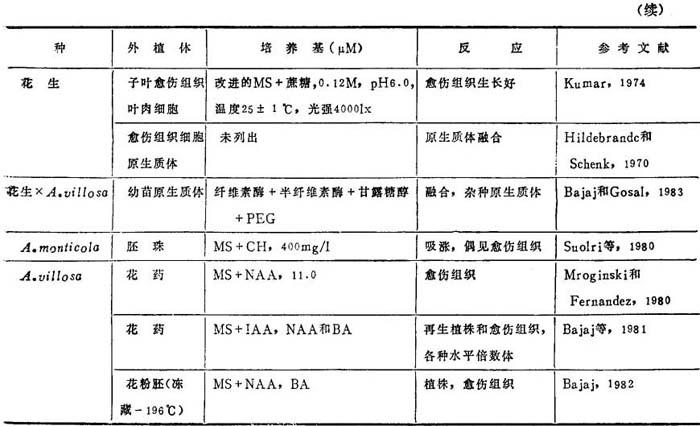
表19-2 花生离体培养研究
花生F1杂种、单倍体和其它罕见植株的切段和组织培养无性系繁殖,将有助于育种和作物改良规划。Bajaj等(1981)曾用人工培养生长的幼苗的各种切段培养在不同培养基上,其生长反应列如表19-3。上胚轴和中胚轴培养后1周内开始伸长。上胚轴原有分生组织展开,而中胚轴产生芽,最后形成植株。子叶、叶柄和根切段增殖形成愈伤组织块。
表19-3 花生离体培养下在各种培养基上生长的幼苗切段的生长反应
(Bajai等,l981)
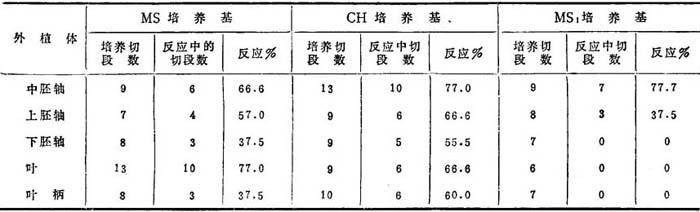
培养的各种切段,中胚轴和上胚轴在CH培养基上,生长反应最好,形成愈伤组织、根和芽。这是培养在MS3和MS1培养基上取得的结果。
(一)果柄离体培养
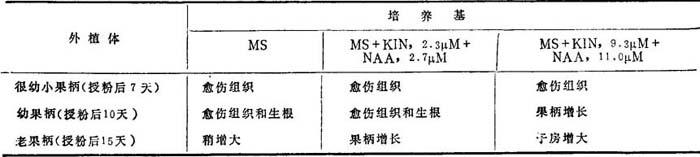
果柄离体培养的行为(表19-4)与其发育时期有关。授粉后7天(7DAP)很幼果柄,不伸长,但形成愈伤组织,子房也不增大。幼的(10 DAP)和老的(15 DAP)果柄继续增殖。在NAA(2.7μM)+KIN(2.3μM)培养基上,果柄保持绿色,增殖成愈伤组织。当NAA和KIN用量分别增加到11和9.3μM时,子房增大,形成根。单性结实,子房里无种子。果柄表现正向地性。这些在离体条件下的研究将有助于了解影响英形成的因子。
表19-4 离体培养花生果柄外植体的生长反应
(Bajaj等,1981)
1.建成愈伤组织培养物 表19-2指出若干学者从各种组织取得了活跃生长的愈伤组织和细胞培养体,并用于生理和形态研究。全部外植体,胚和胚珠,产生了快速生长、松脆愈伤组织。以中胚轴培养在MS+CH,400mg/1+2,4-D,4.5μM的生长最好。加KIN0.5-9.3μM长成紧密,生长慢愈伤组织,KIN用量增大,这种特征增强。保持在附加CH,200mg/l和2,4-D∶2.3μM培养基上的愈伤组织,取得了活跃生长悬浮体。
2.愈伤组织分化成株 早期研究观察到愈伤组织进行部分器官建成,只见根Bajaj等(1981)观察转移到MS+IAA+KIN培养基的愈伤组织,偶见根和芽。这些结果与花药愈伤组织相类同。
(二)花药培养和产生单倍体
曾研究把野生种(正常为二倍体)的合于需要性状转移给商品花生(四倍体),很困难或近于不可能。现在用三倍体,同源四倍体或双二倍体途径以期取得成功。但是,也存在着这样可能性,从花生(4n)花药或游离花粉培养取得双单倍体,然后用与其它野生种(染色体数相同)杂交。再者,突变育种曾产生若干有力结果。X照射后,产生了高产、种子品质好的品系NC4X,曾用以培育成许多商品品种。在育种方案中,培养F1植株花药,继而使染色体数加倍,能缩短同质性所需时间。也需要产生若干花生2n=20染色体的品系,用于远缘杂交。
产生单倍体途径:孤性生殖自发产生,或用远缘杂交,热冲击,辐射,利用败育花粉,延迟授粉,或喷各种化学剂等实验方法诱导产生。但因单倍体产生频率低,因而费工、费时、费事。因此,花药和花粉培养引起相当大兴趣。花药培养相对简单、快速和有效,许多作物取得了单倍体组织和植株(Bajaj,1983)。由此水稻、小麦和烟草提早推广了高产栽培品种。这种成就,鼓励了植物育种家采用离体培养方法于花生。
培养在MS+IAA,11μM+KIN,9.3μM或BA,8.8μM的第一次花粉有丝分裂的A.glabrata,花生和A.villosa花药,3周内约13和11%启动愈伤组织发育(表19-5)。愈伤组织白色到乳白色。
显微镜观察指出不同时期胚胎发生的花粉,花粉进行分段,经反复核和细胞分裂形成花粉胚。其它豆科植物(木豆)也观察到相同模式的胚胎发生。花粉胚大都增殖形成愈伤组织。但是,随时间推延,二类愈伤组织混合在一起,不能区别。
愈伤组织继代在MS+NAA,5.4μM+BA,8.8μM,开始分化,一周内形成芽。有时,在以后3周内,产生果柄类结构和多芽。如果让分化中的芽保持在同样培养基上(BA,8.8μM),它们开始变黄,终于死亡。但转移到基础培养基+NAA2.7-5.4μM后,有时启动生根。然后可将带根再生植株移栽钵中。由此,从开始花药培养到再生植株需时约8-12周。
A.villosa和花生培养物生长和形态建成反应有明显差别(表19-5)。A.villosa花药很少增殖,但常分化芽和再生植物,而花生花药旺盛增殖形成愈伤组织,由此生根,偶或形成芽。
表19-5 花生属花药离体培养下生长反应
(Bajaj等,1981)

a.MS+IAA,22.0μM+KIN,9.3μM
b.MS+NAA,11.0μM+BA,8.8μM
愈伤组织细胞和再生植株根尖的染色体数变动范围很大,有很多多倍体和非整倍体。花生染色体数从20-80个(x=10)(图19-7)。
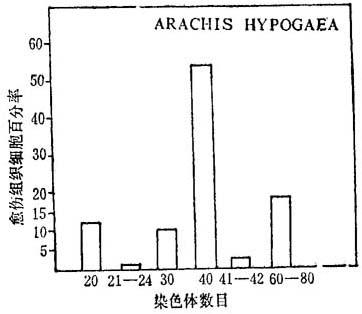
图19-7 A·hypogaea花药产生的愈伤组织的遗传变异性范围
根据886个分裂细胞取得的资料(Bajaj等,1981)
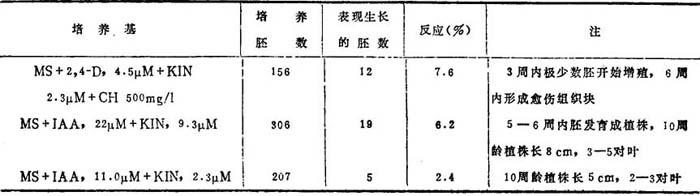
落花生育种规划中,增产,高油分和蛋白质,抗各种病原菌和早熟是主要目标。野生种具有这些特性。可是,在大多数情况下,这些杂交或是不亲和或杂交频率低。1952首次报道了Arachis属种间杂交(A.hypogaea×A.correntina)。最近Smartt(1979)评论了这种课题。由于异种杂种类型有限,需要开拓非常规方法。期望着采用杂种胚培养以及其它人工培养技术克服这些问题。Bajaj等(1982)报道了这方面的首创研究工作。栽培四倍体落花生(2n=40),野生二倍体(2n=20)种A.villosa的胚培养和它们的异种间杂种的观察结果综列于表19-6和图19-8。
表19-6 杂种胚(花生×A.villosa)培养在各种培养基上的生长反应a,b
a.授粉后30-35天。
b·Bajaj等,1982.
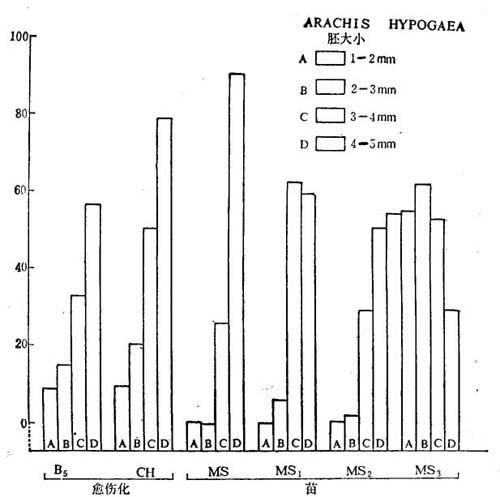
图19-8 花生各种发育时期的未成熟和成熟中胚培养在下列培养基上的生长反应
B5-Gamborg等,1958;CH——MS+水解酪蛋白,400mg/1÷2,4-D,4.5μM+KIN,0.5μM;
MS1——MS+IAA,11.0μM+KIN,2.3μM;MS3-MS——MS+IAA,22.0μM+KIN,9.3μM(Bajaj等1981)·
(三)花生和Arachis villosa的胚培养
不同发育时期胚培养反应不同(图19-8)。MS+2,4-D培养基上胚增殖,生长相当加强,愈伤组织发育旺盛,当附加CH时。花生胚在4周内产生松散愈伤组织,比A.villosa的生长为快。在附加IAA,22μM+KIN,9.3μM培养基上,从胚产生了完整植株。诚如花粉胚一样,二个种的合子胚观察到不同生长反应。
杂种胚对不同培养基反应汇综如表19-6。胚培养在MS+IAA,22μM+KIN,9.3μM(MS3培养基)产生再生植株,加2,4-D和CH,引起过度增殖。在MS3上,胚吸涨,2周内开始生长。上胚轴变绿,伸长形成芽,幼根生长慢。形成的主根粗、短,生长很慢。但将这种再生植株转移到基础培养基+NAA,5.4μM,根开始伸长。杂种植株是三倍体2n=30,即界于两亲染色体数之间。植株直立,叶象花生。叶深绿色,较花生的稍小。Krapovickas和Rigoni(1952)和Kumar等(1957)所得植株表型与花生相似。
花生×A.villosa杂种胚培养和再生杂种植株研究,证实着采用远缘杂交可将外来种质掺入栽培花生的可能性。有待于把这种工作扩大用于其它种。
(四)诱导突变和其它需要的变异性
任何作物改良成功,不仅有赖于已有遗传变异,也涉及栽培品种存在的遗传变异范围。随着自然种质资源逐渐短缺,正在努力于用非常规方法诱导变异以补充基础基因库。为此积极地开拓着人工培养技术。植物细胞和原生质体为分离诱导发生的和自发产生的变异提供着独特手段。
从老细胞培养体再生不同形态植株是普遍现象。经长期培养后,细胞进行着各种核和染色体变化,如核内有丝分裂、多体性,和突变。可用于需要特性的选择。还有运用各种生长调节剂和药物,能以诱导变异和取得有用变异体,如甘蔗,马铃薯和玉米业已取得成功。
大都突变是隐性,在存在非突变显性基因时,二倍体细胞里不能表达,单倍体培养在诱导和易于鉴别突变体方面,有特殊重要性。分离变异体细胞的一般方案是把培养体暴露在只有利于突变体细胞生长条件中。就此细胞群体受到各种不利因素的影响,如盐类、重金属、毒素、除莠剂、极端温度或氨基酸衍生物。许多学者采用单细胞培养体研究辐射和化学诱变剂的影响。单细胞、原生质体和游离花粉,能用处置微生物的技术,大量植板和筛选,比用完整植株有利。最近,用一些植物种细胞系取得突变体,如抗盐,病菌毒素,除莠剂,冷冻,病毒,各种药物和线虫。但未见有关落花生的报告。
扩大基因库基础的另一方法,是原生质体融合,由此能取得有性不亲和种间的体细胞杂种和细胞质杂种。把抗病野生种原生质体与易感栽培落花生的原生质体相融合,是有价值的。烟草和马铃薯曾研究过。落花生也开始了,将野生种A.villosa(抗叶斑病,Cercospora orachidicola)与高度易感的落花生的原生质体相融合,得到若干有价值结果。用OnozukaR-10纤维素酶和半纤维素酶混合液处理(过夜)幼叶和人工培养生长的再生植株切段,继而用聚乙二醇使之融合,能取得相当高产原生质体。
通过原生质体融合或吸收和参入需要的遗传信息,能有助于将其它性状尤其是高蛋白质含量参入。
(五)种质深冻保存
自在液氮中保存游离植物细胞成功后,改进的深冻保存技术应用于从细胞悬浮体产生的完整植物,花粉胚和离体分生组织的长期保存。植物细胞和组织培养体的冷冻保存,可能为保存的实用方法和种质国际交换。
1.分生组织的冷冻保存 愈伤组织和细胞培养体、胚和其它组织虽能忍受超低温,并保持其再生潜力,游离分生组织对长期保存种质有下列突出优点:(a)有时愈伤组织难于再生植株,而分生组织尖相对容易再生;(b)分生组织遗传稳定性比愈伤组织的好,后者在长期继代中,出现染色体畸变和核与倍数性水平改变;(c)营养体繁殖的快速方法;(d)游离分生组织可能产生无病原菌植株;(e)尤其是从单倍体植株取得的原生质体,将能保证保持单倍体水平;(f)分生组织细胞小,细胞质浓和薄壁,由此可望生存率高;和(g)细胞培养体要求降温慢和控制下降速度,分生组织可忍突然冷冻,因此分生组织保存不需要恒冷箱。
用液氮速冻的A.hypogaea离体分生组织的生存率高达23-31%。以后,改进影响冷冻方法的各种因素,生存率提高到42%,从冻藏20个月的分生组织再生植株得到20粒正常种子。
关于影响冷冻分生组织,使之成活,再生植株能力的若干因素述之如下。
(1)预培养 离体分生组织预培养在MS+IAA,11.0μM+BA,0.88μM+3%DMSO4天,生存率增高。但10%DMSO证明有抑制作用。
(2)深冻保护剂 各种深冻保护剂的效果综列于表19-7。各用5%的蔗糖、甘油和DMSO的混合剂,生存率最高42%;这种结果比用蔗糖5%+甘油5%要好得多,后者的生存率为29%。
(3)溶化 不同温度溶化冻结的培养体,以先在35℃下溶化,继之40℃和25℃结果最好。
这种程序的成功,强调着预培养与深冻保护剂配合对冻藏分生组织的有益影响。这些培养体的再生完整植株和产生正常种子,证实着分生组织深冻保存在保存植物种上的潜力。
2.花粉胚的冷冻保存 落花生和A.villosa的花粉胚和雄性发育株的花药切段(表19-7)冻存一年,复活了和再生完整植株。将培养在MS+IAA,22.0μM+KIN,9.3μM4-5周的花药,切成2-4段,用于冰藏研究。取50个花药的切段或用铝箔包裹,或浸入1ml含有各加5%的蔗糖、甘油和二甲基磺砜。制成花粉胚悬浮物。冷冻处理后,用(a)胚大小增长,(b)愈伤组织形成,(c)出现绿瘤,和(d)形成根和芽,以判断其是否生存。
表19-7 各种深冻保护剂对花生分生组织生存的效果
(Bajaj未发表)

a.全部浓度都是用5%水平。
b.液氮冷冻保存7个月。
c.生存率的鉴别:分生组织转绿能力,大小增加,和形成愈伤组织或芽。
详细研究了二个种。二者冷冻保存能力不同(表19-8),花生比A.villosa更为敏感(生存率14%)。溶化后花药进行增殖,愈伤组织偶见分化成芽。包裹在铝箔中的花药(干法)比液冻的结果较好。后者花药趋于海绵状。
表19-8 花生属的冻藏花粉胚和雄核发生花药切段的生存率
(Bajaj,1982)
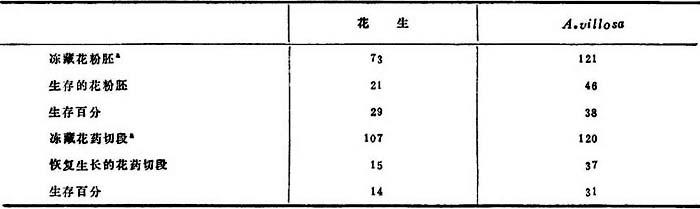
a.冷冻贮藏在-196℃,2个月。
由此可知,从冷冻保存一年的花粉胚培养体的生存和植株再生,说明着深冻法可用单倍体培养物的保存。
3.种质库 现代技术学进展和实践,威胁了罕见植物种的灭绝。遗传资源的减少,引起了国际上注意到罕见和重要植物种的保存,努力于提出种质长期保存方法。传统上是取种子保存。可是,有些种子是“难于对付的”;几年内就会退化,因此种质不能保存。这些植物的遗传母株,可用种子、细胞、组织和器官的深冻储藏保持之(图19-9)。
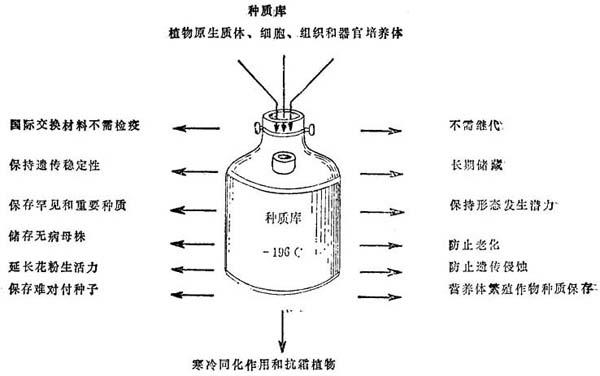
图19-9 原生质体、细胞、组织和器官的深冻保存和建立“种质库”的展望
(Bajaj1977的改进)
为了种质长期保存和建立基因库,采用分生组织是最好方案。它们在遗传上比愈伤组织培养体更为稳定,后者发生遗传侵蚀,不适于保持克隆母系。迄今对许多属分生组织的复活,业已建成了保持种质的深冻贮藏设施。但是,推荐深冻保存法用于种质长期保存的普遍手段前,需要仔细研究二点:第一,复活的培养体的生活力要高,由此不发生选择压。这可采用最适诸因子来达到,如性质、年龄、培养体生理条件,和深冻保护剂、冻结、贮藏和溶化的影响。调节这类因素,使草莓培养体的分生组织生存率达到80%,这指出其它植物有取得高生存率的可能性。第二,必须保证在长期深冻保存期间,不发生种质的退化。马铃薯和Arachis和Cicer(分别深冻贮藏24和20个月)冷冻分生组织再生植株的初步细胞学研究,观察到染色体数没有变化。这个问题尚待深入研究。
(六)培养程序
1.A.villosa花药产生愈伤组织植株再生
(1)将第一次花粉有丝分裂的花药培养在MS+IAA,22.0μM+KIN,9.3μM或BA,8.8μM培养基上。23-27℃,扩散光。5周内长出白色紧密愈伤组织。
(2)愈伤组织继代在MS+NAA,5.4μM+BA,8.8μM上。
(3)1周内产生着芽分化。
(4)将再生芽转移到基础培养基+NAA,2.7-5.4μM以进一步伸长和根发育。
2.花生幼苗外植体和愈伤组织培养体植株再生
(1)用氯液种子表面消毒10min。无菌蒸馏水淋洗3次。
(2)从种子切取胚,培养在无荷尔蒙MS培养基上3-5周。
(3)将幼年幼苗切成切段,把中胚轴、上胚轴或叶培养在MS+IAA,11.0μM+KIN,2.3μM上,使之植株再生。培养温度25±2℃。
(4)幼苗切段和离体胚接种在MS+CH,500mg/l+2,4-D,4.5μM+KIN,9.3μM上,产生愈伤组织。将之转移到MS+IAA,22.0μM+KIN,9.3μm,偶见芽和根形成。
(七)展望
最近几年落花生产量停滞不前。体会到育种和作物改良常规方法可能不足以使产量显着增高。由此急需像人工培养技术新方法以创造遗传变异。原生质体、花粉、细胞和组织培养领域的进展,以及产生各种作物的单倍体、体细胞杂种、细胞质杂种和抗病虫突变体,强调着需将这些方法扩用于落花生改良规划。
就落花生言,采用这些简单技术,如杂种胚和胚珠培养,应全面展开,将不亲和野生种的种质参入落花生中去。再者,研究抗病野生种与落花生间原生质体融合,将有助于诱导遗传多样性。
花药培养产生单倍体和同质植株,将能使品种早日推广。目前,在与栽培落花生杂交前,许多二倍体野生种提高到四倍体水平。较好方法或是产生二倍体落花生植株(2n=20),再与野生二倍体杂交;由此将能取得四倍体落花生。这是就离体花药范围内,或选择20个染色体细胞系并使之再生植株。将人工培养方法加进研究方案,对落花生改良是值得的。
【参考文献】:
〔1〕Boulter,D.and O.J.Crocomo 1979 Plant cel lculture implications::Legumes.In∶Plant Cell and Tissue Culture:Principles and Applications(W.R.Sharp,.VO.Larsen,E.F.Paddock,V.Raghavan,eds.)pp.615-631,Ohio State Univ.Press Columbus.
〔2〕Evans,A.M.and H.E.Gridley 1979 Prospects for the improvement of protein and yield in food legumes.Current Adv.Plant Cci.32∶1-17.
〔3〕Purseglove,J.W.1969 Tropical crops dicotyledon 1.Longmans,New York.
〔4〕Zaumeyer,W.J.and H.R.Thomas 1957 A monographic study of bean diseases and methods for their control.Technical Balletin 868,U.S.Dept.Agric.
〔5〕Cheng,T.Y.,H.Saka and T.H.Voqui-Dinh 1980 Plant regene ration from soybean cotyledoary node segments in culture.Plant Sei.lett.19∶91-99.
〔6〕Christianson,M.L.and D.A.Warnick 1983 Competence and dete rmination in the process of in vitro shoot organogenesis.Dev.Biol.95∶288-293.
〔7〕Christianson,M.L.and D.A.Warnick 1984 Phenocritical times in the process of in vitro shoot organogenesis.Dev.Boil.10∶382-390.
〔8〕CroSS,J.W.and W.R.Adams 1983 Phenvlic levels and embrgogenic potential in carrot cultures.Plant Physiol.72∶546.
〔9〕Kratochwil,K.1983 Embryonic induction.In∶Cellular Interactions and Development∶Molecular Mechanisms.K.M.Yamada.ed.Wiley,New York,pp.99-122.
〔10〕Ratner,V.A.and R.N.Tetthuteav 1978 Simplest genetic systems controlling ontogenesis∶Organization principles and models of their function.Pcog.Theor.Biol.5:81-127.
〔11〕Rendel,J.M.1967 Canalization and gene confrol Logos Press,Ltd.London.
〔12〕Riggs,D.S.1970 Cont rol Theory and Physiological Feedback Mechanisms.Williams and Wilkins Co.,Baltimore.
〔13〕Sneath,P.H.A.and R.R.Sokal 1973 Numerical Taxonomy:The Principles and Practice of Numerical Classifications.W.H.Freeman,San Francisco.
〔14〕Tyson,J.J.and H.G.Othmer 1978 The dynamics of feedback control circuits in biochemical pathways.Progress in Theor.Biol.5:1-62.
〔15〕Yusufov,A.G.1982 Origin and evolution of the phenomenan of regeneration in plant(problem of evolution ontogenesis).Usp.Soyrem.Biol.93∶89-104.
〔16〕Bajaj,Y.P.S.,A.K.Ram,K.S.Labana and H.Singh.1981 Regeneration of genetically variable plants from anther-derived callus of Arachis hypogaea and A.villosa.Plant Sci.Lett.23∶35-39.
〔17〕Bajaj,Y.P.S.,P.Kumar,M.M.Singh and K.S.Labana 1982 Interspecific hybr-idazation in the genus Arachis through embryo culture,Euphytica 31∶365-370.
〔18〕Smartt,J.and W.C.Gregory 1967 Interspecific cross compatibility between the cultivated peanut,Arachis hypogaea L.and other members of the genus Arachis.Oleagineux 22∶455-459.
〔19〕Spielman,I.V.,A.P.Burge and J.P.Moss 1979 Chromosome loss and meiotic behaviour in interspecific hybrids in the genus Arachis L.and their implications in breeding for disease resistance.Z.Pflanzenzuecht.83∶236-250.
〔20〕Wilson,C.T.1973 Peanut∶ Culture and Uses.American Peanut Research Education Association Stillwater,Oklahoma.
〔21〕Kartha,K.K.1981 Meristem culture and cryopreservation-Methods and applications.In∶Plant Tissue Culture(T.A.Thorpe,ed.)pp:181-211,Academic Press,New York.
〔22〕——1982 Cryopreservation of germplasm using meristem and tissue culture。 In:Application of Plant Cell and Tissue Culture to Agriculture and Industry。(D.T.Tomes,B.E.Ellis,P.M.Harney, K.J.Kartha,and R.L.Peterson,eds.)pp.139-161,Univ.of Gulph,Ontario.
〔23〕Mroginski,L.A.and K.K.Kartha 1984 Tissue culture of legumes for crop improvement.In:Plant Bteeding Reviews,vol.2(J.Janicked.)pp.215-264.AVI Pllblishing,Westport,Corn.
〔24〕Wetter,L.R.and F.Constabel(eds.)1982 Plant Tissue Culture Methods.Nationai Resea rch Council of Canada,Saskatoon.