松柏
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第646页(21686字)
(一)营养繁殖重要性
树木改良的重要问题的经济效益和社会效益。种植选择的无性系繁殖体比选择的种子家系至少可增收10%。理由:(1)有从树木改良规划的任何世代增益潜势,由于可繁殖任何阶段的优株;(2)有可能选择和繁殖加性和非加性基因效应,由此增产;(3)选择的克隆能保持在基因库中,建成克隆苗圃;由此可经控制授粉产生基因重组;(4)能以研究基因-环境互作,遗传的和环境的特性间互变量;(5)基因型人工克隆选择能用于建设种植园;(6)邻树间竞争、寄主-病原菌关系和根际共生都可利用克隆内研究;(7)加速繁殖新杂种栽培品种或突变供子代测验,并长期保存以保证规划的连续性;(8)大量生产遗传一致性亲本植株,以生产大量种子。
树林杂交繁殖者高度异质和不亲和的,种子繁殖不仅达到成年树的年数多,通常15-20年,还对亲种的原型难以保证。采用无性繁殖的优势显而易见。例如最合要求的基因型可克隆几百旺势选系,供各处比较测验,很快就能鉴别出最适应短期轮栽生物学产量高的克隆。选择和克隆异种间杂种的每种杂交的优系,也能很快产生遗传改良效果。种植园母株的无性繁殖可节省时间。用常规营养繁殖法如根切段或生根的针叶等,需时长,更由于这些材料取自不同发育时期,常随母株年龄增加(Ortet成年外植体),而ramet(切段幼年外植体)很快失去生根能力。并因成年树年龄增加营养繁殖体的株高和直径增长愈慢。因此,成熟是成功地营养繁殖的关键障碍之一。常用的“还童”技术(嫁接)对切根和微繁殖都是重要手段。但未能广泛采用,大多数松柏细胞培养是用幼年外植体启动的。认为离体培养还能加强形态建成能力。
采用细胞培养作为育规划和大批生产手段的主要优点,是它的无限(潜在)繁殖率。它提供着植株选择的巨大控制性,和能强制全能性表达。由此可知,当用单株切取根切段,几年后,能以再次切取,甚至用休眠芽(供体量有限)能诱导产生许多腋芽和不定芽。从而诱导形成腋芽和不定芽,常能在几周或最多几月就能达到。
(二)研究进展
树木是离体培养最早植物之一。早在1934年,Gautheret培养Pinus pinaster和Abies alba形成层组织。1936年La Rue培养Pinus resinosa,Thuja occiclentalis,Picea ca-nadensis,Tsuaa canadinsis和Pseudotsuga menziesii的胚产生了正常幼苗。1940年代报道了若干宽叶种愈伤组织培养体中器官建成,1950 Ball培养Sequoia sempervirens愈伤组织见到芽的分化。这类芽未能长成茎叶,生芽能力经第4次继代而降低,但这仍是首次从树节上启动的幼不定芽。
1960年代根据Picea glauca正常和肿瘤组织最适生长所需营养的建立,开展松柏细胞培养,不久Brown与Lawrence(1968)采用MS培养基,显着地改进了几种松树种的愈伤组织生长。
1974年IAPTC讨论会上,发表了26篇论文,报道了人工培养裸子植物树木再生植株,完整松柏再生植株尤未产生。1977报道了许多被子植物形成不定芽和茎芽成功,约半数属松属。从Pseudoctotsuga(1972)和Pinus gerardiana(1963)的愈伤组织诱导生了根,和Thuja(Biota)orientalis子叶形成了胚状体,当取出单独培养,形成芽不生根(1965)。这是首次从被子植物芽细胞培养形成芽(茎、叶)。
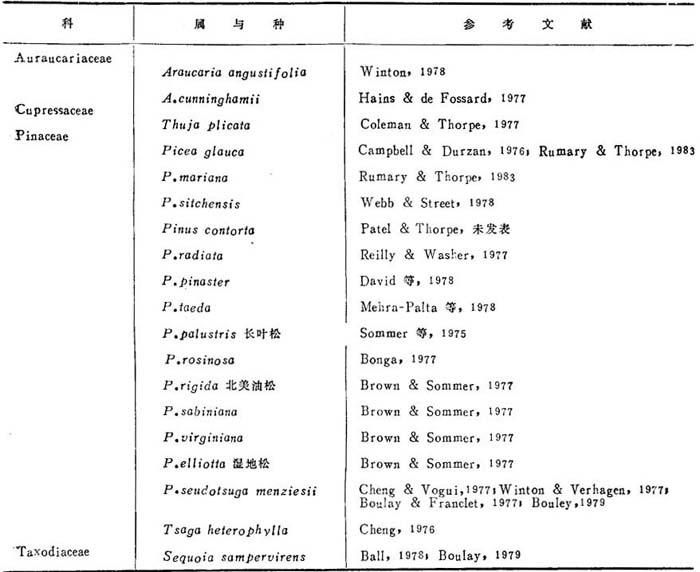
1974Brown氏实验室最先从Pinus palustris(长叶松)人工培养取得松柏完整再生植株。它来源于胚的子叶培养在子叶边缘形成的不定芽。1975年以来,报道日增,能以再生植株的树种列如表25-4,表25-4所列不包括人工培养地下茎、叶分开形成的状态。
表25-4 被子植物再生植株
1971年首次报道了白色针枞(虎尾枞细胞悬浮培养物内细胞分化(维管束因素)。1974从挪威针枞分离出原生质体继而发生细胞分裂。Huhtinen同年由此取得了单倍体大胞子体产生的愈伤组织的根形成;继之也有报道茎叶再生。松柏细胞悬浮培养体产生体细胞胚胎发生尚待研究。
(三)细胞培养方法
培养形成层外植体的早期成果,由此相对易于诱导和保持愈伤组织培养物,可能由于它们的内生细胞分裂素(CK)含量高。这样供给生长素作为唯一生长荷尔蒙就足够了。另一方面,形态建成更难成功,需要精确的生长素-CK平衡。最常用的CK原来是KIN,现常用BA代替。偶单用ZEA和2ip或与其它CK配合。
大多数细胞培养体系也需要供给外源生长素,但有例外,如Pinus radiata子叶培养和Picea glauca下胚轴培养。这可能反映出外植体内内源荷尔蒙浓度差异,并指出生长素-CK平衡必需考虑外植体的生理状态。可是,由于对内生荷尔蒙含量、荷尔蒙作用机理和组织、细胞与分子水平互作上生长素-CK定量差异,不常能导致发生形态建成。除生长素和CK外,其它许多化学因素对控制形态建成也有作用,还有光、温、渗透潜势等物理因素的影响,使情况变得更复杂。Douglas fir培养基启动芽形成,在培养第3、4或5周即芽原基发育时期,红光660nm对此有所加强。
仔细选择外植体很重要,多数学者认识到这种重要性,以及其与供体植株条件的密切关系。一般认为组织愈幼,处于活跃生长中的,就地器官分化进程的反应愈好。在培养物中诱导形成分生组织的细胞,必需以某种方式表现相当程度的弹性,以改变它们的正常发育途径。
Aitken等(1981)注意了外植体选择对放射松培养物的不定芽形成的重要性。采用从胚切取的子叶,其芽形成能力比完整胚的高二倍,用新发芽种子的子叶,芽形成能力比胚上的子叶高12.5倍。mott等(1977)培养鳞状多刺松取得同样结果。再者放射松体系指出即使相差几天(例如发芽后5-10天),子叶形态建成能大受影响。
影响外植体生理状态的外界因子,能影响对培养的反应,并易于控制和标准化。取种子作外植体源,贮藏和吸涨时期和温度,层积程度,发芽时期和条件是重要的。由此,长叶松种子无休眠,能直接用以培养,鳞状多刺松经部分层积后,取子叶培养能产生更多芽。同样可应用于选择供源亲本植株,因为它的生理状态对外植体在培养中的行为有决定性作用。例如还童处理概念,又如挪威杉休止芽的芽增殖,视供体植株生长条件而异。从自然生长树木到温室到人工气候室生长的,反应改进相当大。
外植体间或种子间(反映基因型差异)反应的差异性。由于树种的高度异质性,尤应重视。放射性胚培养曾观察到每个胚产生1-200芽的差别。其它种的细胞培养物也很可能在形成芽的外植体数和每个外植体形成的芽数上发生相似程度差异性。培养基改进和选择外植体能显着降低这类差异。
Durzan和Campbell(1974)把微繁殖法分成二类:第一类由有组织部分体系组成,包括芽培养,茎段(包括切枝),松针叶(短枝或短芽)和芽或幼苗茎尖。其芽增殖特征是由于未萌动腋芽(即预先形成的分生组织)的发育。应强调指出这类培养物常有产生腋芽和不定芽的能力,或仅生后者如Douglasfir。第二类由非组织体系组成,在活体上形成不定芽和/或胚状体。例如愈伤组织或细胞悬浮培养体和胚胎发生的组织(可不经愈伤组织阶段直接形成不定芽)。
理论上,有组织体系的发育途径应是较短而有利。经验指出一个好的有组织体系能在几周内产生芽。利用已形成的分生组织意指子代个体数是固定的。可是,如果能建成一个快速“世代时间”(比如从第一腋芽形成到从启始外植体腋芽形成5-6周),就能采用这种方法。非组织体系言,理论上可从植株任何部位产生培养物,后代个体数是无限的,尤其是悬浮培养物。许多学者理解到尤其是从愈伤组织的繁殖体,在某种较少程度上,从某些器官外植体,可能出现与原有亲本不同的遗传变异。实质上,细胞培养的植株繁殖过程本身不应显着增高突变率,否则用了淘汰不合要求的再生植株(尤其是如果突变要到大田种植后才能鉴别)的时间和费用,很容易抵销这种方法所能取得的好处。树木培养中遗传不稳定现象是否广泛存在或严重性还不知道。再者,细胞质后生遗传因子,对树木细胞生长、生根能力,嫁接率,幼株率和年龄有显着作用。
一般假定茎尘分生组织提供大的遗传稳定性,在器官外植体上长出的不定芽产生反常植株或然率界于腋芽与愈伤组织产生的芽之间。
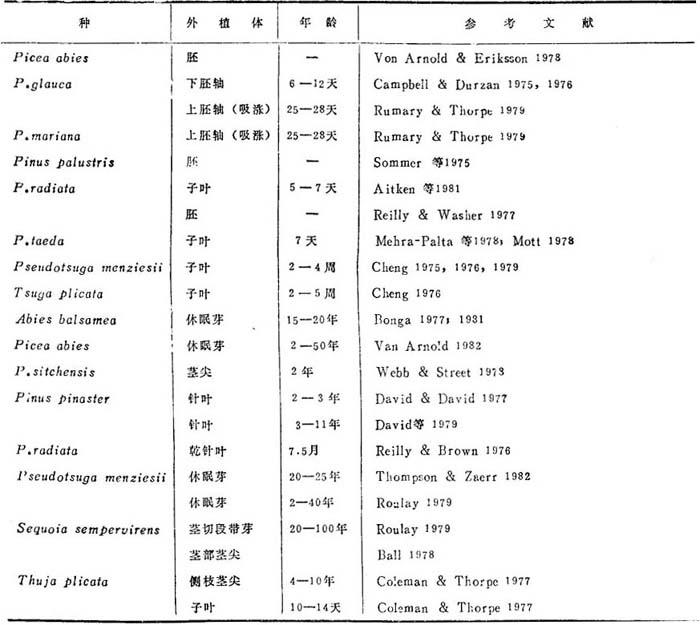
表25-5汇综了目前采用的某些外植体类型已知再生了芽、茎叶和、或再生植株。最常用的外植体是胚或幼苗部分。这类胚胎发生材料一般很易发生反应的。较老材料一般较为困难,但用成株的芽已取得了某种成功。
表25-5 松柏种的部分和年龄用作外植体以诱导原基之例
从不同外植体启动的愈伤组织培养物,已在许多松柏中建立,继代的愈伤组织产生茎叶或再生植株还很少例证,但Douglas fir,Pinus wallichiana和Sequoia sempervirens除外。
(四)形成再生植株阶段
松柏再生植株形成可分下列四个阶段:
1.启动茎茅 把选择的外植体接种在附加CK 0.5-30μM高盐培养基MS或SH上。有时加低水平生长素(0.005一0.5μM)。其它种如放射松不需生长素,甚至它会加强愈伤组织形成,而不是启动原基。有时同时加CK和生长素比单用更为有效,如Douglas fir对BA加2iP和IAA加2iP反应良好。
在胚胎发生外植体形成不定芽时,在外植体边缘发生细胞分裂,产生具有大核、细胞质浓的小细胞(分生组织细胞)。直接包含着表皮和下皮细胞。这些细胞增殖结果,外植体膨大,形成瘤状组织,叫“分生组织芽中心”和“分生组织”。培养3-8周内,不断增长着“圆盖类膨大”,“类分生组织”或“管状突出物”和“鳞片状器官”。
在这些早期阶段,可把它亚分成许多较小片的分生组织团块,以增加芽的生长,Pinus radiata曾有报道(1977)。通常把外植体培养约9天时进行亚分,当时可见许多芽互相抑制生长和发育。同样,挪威杉每个培养的胚形成了10-30芽,只有2或3个将伸长。如果将芽高3-5mm切离,新芽将开始伸长。新西兰Rotorus森林研究所试验指出增加一个液培阶段,可能更增大繁殖10一25倍。
Borge(1977,1981)采用一种新方法,用以诱导成年植株休止芽的增殖,这种方法超出外源生长素-CK变异。早期研究发现如果15-20年龄Abies balsamea胚胎发生芽(休眠芽除去芽鳞片)浸在蒸馏水24小时或100mg/l咖啡酸溶液15min,转移到营养培养基上进行器官建成,形成不定芽。他未能建立最有效的浸渍处理,但假定浸液时从外植体流出抑制物质,他设想浸液的高生长调节剂含量,简单地发生了加速流出效果,而单用水流出速度较慢。Bonga(1981)最近报道除丙二酸(9.6mM浸15分钟)随之浸水24小时外,在浸液中加大量生长素、CK、生长抑制剂、除莠剂、抗氧化剂和其它化学药剂效果极小。有时转移到Bonga(1977)改进的Romberger、Varnell和Tabor氏培养基上后在针叶基部出现针叶器官和小芽簇。丙二酸可能产生对TCA循环抑制作用,由此而引起积存琥珀酸,其它TCA循环酸类,谷氨酸、谷酰胺,或使部分氧化代谢转变到五碳糖磷酸途径,可能对形成芽原基有重要意义。
松柏组织培养芽诱导的生理和调节研究极少。例如培养15年龄Douglas fir和其茎尖与幼苗,在有IAA存在时,生长中芽的IAA浓度比草本种如Pisum或Phaseolus的营养组织含量高一级。Caruso等(1978)还指出与在培养中再生植株的同一发育时期的幼苗,内生IAA水平惊人的高。Von Arnold(1979)指出在低浓度生长素培养挪威针枞能诱导其针叶(取自5年生树)形成不定芽增多,但胚培养中,同浓度生长素无刺激作用。松柏组织培养中内生CK状态和外源CK作用模式尚待阐明。但就其它种言,BA刺激蛋白质合成,多核糖体形成和新合成蛋白质谱有质的改变。
Hasegawa等(1979)研究指出培养2天可测出.Douglas fir子叶外植体芽形成对无芽形成的新合成蛋白质电泳带谱有差异,即使最早可见的组织学变化,也在第4天开始出现。用放射松子叶培养指出从幼苗切取外植体时(胚根伸长时),它们处于代谢活跃状态:3H氨基酸主动渗入;培养0天时存在的贮藏物质(脂质、游离糖、淀粉、蛋白质)迅速降低;和蛋白质-N经起始下降后(贮藏蛋白质解体)复升。由此指出发芽种子取得放射松子叶,切取时贮藏物质含量高,DNA,RNA,蛋白质合成的代谢已很活跃,而许多其它外植体类型正在衰老或休眠。培养0-3天间出现呼吸高峰,保证了主要贮藏物质能很快活化,为形成不定芽过程需要高能提供碳、氮和能。当时要求继续的蛋白质合成以保持稳定蛋白质含量。很多能设想来自脂质很快解体,由于脂质的减少超出生产膜脂质等所需很多。
2.芽发育成茎叶 大多数情况下,形成树木茎尖和幼叶原基需要更换营养和、或荷尔蒙水平。有些芽形成后,必需改变培养基,以备茎伸长。这样有利于诱导生根,和把个体茎分开。例如放射松培养体转移到SH盐类上3-4周,继之移到Gresshoff与Doy盐类上3-4周,再放在基础培养基不加荷尔蒙和降低蔗糖用量(1-2%代换3%)以供生根。某些情况将大元素和微量元素稀释减半。加活性碳(0.1-1%)有时有利于茎叶伸长,但其作用尚不清楚,可能是吸收过多荷尔蒙或抑制物质。由于活性碳来源不同效果不一致,可能还有别的作用。松柏产生的碳对白色和黑色虎尾枞芽发育最好。
加强芽伸长的因子还有维生素D(5μM),远红光和高光强。理论上,GA应有利于节间伸长,但它对松柏培养体无效。
将长期培养在相对高CK(细胞分裂素)的芽转移到无CK培养基上,不能经常足以降低内生CK浓度到容许其伸长和生根(移来效应)。Mott提出可能需要荷尔蒙“冲击”。这意指把外植体暴露在高浓度荷尔蒙很短时间(如少数几天),在可见新形成器官前,转移到无CK培养基。Cheng(1975)采用这种方法,把高浓度CK(0.5-1.0mM BA)滴加在Douglas fir组织周围,再转移到无植物荷尔蒙培养基。可是,Biondi与Thorpe(1982)发现CK对放射松诱导芽形成最有效,如果培养最初21天加CK的话。暴露在CK中时间较短,减少分生组织形成。
3.芽的生根诱导离体培养产生芽的生根常用方法,包括降低培养基盐类含量(例如减半量无机盐类),减少蔗糖(0.5-1%),温度降到约20℃,最初10天暗培生根处理,继之光培。至于荷尔蒙处理,生长素代表着关键因素。单用IBA(0.5-49μM),IBA+IAA或IBA+IAA,或浸在IAA或IBA浓溶液(590-685μM)过夜,都曾收得成功。有时加低浓度CK(0.04-0.4μM)有效,但一是形成根原基,必需转移到无荷尔蒙培养基上,以供根伸长。Pinus taeda,Tsuga heterophylla,Pseudotsuga menziesii,Thuja plicata,Pinus radiata,Sequoia sem pervirus和Pinus pinaster等被子植物生根成功。
有意识地发现非无菌条件下生根,与无菌生根效果相等或更好。再者,无根芽(茎叶)移入土中比带根芽更容易。由于芽与根间维管束联接不完全,再生植株移栽有时有困难。这种情况非无菌生根或可较少发生。琼脂生长根有时不长根毛,也可用非无菌生根来避免。
Loblolly松芽(长5mm)能在 石-沙或泥炭-地衣-沙(1.5∶1)混合物中生根,在喷水雾(隔6min喷6s)下。采用底部温度26℃,高光强10000lx。土中生的根比琼脂中生的更为健旺。
石-沙或泥炭-地衣-沙(1.5∶1)混合物中生根,在喷水雾(隔6min喷6s)下。采用底部温度26℃,高光强10000lx。土中生的根比琼脂中生的更为健旺。
在非无菌条件下,用水-琼脂培养基加11.0μMIBA和2.7μM NAA预处理Pinus radiata芽(长1-2cm)5天。然后转移到泥炭-浮石(1∶1)生根混合物中,最初1周保持在水雾状态中。修剪单根伸长根促进侧根生根。
Cheng(1976)把西部毒芹芽栽在“Mica-Peat”土壤混合物中生根,每隔2天浇NAA(15μM,pH6.2)溶液一次,2周。加盖塑料篷以保持相对湿度。
很多例证指出知之很少的根菌共生改进着生根和再生植株生长。最近报道外根菌真菌Hebeloma hiemalc能增高Pinus halepensis下胚轴生根百分。尤其是培养在降低生长素培养基上,这样荷尔蒙处理的形态建成影响低。
4.再生植株移植大田 移栽大田一般原则:(1)根和茎叶要有合理平衡。(2)再生植株要逐步转移(2-3周内),从恒常高湿度到低湿度苗圃或大田。法采用塑料蓬保湿。(3)除去根部琼脂,由于它是病原菌生长的茎质。(4)选择容器以利再生植株生根和生长。(5)带根再生植株或可直接移栽苗圃。
5.大规模繁殖的潜势 至今已建立的松柏细胞培养系统指出,用人工培养方法大规模还不可能,有问题或不经济。但是只使是很少的高度生产力系统是鼓动人心的,尤其因涉及很难繁殖的和杂质树种,以及取得成功的研究领域还不足十年。例如AFOCEL从10-500年龄珍贵树Sequoia sempervirens采用细胞培养建成了克隆园地。从200无性系可生产30000再生植株。松柏树种有可能像Eucalyptus等森林树种种植10000英亩,用了7.5百万试管树。
单是微繁殖费用过高,直接用于更新森林不合经济。它能用作中间阶段,从选择的种或控制授粉产生的种子,用切枝生根取其繁殖体(吸枝),快速建立克隆园地。美洲杉细胞培养阶段可得很老材料还童之利,否则将不能繁殖。
从细胞悬浮培养物能产生体细胞胚胎发生的树种,可实现集团繁殖。这种技术可经胚形成直接再生植株。还有其增殖率是巨大的。Durzan(1976)估算如果80%细胞形成植株,100L培养基能产生足供种植100000英亩所需幼苗(树距12×12英尺)。松柏细胞培养偶见胚状结构。如Thuja子叶,香枞伸长的休眠芽,挪威虎尾枞愈伤组织悬浮培养体经反复转移后形成5-10细胞小胚状结构。Douglas fir悬浮培养物在含有无机盐、铁和蔗糖简单培养基上产生小胚状结构。白枞和菠萝松愈伤组织的悬浮培养物出现小胚状结构。Douglas fir和Loblolly松细胞悬浮培养物也观察到这些结构。但至今未见体细胞胚再生植株。Pinus con-torta细胞悬浮培养体细胞分化观察到形成假导管因素。除去培养基中的硼能改变这种发育途径,代之以形成韧皮部类因素。
细胞悬浮培养物中常见酚类化合物在培养基积存,这对原胚是致死的。Durzan等(1973),和最近Litvay等(1981)发掘了一种松柏悬浮培养基,成功地用以控制旦宁产生。这是根据分析发育的Douglas fir资料而设计的。这种培养基(表25-6)可以延长Douglas fis和Loblolly松幼年和成熟树组织生长和保持细胞悬浮培养体中。酚生产降低甚大。
表25-6 松柏细胞悬浮培养培养基组成

6.树种改良 植物细胞培养主要目的是作物改良。自1929年以来,就认识到树木改良中的特殊生理技术:它的复杂性、异质性,和寿命长。Durzan(1980)列举利用细胞悬浮培养的优点:(1)起始材料只要少数细胞,(2)细胞能像细菌一样生长,且有潜在全能性,(3)空间利用和繁殖系统经济和可加控制,(4)由于能筛选大量细胞和选择突变性状,能诱导和鉴别突变,(5)再生植株所需时间和费用大大降低(培育细胞有可能长达18个月),(6)突变性状在单倍体上不受掩盖,单倍体细胞二倍体化可用于遗传分析和改进(杂种优势)和(7)能除去细胞壁产生原生质体,供遗传操作利用(融合产生体细胞杂种或DNA吸取等等)。
7.自发突变 人工培养再生植株出现表型(或体细胞克隆)变异。已熟知长期培养物会发生染色体数变异。但是,被子植物三倍体(例如杨柳三倍体)比二倍体生长率快得多,自然和诱导松种多倍体,似乎表现生长减退和形成形态反常幼苗。
8.性状改变 人为引入新性状时,常发生于处理的群体的一小部分。Carlson等(1972)从2×107细胞群体,改变的细胞只有33个。因此:(1)必需有能掌握大量细胞群的体系,如悬浮培养体。(2)必需建立筛选和选择改变的细胞方法,在培养基上植板细胞,只有改变的细胞能生长,是易而快方法。(3)树种有多效性,可选择一种需要特性改变的细胞。
大多数突变是隐性的,培养单倍体花粉粒或雌配子体,继之再生单倍体植株,是改良松柏树种的重要方法。在再生植株前或后加倍染色体可得同质二倍体。
LaRue(1954)和Tulecke(1953)首次指出被子植物花粉能形成愈伤组织。Bonga与Fowler(1970)开始人工培养Pinus resinosa小孢子囊,小孢子叶和成熟花粉,除成熟花粉外,取得愈伤组织。Sommer与Brown(1979)培养Loblollv,长叶和Virgina松孢子体形成了愈伤组织,但只有Virgina松取得了单倍体愈伤组织。
一般言之,花粉产生愈伤组织是由混倍体细胞群体组成,只能进行有限器官建成。其复杂性在于:花药、小孢子囊培养物中花粉粒具有不同基因型,除非由愈伤组织中单细胞再生植株,或从单个花粉粒形成胚,结果产生嵌合体。其二,那类培养体的特征是多核细胞。其三,许多树种具有不良、致死隐性基因,产生的同质二倍体,可能出现衰退或甚至死亡。
被子植物大孢子体是一个大单倍体结构,从单个大胞子产生的许多细胞组成,因此是完全基因型同一的。最近,广泛培养挪威枞雌孢子体,成功率5%,培养基是MS+谷酰胺,KIN和2,4-D。有90%愈伤组织是单倍体,继代后仍能保持。在含4.6-23.0μMK IN培养基上形成胚状小芽,但不生根。Steinhauer与Huhtinen(1978)从那类培养体取得芽再生成功。
Bonga(1970,1974)培养各种松种大孢子体,常见愈伤组织,几乎都出现单倍体中期染色体。只有Mugo松细胞有某种细胞分化(圆形生长中心有时有假导管)。他人用长叶松得到类似结果。Bonga(1977)从培养在Brown和Lawrence培养基(1968)加IAA挪威枞雌配子体愈伤组织取得再生植株,Ball(1981)从Sequoia sempervirens取得再生植株。但都非单倍体。Huhtinen(1976)认为在切取配子体时,胚的二倍体细胞相混淆,和形成愈伤组织频率低。并提出在高湿度下从球果取春化种子,易于取得胚。
Douglas fir,挪威枞,海松和其它种的原生质体形成愈伤组织。不同种原生质体融合很少成功。遗传工程工作尚待研究。
(五)幼年和成年
树木营养繁殖最严重困难是阶段转变和分生组织成熟。成株分生组织的无性系繁殖常产生不合适特性如横斜性生长、生长率降低等。目前采用成年预处理(“还童”),如在特定位置上的新生的部位反复剪枝。放射松经如此处理后,以保持在剪枝时的成熟状态。
经系列繁殖也能推迟成熟。如果从原来ortet切取ramet生根,从其取ramet生根,如此循环,相继世代生根率可能增高。Pawseg(1971)发现第四代接穗的ramet比以前的嫁接材料的生长表现更为幼年。Dauglas fir也用嫁接在幼年幼苗以求“还童”。嫁接材料随嫁接世代的增多,幼年(幼苗状)形态逐渐增加,对离体培养繁殖反应增大。如放射松之例。这种方法也适用于Pinus pinea,P.pinaster,P.nigra,P.rigida和P.halepensis。
最近采用BA喷ortet,似能除去钝化分生组织的抑制(包括芽的突发)。人工培养阶段,有时成熟过程本身可得恢复。把100年龄红木继代,每次继代生存率增高(从起始培养的2/35,第四次继代增高到12/12),第五次继代大多数芽变成直生性,有一个芽自发生根。细胞培养学者要研究基础解剖问题,以澄清痕迹芽,潜伏芽,epicormic芽等等。
许多幼年和成熟组织间化学-生理差异尚待阐明(如抑制剂、酶活性、氧化还原状态等),实用上,采用上述方法可得相当大的成功。其改进和广泛采用,可显着有助于成熟材料的繁殖。
(六)培养程序
1.Pinus radiata:胚和子叶培养
(1)用50%商品漂白粉种子表面消毒15min,流水中洗过夜。
(2)种子浸入6%H2O210min,无菌水洗3次。
(3)贮存在5℃48h。
(4)胚培养,无菌去除种子壳和胚乳,取出胚。
(5)子叶培养,将种子在无菌 石上,或放在滤纸桥上浸水,暗培5-7天。
石上,或放在滤纸桥上浸水,暗培5-7天。
(6)取种子根出现的幼苗备用。幼根长1-30mm;子叶长最适3-5mm除去种子壳和胚乳,在无菌条件下从节上切取子叶。每粒种子可有5-10片子叶。
(7)把各个子叶段或胚平放在固化培养基上,用Reilly和Washer改进的SH培养基:
KNO3 0.025M Na2-EDTA 0.06mM CuSO4·5HO 0.8μM
MgSO4·7H2O 1.62mM MnSO4·4H2O 0.09mM Na2MoO4·2H2O 0.8μM
NH4HP2O4 2.6mM H3BO3 0.08mM CoCl2·6H 2O 0.8μM
CaCl2·2H2O 1.36mM ZnSO4·7H2O 3.4μM
FeSO4·7H2O 0.03mM KI 6 μM
附加 肌醇 5.5mM 盐酸吡哆醇 2.4μM
盐酸硫胺素 14.8μM 蔗糖 87.6mM
烟酸 0.04mM BA 22μM
琼脂固化 8 g/l pH5.6-5.8
(8)取培养基20-25ml,装入100×15mm培养皿,培养在16小时光周期,光强80μEm-2s-1,日、夜温度分别为28±1℃和24±1℃。
(9)培养3周后,将发育中胚或子叶段转移到同样培养基上,蔗糖改用58.4mM,不加BA。
(10)每第3或第4周转移一次,8周后,改用玻璃瓶。
(11)芽长1-2cm时,取出放在水-琼脂培养基上,加4.9μM IBA,和4.7μM NAA5天,以促生根。
(12)移植于泥炭-浮石(1∶1)生根混合物,第一周放在湿雾中。9-12周芽发育成可以分开。每生芽的胚平均带根芽数9-15个(变异:1-200)。每种子(用切取的子叶)可生根芽平均数为180。约有87%胚产生了芽;子叶则为100%。
2.Picea albies:胚和针叶培养 此法也适用于P.sylvestris和P.contorta和P.sylvestris针叶。
(1)从5年生温室生长植株取新生芽。应齐茎切取。
(2)用7.5%次氯酸钙溶液表面消毒,浸种子20-30min,吸涨芽10分钟。移入70%乙醇2min,无菌水洗,种子一次,吸涨芽3次。
(3)无菌中从种子解剖取胚。从针叶上半部切取3mm顶尖。每芽取30针叶。
(4)外植体放入装在5cm培养皿中的5ml改进LP培养基上。基础培养基是豌豆叶肉原生质培养基和胚培养基混合组成。改进的LP是不加肌醇,2,4-D和2iP,Ca2浓度从12降到1.2mM,附加蔗糖100mM,2iP 5μM(胚)或BA 10μM(针叶),琼脂5-7g/l。低生长素(IBA或NAA0.5-10μM)使针叶成胚百分稍增高,胚无此影响。
(5)胚培养体培养5周,针叶培养6周。转移到1/2基础培养基不加CK,以供芽发育。每第3或4周转移到新鲜培养基上。
(6)培养温度10-16℃,最初4-14天,然后移置20℃,连续光照(白色荧光400-700nm)20Wm-2。
(7)胚培养芽发育平均培养时间7周,针叶10周。胚培养体,培养5周后,平均60%外植体有不定原基。针叶培养12周后,平均每外植体有不定芽10。6周后43%外植体有原基,12周后,22%外植体有不定芽。
(8)不定芽原基有二种类型:(1)“鳞片状器官”,是胚培养在较低CK占优势,类似芽原基,最后形成带有顶圆盖的芽原基和针叶原基;(2)“管状突出物”,胚培养在较高CK占优势,由富含细胞质小细胞组成,围以中央木质层因素。最后为绿“芽鳞片”围绕的芽。几乎(1)型原基全发生在针叶上。
3.Pseudotsuga menziesii:子叶培养
(1)除去种子壳和用5.25%次氯酸钠表面消毒8min,无菌水淋洗。
(2)在1/2MS加0.06mM FeSO4·7H2O,0.11mMNa2-EDTA,87.6mM蔗糖,肌醇1.39-2.78mM,硫胺素7.4-14.8mM和琼脂6-8g/l,pH5.5。培养在25℃18时小光照。
(3)另一方法,将种子直接播在土混合物(高粱泥炭和 石60∶40),放置生长箱内,18小时光照,25℃/19℃日/夜。2-4周后,用6%商品漂白粉消毒子叶,摇动8min,无菌水洗3次(Cheng和Vogui,1977)。
石60∶40),放置生长箱内,18小时光照,25℃/19℃日/夜。2-4周后,用6%商品漂白粉消毒子叶,摇动8min,无菌水洗3次(Cheng和Vogui,1977)。
(4)第二种方法(Abo El-Nil私人通讯)将贮藏在0℃的种子,6%商品漂白粉消毒,无菌水淋洗后,将种子放在湿滤纸上,存放在4℃3周。放在土混合物(泥炭-真珠岩-沙)发芽。
(5)发芽后2-4周,将子叶切成长3mm小块,放在50m1琼脂培养基装在100×200mm培养皿中,或放在织物组织支持物上(100%聚酯绒,厚3mm)装在塑料培养皿。这类支持要求液体培养基,更换培养基中,可用虹吸法除去老培养基。
(6)培养基附加BA5μM,NAA0.5-5μM,或BA5μM,IBA2.5μM,IAA2.5μM,用于芽形成。培养在25℃,18小时光照。通常97%外植体长芽。
(7)4-6周后,将培养物转移到无荷尔蒙培养基,供芽伸长。
(8)当芽长2cm时,切取,各个地培养在培养在装20ml琼脂固化培养基,19℃,蔗糖减至5g/l,和NAA0.25μM。结果约80%生根。
(9)移到不加NAA培养基上,供根伸长。
(10)移栽土中,近乎90%成活。
4.Thuja plicata:成熟组织
(1)从4-10年龄老树取营养侧枝。用焙腊封切口。
(2)20%次氯酸钠表面消毒,25min,无菌水淋洗4次。
(3)切取长8-10mm茎尖(可见成对侧鳞片状叶)。
(4)为了芽形成,接种在MS盐类加肌醇555μM,天门冬酰胺757μM,盐酸硫胺素1μM,盐酸吡哆醇1μM,烟酸1μM,BA 50μM,NAA 0.1μM,蔗糖87.6mM,琼脂8g/l,pH5.2±0.2o
(5)培养在25±2℃,连续光照2000lx6-8周。
(6)生根:把发育的芽转移到1/2MS盐溶液加上述维生素1μM,蔗糖87.6mM,IBA50μM,琼脂8g/l。培养在16h光周期中。
(7)4-6周后,再生植株移植泥炭- 石1∶1土混合物中,温室湿雾下,光周期16h。
石1∶1土混合物中,温室湿雾下,光周期16h。
(七)展望
细胞培养技术将不能代替常规树木育种,可作为互补方法,用于树木育种,基因型评价等等。为了完成这种任务,要求下列领域组成协作研究。
1.采用单倍体作为测验特种性状的遗传位点的结构连锁方法。树木常出现特性间的密切连锁,难于表现典型遗传分离。
2.筛选抗病性。这是树木与病害斗争的唯一方式。
3.研究菌根共生。早期研究指出离体根可用于研究菌根侵染。需研究内生和生态菌根联合。
4.必须研究幼年性和成年性。还童可能是用成年组织成功的关键。
5.调节器官建成,胚胎发生和生根。松柏愈伤组织或细胞悬浮培养体不能再生植株成功,将不可能利用无性方法等取得细胞转变的进展。
6.了解活体和人工培养组织中氮化合物成分与生长率间的相关。由于氮常是森林土的限制因子,这很重要。
7.培养的组织一或更多特性与后代表现间相关。例如,愈伤组织生长率与再生植株生长率有相关吗?急需测验早期某些特性方法,在最早阶段(即细胞培养阶段)评价的任何可能性,值得深入研究。这将显着加速育种规划,遗传所得的快速评价。
9.形成自然化合物包括:纤维和木材。要研究其调节因子,是否在人工培养下可能控制。可惜,树木尚缺少好的木质细胞培养体系,亟待研究。
细胞培养应用于树木改良的最迫切任务,是从体细胞和配子组织再生植株,继之田间测验。这指出不仅从幼年也要从成年树取得再生植株。此外,这应从大规模选择、科、和原产地取得,以避免单一栽培的危险。再生植株必需复制亲本表型和基因型,并供遗传测验。
【参考文献】:
〔1〕Corley,R.H.V.,C.Y.Wang,K.C.Wool and L.H.Jones 1981 Early results from the first oil palm clone trials.In:The Oil palm in Agriculture in the Eightjes,vol.1pp.175-196.Incorporated society of Planters,Kuala Lumpur,Malaysja.
〔2〕Eeuweens,C.J.1978 Effects of organic nutrients and hormones on growth and development of tissue explants from coconut(Cocos nucifera)and date(phoenjx dactylifera)palm cultured in vitro.Physiol.plant.42:173-178.
〔3〕Jones,L.H.1974 Propagation of clonal oil palms by tissue culture.Oil pajm News 17∶1-8.
〔4〕Lioret,C.1981 Vegetative propagation of oil palm by somatic embryogenesjs.In,The Oil Palm in Agriculture in the Eighties,vol.1.pp.163-172,Incorporated society of Planters,Kuala Lumpur,Malaysia.
〔5〕Rabechault,H.,S.Ahee,and G.Guenin 1976 Resherches surla culture in ritro des embryons de palmier a huile(Elaeis guineensis Jacq.).Ⅻ.*Effects de substances-de croissanee a des doses supraoptimales.Relation avec le brunissement des tissus.Oleagineux 31∶159-163.
〔6〕Tisserat,B,1984 Date palm.In∶Handbook of plant eell culture,Vol.2,(W.R.Sharp,D.V.Evans,P.V.Ammirato and Y.Yamada,eds.)pp.505-545,Macmill an,New York.
〔7〕Wang,P.J.and L.C.Huang 1976 Beneficial effects of activated charcoal on plant tissue and organ cultures.In Vitro.12∶260-262.
〔8〕Goncalves,A.N.,M.A.Marc*hedo,L.S.Caldas,W.R.Sharp,and H.A.Mello.1979 Tissue culture in Eucalyptus.In∶Plant Cell and Tissue Culture∶principles and Applications(W.R.Sharp,P.O.Larsen,E.F.Paddock and V.Raghavan,eds.)pp.509-526,Ohio state Univ.Press,Columbus.
〔9〕Radojevic,L.1979 Somatic embryos and plantlets from callus cultures of Paulownia tomentosa steud,Z.pflanzenphysiol.91∶57-62.
〔10〕Redenbaugh,K.,D.F.Karnosky,and R.D.Westfall 1981 Protoplast isolation and fusion in three Ulmus species.Can.J.Bot.59∶1436-1443.
〔11〕Saito,A.1980 Fusion of protoplaots isolated from somatic cells of tree species.Bulletin of the Forestry and Forest Products Research Institute No.309,pp.7-12.
〔12〕Sommer,H.E.1981 Propagation of sweetgum by tissue culture.In∶Proc,6th Southern Forest Tree Improvement Committee,pp.184-138.
〔13〕Zhu,X.,R.Wang and Y.Liang 1980 Induction of poplar pollen plantlets.Sci.Silv.Sin.16∶190-197.
〔14〕De Guzman,E.V.,A.G.del Rosario and E.M.Ubalde 1979 Proliferative gro-wths and organogenesis in coconut embryo and tissue cultures,Philipp.J.Cocon-ut Stud.7:1-10.
〔15〕Eeuwens,C.J.and J.Blake 1977 Culture of coconut and date palm tissue with a view to revegetative propagation.Acta Hortic.78∶277-286.
〔16〕Rabéchault,H.,J.Ahée and G.Guénin 1970Colonies cellulaireséf formes cmb-ryoids obtenues in vitro a partir de cultures démbryons de palmier a huile(Elaeis guineensis Jacq.var.dura Becc),C.R.Acad.Sci.270∶233-237.
〔17〕Reuveni,Q.and H.Lilien-Kipnis 1974 studies of the in vitro culture of date palm(phoenix dactylifera L.)tissues and organs.Volcani Inst.Agric.Res.Div.Sci.Publ.Pam.145,Bet Dagan,Isreal.
〔18〕Reynolds,J.F.and T.Murashige 1979 Asexual embryogenesis in callus cultures of plants.In Vitro 15∶383-387.
〔19〕Tisserat,B.1979 Propagation of date palm(Phoenix dactylifera L.)In Vitro,J.Exp.Bot.30∶1275-1283.
〔20〕Ahuja,M.R.1983 Somatic cell differentiation and rapid clonal propagating of aspen.Silvae Genet.32∶131-135.
〔21〕Ahuja,M.R.1983 Isolation and culture of mega and normal protoplasts in aspen.Silvae Genet.32∶225-227.
〔22〕Ahuja,M.R.1984 A commercially feasible micropropogation method for aspen.Silvae Genet.33∶174-176.
〔23〕Winton,L.L.1970 Shoot and tree production from aspen tissue cultures.Am.J.Bot.57∶904-909.
〔24〕Wolter,K.E.1968 Root and shoot initiation in aspen callus culture.Nafure 219;509-510.
〔25〕AFOCEL.1979 Micropropagation d′Abres Forestiers. No.12-6/79, Association Foret-Cellulose,Nangis,France.
〔26〕Bongs,J.L.and D.J.Durzan(eds.)1982 Tissue culture in forestry.MartinusNijhoff/Dr.W.Junk,The Netherlands.
〔27〕Durzan,D.J.1980 Progress and promise in forest genetics.Proc.50th Anniversary Conf.,Paper Science and Technology-The Cutting Edge,Institute of Paper Chemistry,Appleton,Wisconsin,May8-10,1979,pp.31-60.
〔28〕Karnosky,D.F.1981 Potential for forest tree improvement via tissue culture.Bioscience 31:114-120.
〔29〕Mott,R.L.1981 Trees.In; Cloning Agricultural Plants via In Vitro Techniques.(B.V.Conger,ed.)pp.217-254,CRC Press,Boca Raton Florida.
〔30〕Sommer,H.E.and C.L.Brown,1979,Application of tissue culture to forest tree improvement.In:Plant.Cell and Tissue Culture∶ Principles and ApPlications(W.R.Sharp,P.O.Larsen,E.F.Paddock,and V.Raghavan,eds.)pp.461-491,Ohio State,univ.Press,Columbus.
〔31〕Sommer,H.E.and L.S.Caldas 1981.In vitro methods applied to forest trees.In:plant Tissue Culture:Methods and Applications in Agriculture.(T.A.Thorpe,ed.)pp.349-358,Academic Press,New York.