电化学反应
出处:按学科分类—工业技术 北京工业大学出版社《特种加工手册》第429页(1096字)
7.1.1.1 电化学反应
如图7-1所示,用两块金属作为电极(阳极和阴极)浸入电解液中,接通直流电源,电极及电解液中就有电流通过,电极(金属导体)是依靠自由电子导电,电解液则是依靠离子(阳离子和阴离子)导电,所谓电极反应,指电子导电到离子导电的过渡,电化学反应时,电极反应及电解液中离子迁移必然同时发生,二者缺一不可,什么叫电化学反应呢?电解液通电后,在阳极及阴极表面发生的得失电子(下文叙述)的化学反应,称为电化学反应.
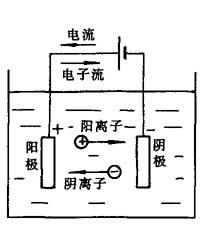
图7-1 电解液中的电化学反应
7.1.1.2 电化学加工
电解液是指含电解质(如HCl、H2SO4、NaOH、NH4OH、NaCl、NaNO3、NaClO3等)的溶液(一般用H2O为溶剂),在溶液中,电解质分离成为阳离子和阴离子,这种现象叫电离,在溶液中,阳离子所带的正电荷与阴离子所带的负电荷总数相等,且在溶液中分布均匀,所以溶液整体为中性,当通入直流电后,在电场作用下,正离子向阴极迁移,阴极表面得到电子进行还原反应,负离子向阳极迁移,阳极表面失去电子进行氧化反应,还原反应及氧化反应,即总称为电化学反应,利用电化学反应对金属进行加工,即称为电化学加工,
7.1.1.3 电解液的导电能力
为说明电解液的导电能力,现举例如下,NaCl为强电解质,它在水中几乎全部离解为氯离子及钠离子,即
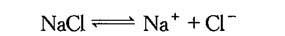
水分子也会有少量电离为氢离子及氢氧根离子,即
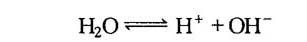
在电场作用下,正离子(Na+、H+)和负离子(Cl-、OH-)分别向阴极和阳极迁移,离子迁移传导了电荷,形成导电通道,由此可见,电解液的导电能力与离子浓度、离子运动速度及电解液的温度有关,溶液中离子数多,电场力强,溶液粘度校则电解液导电能力强,溶液温度升高,令电解液粘度下降,亦会提升电解液导电能力,由于离子质量远大于电子质量(例如氢离子质量为电子质量之1840倍),故离子运动速度远小于电子运动速度,电解液中的导电率比金属的导电率要小得多.