溶解氧的测定
出处:按学科分类—工业技术 中国轻工业出版社《皮革工业手册制革分册》第650页(6451字)
测定溶解氧可以了解水质情况,可以测定生化需氧量BOD5。一般可采用国家标准的碘量法,但制革废水污染严重,用此法时修正多,较麻烦。此时也可采用高锰酸钾碘量法。现将这两种方法介绍如下。
(一)碘量法〔13〕
1.原理
水样中溶解的氧与刚刚沉淀的二价氢氧化锰的反应。酸化后,生成的高价锰化合物将碘化物氧化游离出等物质量的碘,用硫代硫酸钠滴定法测定游离碘量。
2.试剂
(1)硫酸溶液,1∶1。
(2)硫酸溶液,c(1/2H2SO4)=2mol·L-1。
(3)碱性碘化物试剂:将35g氢氧化钠(NaOH)〔或50g氢氧化钾(KOH)〕和30g碘化钾(KI)〔或27g碘化钠(NaI)〕溶于约50mL水,再稀释至100mL,贮存在棕色细口瓶中,塞紧。
若水样中亚硝酸盐含量大于0.05mg/L,而亚铁含量不超过1mg/L时,为防止亚硝酸盐的干扰,需加叠氮化物。方法是将1g叠氮化钠(NaN3)溶于几毫升水中,与上述试剂(未稀释前)混合,再稀释至100mL。叠氮化物是剧毒试剂,操作时严防中毒。配成的碱性碘化物-叠氮化物试剂不可酸化,否则会产生有毒的叠氮酸雾。经稀释后,再行酸化。并加淀粉指示剂时,本试剂应无色。
(4)无水二价硫酸锰溶液:340g/L(或一水硫酸锰380g/L溶液,或用四水二氯化锰450g/L溶液)。如溶液浑浊需过滤。
(5)碘酸钾:c(1/6KIO3)=10mmol·L-1标准溶液。称取经180℃干燥的碘酸钾(KIO3)3.567±0.003g溶于水并稀释到1000mL。吸取此溶液100mL,在容量瓶中再稀释至1000mL。
(6)硫代硫酸钠标准滴定液:c(Na2S2O3)≈10mmol/L。将2.5g五水硫代硫酸钠溶于新煮沸冷却的水中,再加0.4g氢氧化钠,稀释至1000mL,贮于深色玻璃瓶中。使用时当天标定。
标定:在锥形瓶中用100~150mL水溶解约0.5g碘化钾或碘化钠,加入5mL2mol·L-1硫酸溶液,混匀,加20.00mL标准碘酸钾溶液,稀释至约200mL,立即用硫代硫酸钠溶液滴定释出的碘。当溶液呈浅黄色时,加淀粉指示剂溶液,再滴定至完全无色。

式中 V——硫代硫酸钠溶液滴定量(mL)。
(7)淀粉指示剂溶液:10g/L,新配制。
(8)酚酞:1g/L酒精溶液。
(9)碘:约0.005mol·L-1溶液。溶解4~5g碘化钾或碘化钠于少量水中,加约130mg碘,待碘溶解后,稀释至100mL。
(10)碘化钾或碘化钠。
3.仪器
溶解氧瓶:细口玻璃瓶,容量250~300mL,标准至1mL,具塞温克勒瓶或任何其它适合的瓶,瓶肩最好是直的。每一个瓶和盖号码相同。用称量法测定每个瓶的体积。
4.操作步骤
(1)水样的采集
通常在现场将水样直接采集在进行测定用的溶解氧瓶内,充满全瓶时避免溶解氧浓度的改变。在消除附着在玻璃瓶上的气泡之后,立即固定溶解氧。
(2)溶解氧的固定
在现场取样后,立即向盛满水样的溶解氧瓶中加1mL二价硫酸锰溶液和2mL碱性碘化物试剂。使用细尖头的移液管,将试剂加到液面以下,小心盖上塞子,避免把空气泡带入。
若用其它装置,必须小心保证水样氧含量不变。
将溶解氧瓶上下颠倒转动几次,使瓶内成分充分混合,静置沉淀最少5min,然后再重新颠倒混合,保证混合均匀。这时可以将溶解氧瓶运送至实验室。
若避光保存,样品最长贮藏24h。
(3)游离碘
确认所形成的沉淀物已沉降在溶解氧瓶下三分之一部分后,缓慢加入1.5mL 1∶1硫酸溶液,盖上瓶盖,然后摇动瓶子,要求瓶中沉淀物完全溶解,并且碘已分布均匀。
(4)滴定
将溶解氧瓶内的组分或其部分体积(V1)转移到锥形瓶中。用硫代硫酸钠滴定,在接近终点时,加淀粉溶液。
5.结果计算(结果取一位小数)

式中 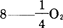 的摩尔质量(g/mo1);
的摩尔质量(g/mo1);
V1——滴定时水样的体积(mL)一般取V1=100mL;若滴定溶解氧瓶内全部水样,则V1=V0;
V2——滴定水样时耗用硫代硫酸钠溶液的体积(mL);
c——硫代硫酸钠溶液的实际浓度(mol·L-1)。

式中 V0——溶解氧瓶的体积(mL);
V′——二价硫酸锰(1mL)和碱性碘化物试剂(2mL)体积的总和(mL)。
6.特殊情况的修正法
(1)检验是否存在氧化或还原物质干扰,如果预计有氧化剂或还原剂可能干扰结果时,在前述取样测定前,先取50mL水样,加2滴酚酞溶液后,中和水样。加0.5mL稀硫酸溶液、几粒碘化钾或碘化钠(约0.5g)和几滴淀粉指示剂溶液。如果溶液呈蓝色,则有氧化物质存在。
若溶液保持无色,加0.2mL碘溶液,摇匀,放置30s。如果仍不显蓝色,则存在还原物质。
在有氧化或还原物的情况下,操作步骤4(1)取样时应采集2个水样装满二个溶解氧瓶,按以下补允操作和修正。
(2)若存在氧化性物质时,须通过滴定第二瓶水样来测定除溶解氧以外的氧化性物质的含量,以修正前述计算结果。
①步骤:将第一瓶水样按前述操作步骤4(2)、4(3)、4(4)测定溶解氧。将第二瓶水样定量转移至较大的锥形瓶内,加1.5mL1:1硫酸溶液,然后再加2mL碱性碘化物试剂和1mL二价硫酸锰溶液,放置5min。用硫代硫酸钠滴定,在快到终点时,加淀粉指示剂。
②结果计算:

式中 8,V1,V2,c和f1与前面公式中含义相同;
V3——盛第二个水样的溶解氧瓶体积(mL);
V4——滴定第二瓶水样用去的硫代硫酸钠溶液的体积(mL)。
(3)若存在还原性物质时,加入过量次氯酸钠溶液,将两瓶水样中的还原性物质都氧化后,测定第一瓶水样中的溶解氧含量,测定第二瓶水样中过剩的次氯酸钠量。
①试剂:次氯酸钠溶液——约含游离氯4g/L,用稀释市售浓次氯酸钠溶液的办法制备,用碘量法测定溶液的浓度。
②步骤:向两瓶水样中各加入1.00mL(若需要可加入更多的准确体积)次氯酸钠溶液,盖好溶解氧瓶盖,混合均匀。将第一瓶水样按照前述操作步骤4(2)、4(3)、4(4)处理,将第二瓶水样按照6(2)步骤中第二瓶水样进行。
③结果计算:

式中 8,V1,V2和c与前面含义相同;
V3和V4与7(2)公式中含义相同;
V5——加入到水样中次氯酸钠溶液的体积,(mL,通常V5=1.00mL)。

式中 V′与前面公式含义相同;
V0——盛第一瓶水样的溶解氧瓶的体积(mL)。
(4)当存在或怀疑有能固定或消耗碘的悬浮物时,用明矾将其絮凝除去,以排除其干扰。
①试剂:十二水硫酸钾铝[AlK(SO4)2·12H2O]质量分数为10%的溶液;浓氨水13mol·L-1,ρ=0.91g/mL。
②步骤:将待测水样充满容积约1000mL的具玻璃塞细口瓶中,直至溢出。用移液管在液面下加20mL硫酸钾铝溶液和4mL浓氨水,盖上细口瓶盖,将瓶颠倒摇动几次使充分混合。待沉淀物沉降后,将顶部清液虹吸至两个溶解氧瓶内。按6(1)检验氧化还原物质的存在,再按4(2)、4(3)、4(4)或6(2)或6(3)相应步骤进行测定。
③结果计算:应对絮凝处理水样体积校正。

式中 V0——用来采集水样的大细口瓶体积(mL);
V″——硫酸钾铝溶液(20mL)和浓氨水(4mL)的总体积。
(二)高锰酸钾碘量法
1.原理
在酸性条件下用高锰酸钾将水样中还原性物质氧化,过量的高锰酸钾用草酸钾还原。然后在水样中加入硫酸锰及碱性碘化钾,生成氢氧化锰沉淀,在碱性溶液中,Mn(OH)2和溶解氧结合为H2MnO3,而H2MnO3又与过量的Mn(OH)2结合为锰酸锰(MnMnO3)。在酸性溶液中,锰酸锰将碘化钾氧化,释出与溶解氧等物质量的碘,以硫代硫酸钠滴定之。
2.试剂
(1)浓硫酸:化学纯。
(2)硫酸锰溶液:称取分析纯硫酸锰(MnSO4·4H2O)480g或氯化锰(MnCl2·2H2O)400g溶于蒸馏水中,过滤后稀释成1L。
(3)碱性碘化钾溶液:称取分析纯氢氧化钠500g,溶于300~400mL蒸馏水中。称取分析纯碘化钾150g(或碘化钠135g)溶于200mL蒸馏水中。将以上两溶液混合,加蒸馏水稀释至1000mL。静置24h,使碳酸钠沉降,倾出上层澄清液备用。
(4)0.025mol·L-1Na2S2O3标准溶液:称取约6.2g化学纯硫代硫酸钠(Na2S2O3·5H2O)溶于煮沸放冷后蒸馏水中,加入0.2g无水碳酸钠防止分解,然后稀释至1L贮于棕色瓶内。静置一星期后,用分析纯重铬酸钾标定。
(5)1%淀粉溶液:称取可溶性淀粉2g,置于300mL烧杯中,加入少量蒸馏水,用玻璃棒调成糊状后,加煮沸的蒸馏水约200mL,冷却后再加入水杨酸0.25g或氯化锌0.8g,以防止其分解变质。
(6)高锰酸钾溶液:称取分析纯高锰酸钾3.16g溶于蒸馏水中,稀释至500mL。
(7)2%草酸钾溶液:称取分析纯草酸钾(K2C2O4·H2O)2g溶于蒸馏水中,稀释至100mL。1mL此溶液相当于1.1mL上述高锰酸钾溶液。
3.测定步骤
(1)取250mL溶解氧瓶或试剂瓶,用橡皮管插入瓶底部虹吸将瓶装满水样。注意不使空气进入瓶中。
(2)取下瓶塞,用吸管沿瓶口加入0.7mL浓硫酸(切勿过量)。
(3)将吸管插入瓶口液面以下加入1mL高锰酸钾溶液。
(4)盖紧瓶塞,把瓶颠倒混合3~5次,此时水样应保持淡红色。如果高锰酸钾溶液的红色迅速退尽,应再加入0.5~1.0mL,要求水样的红色保持5min以上,这样可以氧化水样中的还原物质。
(5)5min后,将吸管插入液面下,加入1.0mL草酸钾溶液,盖紧瓶塞,颠倒混匀。高锰酸钾的颜色退成很淡时,应减少草酸钾用量。
(6)静置数分钟,使水样中高锰酸钾的红色完全退尽。如未退尽可再加入0.3~0.5mL草酸钾溶液,重新混合。必要时放置15~20min才能完全退色。
(7)用吸管插入液面以下加入1mL硫酸锰溶液及3mL碱性碘化钾溶液,盖紧瓶塞。
(8)待沉淀下降至半途,再加以混合,如此重复混合2次。
(9)用吸管沿瓶口加入1mL浓硫酸,盖紧瓶塞,颠倒摇匀。1~2min后,如瓶中沉淀消失而生成黄色溶液,还需静置5min。
(10)吸取出上述水样100mL,于250mL的锥形瓶中,用0.025mol/L硫代硫酸钠标准溶液滴定至淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚消失为终点。
4.结果计算

式中 V——滴定耗用硫代硫酸钠标准溶液的体积(mL);
c——Na2S2O3标准溶液浓度(mol·L-1);
