〇盐酸舍曲林
出处:按学科分类—医药、卫生 第二军医大学出版社《新药临床应用手册二》第197页(2456字)
【别名】:左洛复
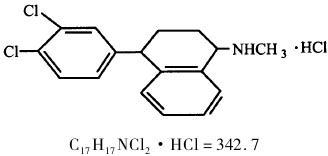
【化学名称】(IS-cis)-4-(3,4-dichlorophenyl)-1,2,3,4-tetra-hydro-N-methyl-1-naphthyalena minehydrochloride
【化学结构】
【药理作用】舍曲林在体外是神经元强效和特异的5-羟色胺再摄取抑制剂,能导致动物体内5-羟色胺效应的增强,从而产生抗抑郁作用。舍曲林对去甲肾上腺素及多巴胺的神经元再摄取仅有极轻微的影响。动物长期给予舍曲林可使脑内去甲肾上腺素受体下调,与临床其他抗抑郁药作用一致,这种作用于临床抗抑郁需长期给药这一事实,提示抗抑郁药物通过这一机制起作用。
舍曲林不增强儿茶酚胺活性,对胆碱能受体、5-羟色胺受体、多巴胺受体、肾上腺素能受体、组织胺受体、GABA受体、或苯二氮受体均没有亲和性。它在动物体内没有兴奋作用、镇静作用、抗胆碱作用或心脏毒性。
舍曲林既没有苯丙胺伴随的兴奋或焦虑,也没有阿普唑仑伴随的镇静和神经运动损伤。舍曲林既没有在功能上成为经训练后可自行摄用可卡因的恒河猴的正性增强剂,也没有作为对恒河猴的选择性刺激物而取代d-苯丙胺或苯巴比妥。
【药代动力学】在50~200 mg剂量范围内本品药代动力学特性与用药剂量成正比。在男性,本品1次/d,50~200 mg,连续用药14d后,服药4.5~8.4h后人体血药浓度达峰值(Cmax)。本品主要在肝内代谢,轻度肝硬化病人的AUC及血浆峰浓度约为正常人的3倍,肝硬化病人的清除半衰期较正常人延长,但血浆蛋白的结合率无明显差异。
【适应证】本品主要用于治疗抑郁症包括焦虑、有或无躁狂史的抑郁症、抑郁性疾病的相关症状。疗效满意后,继续服用本品可有效防止抑郁症的复发和再发。
本品也用于治疗强迫症,初始疗效后,本品在治疗强迫症2年的时间内,仍保持它的疗效性、安全性和耐受性。
【剂量与用法】成人1次/d,与食物同服或不同服均可,早或晚均可。通常治疗抑郁症和强迫症的有效剂量为50 mg/d。
少数病人疗效不佳而对药物耐受性较好时,可在几周内根据疗效逐渐增加药物剂量,每次增加50 mg,最大可增至200 mg/d,1次/d。服药7d左右可见疗效,完全的疗效则在服药的第2至4周才显效。可维持在最低有效治疗剂量。老年病人用药无需调整剂量,用药方法同上。
本品用于儿童病人的安全性和疗效资料尚不充分。在治疗年龄6~17岁的抑郁症或强迫症病人的临床试验中,显示出与成年人相似的药代动力学。
【临床评价】在一项多中心、双盲与阿米替林对比试验中,180例抑郁症病人口服本品1次/d,20~200 mg,61例服用阿米替林每次25~150 mg,2次/d。连续8周,用“汉米尔顿抑郁症量表”评价。此两种药物疗效相似。有一例53岁有冠心病史的男子在开始使用本品治疗后,心前区胸部突然疼痛。硝酸甘油治疗有效。病人病情发作时没有证实组织局部缺血的ECG变化,因此不能证实本品对心血管和ECG间期的临床影响。此外,1例意外超量服用6 g本品的病人心血管指标亦未见显着改变。推测可能是作用于胃肠道在食道部位的反应。
1例试图自杀并非精神病病人的妇女服用40片(50 mg/片)的本品1h后出现面部潮红、发怒、情绪不稳、注意力分散。采用灌胃、口服活性炭、静注镇静剂治疗后,除有水样大便外,病人恢复平静。有证据表明,本品单独过量服用高达8 g获救,并有救治成功与其他药物和/或酒精联合应用情况下几乎死亡的本品用药过量的报告。因此,应对任何用药过量给予积极治疗。过量服用本品后没有特别的解毒方法及解毒剂。首先保持气道通畅,确保充分的供氧及通气。与导泻剂合用,可能与催吐或洗胃同样甚或更为有效。再同时对症治疗及支持疗法,进行心脏及生命体征监测。由于本品分布容积大,强迫利尿、透析、血液灌注及换血疗法均没有明显意义。
【不良反应】可能引起恶心、腹泻/稀便、厌食、消化不良、震颤、眩晕、口干、失眠、嗜睡、多汗、及性功能障碍(在男性主要表现表现为射精迟缓)。偶有(大约0.8%)与舍曲林用药相伴随的无症状血清转氨酶(SGOT和SGPT)升高。这些异常通常发生于用药后的1~9周,且于停药后即可消失。曾有低血钠症的个别报道,在停药后似乎是可逆的。可能由抗利尿激素分泌失调所致。多数报告发生在老年病人及应用利尿剂或其他治疗的病人。
在使用本品的病人中曾偶有血小板功能改变。发生出血或紫癜的报告,尚不清楚是否由舍曲林引起的。
【注意事项】本品有增加中枢神经毒性的危险,禁与单胺氧化酶抑制剂同服;停用单胺氧化酶抑制剂至少2周后方可服用本品,同样停用本品至少2周后方可服用单胺氧化酶抑制剂。
对本品过敏者禁用。
【制剂规格】片剂:每片含本品50 mg。
【生产厂家】美国辉瑞制药有限公司。中国大连辉瑞制药公司。