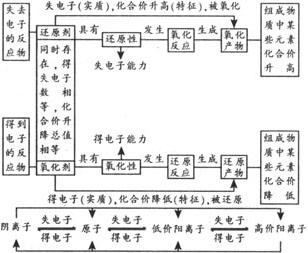
氧化性,还原性的强弱判断方法
出处:按学科分类—文体、科学、教育 商务印书馆国际有限公司《高中数理化公式定理大全》第344页(1625字)
氧化性,还原性的强弱取决于得失电子的难易,而与得失电子的数目无关.
1.根据方程式判断:
氧化剂+还原剂→还原产物+氧化产物
则:氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物.
2.依据金属活动性顺序表
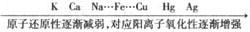
非金属活动性顺序(常见元素)
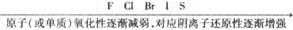
3.根据反应条件判断:
当不同的氧化剂作用于同一还原剂时如氧化产物价态相同,可根据反应条件的难易来进行判断.例如:
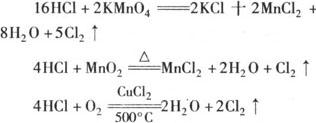
氧化性:KMnO4>MnO2>O2.
4.根据氧化产物的价态高低判断:
当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱.
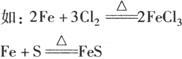
可以判断氧化性:Cl2>S.
5.根据元素周期表判断:
(1)同主族元素(从上到下)

(2)同周期主族元素(从左到右)

阳离子氧化性逐渐增强,阴离子还原性逐渐减弱
6.根据元素最高价氧化物的水化物酸碱性强弱比较:
例如:酸性:HClO4>H2SO4>H3PO4>H2CO3,可判断氧化性:Cl>S>P>C.
7.根据原电池、电解池的电极反应比较
(1)两种不同的金属构成原电池的两极.负极金属是电子流出的极,正极金属是电子流入的极.其还原性:负极>正极.
(2)用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性强,在阳极先放电的阴离子的还原性较强.
8.根据物质的浓度大小比较
具有氧化性(或还原性)的物质的浓度越大,其氧化性(或还原性)越强,反之,其氧化性(或还原性)越弱.如:氧化性:HNO3(浓)>HNO3(稀).
9.依据反应中能量变化判断
H2+X2=2HX;△H1.
H2+Y2=2HY;△H2.
若△H1<△H2,则X2的氧化性比Y2强,
X—的还原性比Y—的还原性弱.
氧化还原反应有关概念的联系和区别: