金属的腐蚀和防护
出处:按学科分类—文体、科学、教育 商务印书馆国际有限公司《高中数理化公式定理大全》第414页(1391字)
1.金属腐蚀的概念:
金属的腐蚀指金属合金周围接触到气体或液体进行化学反应而腐蚀损耗的过程.
2.金属腐蚀的本质
金属腐蚀的本质,是金属原子失去电子变成阳离子的过程.也就是说,金属腐蚀的本质是金属发生了氧化反应.
3.金属腐蚀的类型
由于与金属接触的介质不同,发生腐蚀的情况也不同,一般可分为化学腐蚀和电化学腐蚀.
(1)化学腐蚀与电化腐蚀的比较
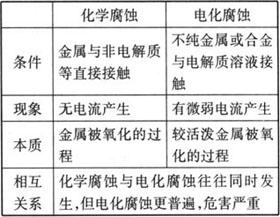
注 电化腐蚀是造成钢铁腐蚀的主要原因.
(2)金属腐蚀快慢的判断:
①电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀.
②同种金属的腐蚀在强电解质中>弱电解质中>非电解质中.
③O2的浓度越大,腐蚀越快.
(3)金属的防护
金属防护的方法很多,例如可以根据不同的用途选用不同的金属或非金属制成合金,以防止腐蚀,如不锈钢就是一种耐腐蚀的合金;也可以采用喷油漆、涂油脂、电镀、喷镀或表面钝化等方法使金属与介质隔离,以防止腐蚀;还可以采用电化学保护法防止金属腐蚀等.
例 (2004·江苏·16)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(1)=Zn(OH)2(s)+Mn2O3(s).
下列说法错误的是( ).
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
解析 从电池总反应式Zn(s)+2MnO2(s)+H2O(1)=Zn(OH)2(s)+Mn2O3(s)可以确定Zn为负极,电子从负极流出经外电路流向正极.当外电路中每通过0.2mol电子,参加反应的锌理论上为0.1mol,质量减小6.5g.
答 C.