厌氧药敏试验主要方法
出处:按学科分类—医药、卫生 中国科学技术出版社《临床厌氧菌检验手册》第75页(7034字)
(一)琼脂扩散法——KB法
1.菌株接种 挑4~5个菌落接种于胰酶水解酪蛋白植胨肉汤或GAM液体培养基内,37℃厌氧培养48h,或于平板培养基内接种。
2.用于药敏的菌株制备
(1)用于药敏的菌液浓度为1.5~3.0亿/ml。
(2)可用硫酸钡比浊法比浊,决定菌液浓度,硫酸钡比浊管用前振摇10~12次(或用紫外分光光度计测定菌浓度)。
(3)液体培养基用灭菌生理盐水稀释制备浓菌液,固体培养基就直接用灭菌生理盐水制成浓菌液。
3.WC平板或GAM平板培养基接种 将灭菌的棉棒沾菌溶液,于壁上挤除多余的液体,在WC平板培养基上涂布并沿平皿边缘环扫一圈,盖好平皿干燥2~3分钟。
4.抗生素纸片的贴放
(1)从抗生素纸片中相间每24~30mm距离放一纸片。
(2)纸片外缘距平皿外缘约15~20mm。
(3)纸片轻压贴紧。
(4)所有操作必须在10分钟内完成,立即置37℃厌氧培养,48小时后观察结果(生长缓慢的厌氧菌可在96小时后观察结果)。
5.测量抑菌环直径 用双角规和透明尺测量抑菌环(包括纸片直径)直径(D)。
6.判断 参阅表2-3判断
表2-3 常见抑菌浓度和质控参考资料
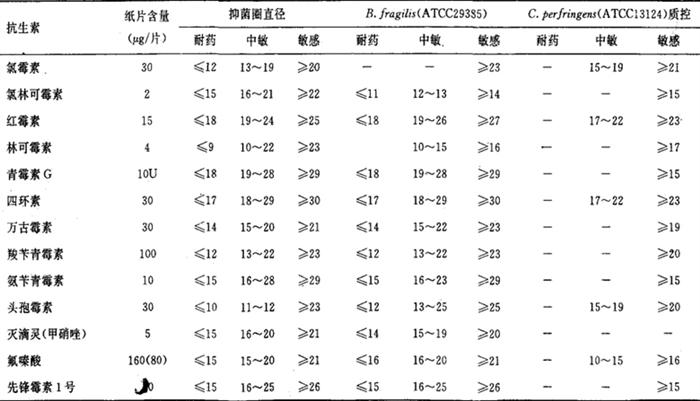
7.干燥纸片的含药浓度及其制备
(1)选择优抽新华1号滤纸制成直径为6mm的圆纸片。每200张一管,经干烤120℃2小时灭菌,保存备用。
(2)纸片内抗菌药物含量参考表2-3。
8.K-B方法回归曲线的绘制(以氯霉素要求为例) 将被测菌株的MIC转换成log2MIC对数值(双倍稀释法)和相对应的纸片法所得抑菌圈直径一对一对地点在坐标纸上,将数据作统计学上的相关回归分析,得截距a=6.49,斜率b=-0.22,相关系数γ=-0.76。MIC与抑制环直径呈负相关关系,即MIC愈小,抑菌环愈大,P<0.05,将此数据代入回归方程Y=a+bx,并做出代表此方程的回归线(图2-1)。
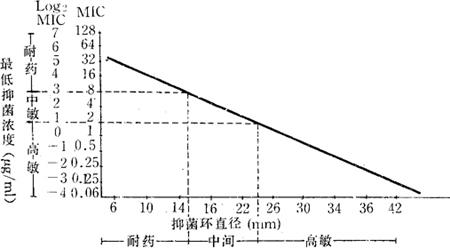
图2-1 氯霉素标准曲线(纸片浓度30μg/ml张)
9.细菌对氯霉素的敏感和耐药标准的划分 见表2-4。
表2-4 细菌对氯霉紊的敏感和耐药标准
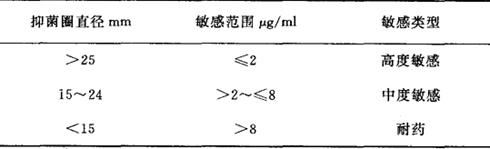
10.敏感度划分的临床意义
(1)高度敏感:当一种细菌引起的感染用某种药常用量治疗有效,这种细菌就对该药高度敏感,即常规用药时达到的平均血浓度超过对细菌MIC的5倍以上。
(2)中度敏感:当细菌引起的感染仅在应用高剂量抗菌药物时才有效,或者细菌处于体内抗菌浓度浓缩的体液(如尿、胆汁)才被抑制,这种细菌对该药呈中度敏感。常规用药其血液药物浓度一般相当于或略高于细菌的MIC。
(3)耐药:药物对某一种细菌的MIC高于药物在血液或体液中可能达到的浓度。
11.纸片法的质量控制 可用标准菌株,如脆弱类杆菌(B.fragilis ATCC 28285)、多形类杆菌(B.thetaiotaomicron ATCC 29741)、产气荚膜梭菌(C.perfringens ATCC 13124)进行质量控制。
(二)国际厌氧菌药敏标准方法(1986)(限量琼脂稀释法)
目前厌氧菌药敏标准方法据美国临床检查标准委员会(NCCIS)和日本化学疗法(JCAM)方案拟定的限量琼脂稀释法进行的,分为简易判断法和常规琼脂稀释法两大类。
1.抗生素的稀释和原液的制备
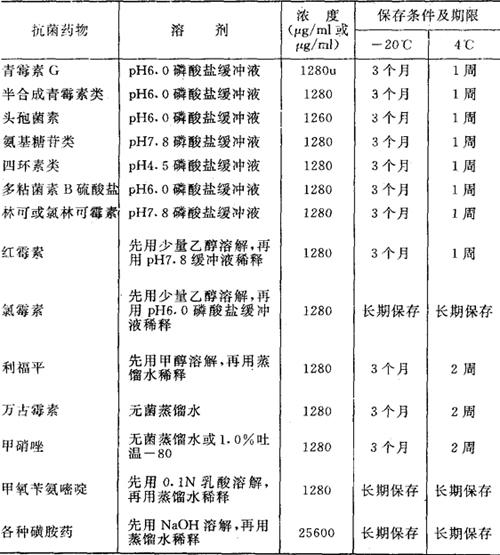
(1)抗生素稀释所使用溶剂制备成原液,其浓度、保存条件和期限列于表2-5中。
表2-5 抗菌药物原液的配制和保存期限
(2)抗生素稀释一般采用对倍稀释法,稀释范围确定可由表2-6资料提供参考。
表2-6 抗生素选择稀释浓度参考表常选择稀释浓度(μg/ml)

(3)简易法是做一高浓度和一低浓度2块平板培养基或用纸片,大致可以确定其小抑菌浓度(minimal inhibitory Concentration即MIC)和最小杀菌浓度(minimal bactericidal concentration即MBC),见表2-7。
表2-7 简易法常选择的药物浓度
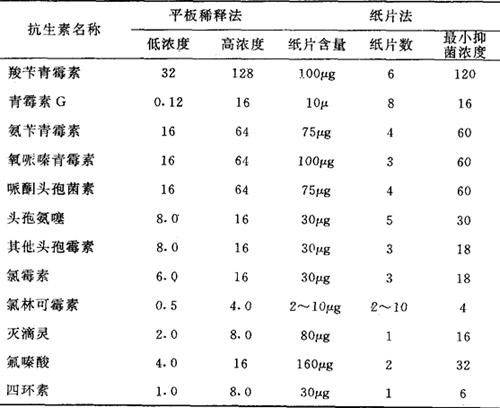
注:药物浓度为ug/ml或u/ml,其他头孢霉素包括噻吩(钠)、唑啉、羟唑等。
2.药物平板的制备
(1)取各种稀释度的抗生素10ml,冷却至50℃左右加于90ml培养基中,混匀后倾注平板,即为含不同药物梯度的平板培养基(百倍稀释)。
(2)抗生素原液为2560μg/ml,对倍稀释法分别为1280,640,320,160,80……,然后分别取2ml加WC固体培养基(<50℃)倒平板,则平板含量分别为:128、64、32、16、8、4、2、1、0、50、25、0.125、0.0625(μg/ml),根据表2-5选适当浓度倒平板,即为不同稀释度的药物平板培养基。
3.菌液制备 从GAM平板的48小时培养物上刮菌,以布氏肉汤或BHI汤制备成1.5~3亿/ml(Mcfarland)标准浓度,10倍稀释,最后使用浓度为105~106/ml。
4.接种 用1mm接种环取一满环105~106/ml菌液,或1.5~3.0×108ml菌液取0.001~0.003ml。接种于一种抗生素某种浓度药物平板上,9cm平板培养基可接种4~8株,12cm可接种8~16株,按照划线2cm左右,10分钟处理毕,置厌氧培养37℃,48小时观察结果。
5.结果判断
(1)简易法:按下法判断。

(2)普通法:在平板培养基上不生长的为MIC(如32μg/ml不生长,其以上浓度为64、128…),再从以上浓度的平板培养基表面刮菌至布氏肉汤或BHI肉汤中,37℃厌氧培养48小时,再转种到WC或GAM平板基上,如64μg/ml平板上仍无菌生长,此浓度为该药品对某菌的MBC。
(三)试管法
试管稀释法是以BHI或布氏汤培养基,加入抗生素标准贮存液后,做不同浓度稀释,然后定量地接种待检菌株液,以确定某药物对待检菌株的MIC和MBC的方法。
1.抗生素标准分剂用量的计算
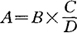
式中各字母表示:A为应称量标准粉剂毫克数;B为稀释剂的毫升数(即为容量瓶的毫升数);C为贮存液浓度(一般为1000μg/ml);D为标准粉的有效力。
例:灭滴灵标准粉的有效力D=1mg=755μg
若用25ml容量瓶(即B),配制最终浓度为2560μg/ml的贮存液(即C),应称量标准粉剂为
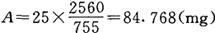
2.抗生素的稀释 一般以对倍稀释法从第一管到第九管,第十管为空白对照管。例:称量上述灭菌灵84.768mg于25ml容量瓶中,即抗生素贮存液浓度为2560μg/ml,按表第一管取64μg/ml,则各管抗生素浓度为(μg/ml)
1 2 3 4 5 6 7 8 9 10
64 32 16 8 4 2 1 0.5 0.25 空白
3.菌液的制备 将培养好的特检菌株和对照已知菌株制备成107~108/ml菌液。
4.接种 在9.9ml的各抗生素浓度试管中加入107~108/ml菌液0.1ml,第一排管接种待检菌,第二排接种对照菌液,最后菌浓度为105~106ml。
所有操作在厌氧环境中进行,或大气中15分钟内接种毕。
5.培养 在37℃,48小时的厌氧培养。
6.培养判断
(1)含抗生素浓度最小而肉眼见无细菌生长的稀释度为MIC。
例如:上述第四管无菌生长(清晰、无颗粒、无沉淀),则灭滴灵对待检菌株的MIC为8μg/ml。
(2)从肉眼观察无菌管(即MIC)包括以上几个浓度,挑液接种GAM或WC血平板,厌氧培养37℃,48小时后,平板培养基上无菌生长的浓度为某药物对待检菌株的MBC。
例如:上述第四管(8μg/ml)、第三管(16μg/ml)、第二管(32μg/ml)及第一管(64μg/ml)中,用接种环沾菌液接种到GAM血平板上,从第三管以后无菌生长,则灭滴灵对待检菌株的MBC为16μg/ml。
(四)微量法
微量法类同于试管稀释法,只是剂量改变而已,具体方法如下。
(1)用灭菌的96孔或24孔V型孔塑板,每孔先加抗生素液,第一孔根据表2-6选择加入某抗生素浓度,以下将对倍稀释法稀释的呈递减浓度抗生素加入,每孔0.5~0.1ml至第八孔上。
(2)将配好的菌液浓度为105~106CFU/ml也依次加入各孔,每孔加入0.05~0.1ml,从第一孔加至第九孔。
(3)第九孔加入菌液后,再加布氏肉汤或BHI汤0.05~0.1ml,不加抗生素液,第十孔只加抗生素液后,再加布氏内汤或BHI0.05~0.1ml(不加菌液),此两孔作为对照。所加液体以限制溢出为准。
(4)厌氧培养37℃、48小时,观察孔中无生长者为MIC。
(5)从不生长微孔中取液体接种到GAM血平板上,不生长者为MBC。
(五)联合敏感试验
该试验是为了测定某种药物或某种因素(如培养基成分、pH等)对另一种药物的抗菌效果的影响,即两种药物是否拮抗、协同或无关?或是为了提高药物的抗菌效力。减少用药剂量,避免不良反应,防止或延迟耐药菌株的产生。选择有效的抗菌药物联合使用等一些特殊需要,而进行联合敏感试验,方法有纸片法、纸条交叉法、简化试管法等等。在此介绍两种。
1.纸片法 方法与KB法类似,只是所贴I纸片的距离屡2~3mm,同样必须37℃、48小时的厌氧培养后判断结果。
(1)协同作用:①甲乙两种抑菌区交界角平直;②甲药不敏感,乙药抑菌区向甲药扩大;③无抑菌作用的两药出现了抑菌区。
(2)相加作用:甲、乙两药抑制区交界角钝圆。
(3)无关作用:①细菌对两药都耐受;②细菌对甲药耐受,而对乙药敏感,抑制区交界角尖锐;③细菌对两药都敏感,抑菌区交界角尖锐。
(4)拮抗作用:①细菌对甲药耐受,对乙药敏感,甲药对乙药抑制区呈切割状;②细菌对两药均敏感,乙药使甲药的抑菌偏圆形状。
2.纸条法 在已接种试验菌的平板基表面垂直2条各浸有一种药液的滤纸条,48小时厌氧培养后,根据2种药液抑菌区的加强、减弱或无影响,来判断它们在联合应用时是协同、抵抗或无关。
(1)两者无关(AB两种药物):
①A敏感,B不敏感,直线相交。
②A敏感,B也敏感,互不影响。
(2)两者拮抗:
①A敏感,B耐药,使A抑菌圈呈弧形。
②A敏感,B也敏感,使两抑菌圈呈弧形。
(3)两者协同:
①A敏感,B虽耐药,但B抑菌圈呈锥形。
②A敏感,B也敏感,形成花瓶形。
3.小数抑菌浓度指数的测定 小数抑菌浓度(fraction inhibitory concentration即FIC)

FIC指数<1,表示2药有协同。FIC<0.5时,有明显的协同作用。
4.棋盘格法(Checkboard test)
(1)分别以连续稀释法稀释A、B二药备用。
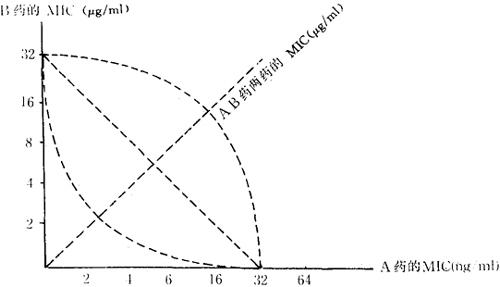
图2-2 以FIC求AB药的MIC
(2)列三排稀释,第一排为A药系列,第二排为B药系列,第三排含不同浓度的A及B药。
(3)各孔加入105~106/ml菌液0.1~0.5ml,即等量的试验菌液。
(4)求A药的MIC(或MLC,minimal lethal concentration,即最小致死浓度),B药的MIC(或MLC)和A、B药的MIC,连线作图判断,或求FIC指数来判断联合试验结果。
药物抗菌试验的影响因素包括:①试验菌,最好采用临床新分离菌株,控制菌浓度为105~106/ml,接种量控制在0.1ml以内。②培养基,以WC或GAM培养基为准,pH控制在7.2左右。③抗菌药物,注意完全溶解和精确配制,注意中药中含鞣酸和色泽会影响透明度。