麻风杆菌活力判定的意义和方法
出处:按学科分类—医药、卫生 科学普及出版社《麻风病实验室工作手册》第23页(4754字)
由于ML体外培养尚未成功,研究ML活力的判定法不得不以活组织菌悬液来进行。由于测定ML活力在临床实践和理论研究中都有重要意义,这方面的研究颇多。简单、快速、可靠的ML活力测定方法可用以判断疗效、测定菌的感染力、进行药物敏感试验、发现耐药菌株、筛选与评价新的有效抗麻风药物,乃至探讨ML的感染与传播途径等。
一、形态指数法:
尽管形态指数(简称MI)这一指标已广泛应用于临床和实验研究,但一直存在着争论。主要是各家的研究结果不完全一致。许多人发现MI为“0”的菌悬液接种小鼠足垫后能获得正常的生长繁殖曲线。相反,完整菌却有不能生长繁殖者;还有一种现象是ML在体内高速增殖时失去抗酸性。体外培养过程中有人亦看到有一个无抗酸性的阶段,而且能从无抗酸性转变到有抗酸性。这些例证说明单靠抗酸染色后显示的形态完整与否来判断菌的死活和有无感染力是不太可靠的,尤其近年来ATP法、FDA/EB法(见本节)与MI法的比较结果更支持上述的结论。但多年的实践表明虽单靠MI不能判定ML有无感染力,但如果在同一个体建立了基础线,MI在判断疗效和科研工作中还是有一定价值的。特别是在不能开展小鼠足垫接种和用ATP法、FDA/EB法测定ML活力的地方,运用MI判断疗效和筛选抗麻风药物还是一个有用的方法。若单凭细菌指数(简称BI,见第二章),由于检查周期太长,是相当费时间的,特别在抗麻风药物的筛选方面。图1-6的结果,提示MI的可用性。
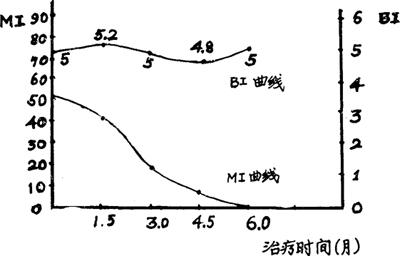
图1-6 BI、MI与治疗时间的关系
二、小鼠足垫接种法(见第四章)
此法可靠,但方法要求苛刻、复杂和耗时过长,不适宜大规模应用。但为比较和评价新建立的方法还是相当有用的。鉴于目前尚无理想的方法,小鼠足垫接种法在判定ML活力、测定耐药菌株、进行药物敏感试验及筛选抗麻风药物、鉴定ML等方面应用比较广泛。
三、ATP含量测定法
本法由Dhople于1973年移植应用于ML的活力测定。
(一)原理
在有生命的生物体中,由于生物活体能的作用而产生的发光现象称为生物发光。荧火虫发光素(firefly luciferin)和发光素酶(luciferase)在ATP、Mg++及02存在的条件下可以发光。其反应如下:
E+LH2+ATP→E·LH·AMP+PPi
E·LH·AMP+O2→oxyluciferin+CO2
+AMP+光(λ=562纳米)
式中E为发光素酶,LH2为发光素,PPi为焦磷酸,oxyluciferin为氧化发光素即发光体。由于ATP是细胞(包括细菌)代谢中普遍必需的代谢产物,比其它代谢物的浓度高,均匀地分布于细菌原生质中,容易提取,而且转换率快和在死细胞(菌)中迅速消失,故可用于观察细胞(菌)的活力、长势和做为活菌计数的指标。
(二)方法
1.试剂及其配制
(1)0.05M磷酸盐缓冲液(PBS,pH7.0):
NaH2PO460克加水1000毫升(0.5M),溶后称为A液;Na2HPO471克加水1000毫升(0.5M),溶后称为B液;用时取A液3.9毫升,B液6.1毫升加水90毫升混匀得100毫升0.05MPBS。
(2)1NNaOH:4克NaOH加H2O100毫升溶后即成。
(3)1N盐酸:1毫升浓盐酸(12N)加水11毫升混匀即成。
(4)酶混合物:0.2克胰酶,0.2克糜蛋白酶,0.2克胶原酶,加水10毫升,混溶即成。
(5)ATP酶:8.5克ATP酶,0.025克CaCl2加100毫升水。
(6)0.05MTris缓冲液(pH7.7):6.05克Tris,1.22克MgSO4,100毫升水,溶后较正pH至7.7。
(7)ATP标准液:10PG/0.1毫升(母液1毫克/毫升)。
(8)ATP底物:Dupont ATP试盒。1瓶加水3毫升,加结晶荧火虫素1.5毫克。
(9)TritonX-100。
2.测定程序
(1)0.5克含麻风杆菌组织加2.5毫升PBS,将之制成匀浆。
(2)以200×G,离心5分钟,弃沉淀,留上清备用(菌悬液)。
(3)1毫升菌悬液加1毫升1NNaOH,混合。37℃保温20分钟,加1毫升1N盐酸,混合。以3000×G离心20分钟,留沉淀,加5毫升PBS,混合,再以3000×G离心20分钟。
(4)留沉淀加2毫升PBS和0.1毫升酶混合物,混合,室温静置20分钟。
(5)以3000×G,离心20分钟,留沉淀和加5毫升PBS,混合,3000×G离心20分钟。
(6)沉淀加5毫升PBS,加0.005毫升TritonX-100,混合,候10分钟加0.1毫升ATP酶溶液,混合,候10分钟。
(7)以3000×G离心20分钟。
(8)沉淀加0.5毫升PBS混合,取0.1毫升计数液。取0.4毫升作ATP测定。
(9)0.4毫升菌悬液加0.6毫升PBS,混合,以3000×G离心20分钟。沉淀加0.1毫升Tris缓冲液,旋涡振荡混合20秒钟,加0.03毫升氯仿,再旋涡振荡混合20秒钟。
(10)置试管于沸水浴中10分钟,最后1分钟真空干燥提取物。
(11)提取物加0.4毫升Tris缓冲液。
(12)取上液0.1毫升加至含有0.1毫升ATP底物的比色杯中。
(13)测定曲线的峰值与标准ATP(10PG)的结果对比。
此法可进行定量测定,并迅速可靠,但需大量的菌和复杂的设备。目前正研究将此法用于判断临床治疗效果、测定单菌的活力和将它推荐作为筛选抗麻风药物的方法。还有人主张此方法可做为ML的一种鉴定方法(因不同种菌的ATP含量不同)。Dhople实验室已将之列为ML的鉴定常规。此外,许多学者用此方法与MI、FDA/EB等活力测定方法进行对比和评价,并扩大应用于其它分枝杆菌和细菌的活力的测定中,具有很大的应用潜力。
四、FDA/EB染色法
本法是Kvach等人1984年移植应用于ML活力测定的。
(一)原理:Rotman和Papermaster早在1966年就发现荧光素乙酰乙酸酯(fluorescein diacetate,FDA)可用于测定哺乳动物细胞的活力。FDA本身无荧光效应,是一种无极性的小分子量的酯类,能迅速渗入细胞内,当被活细胞内的酯酶水解后成为有极性的游离荧光素复合物,且不易从完整细胞膜内排出,因而蓄积在细胞内,以致在紫外线激发后产生绿色的荧光,使细胞呈绿染。如果是死细胞,虽FDA进入细胞但因不能被酯酶水解成有极性的荧光素复合物,故不能在细胞内蓄积,经紫外线激发亦不能使细胞呈绿染。1970年Edidin提出用溴乙啡啶(ethidium bromide,EB)染色以观察死亡或损伤的细胞由于EB只能渗入细胞膜受损伤的死细胞,而不能渗入细胞膜完整的活细胞,当EB进入死细胞后与胞核DNA结成复合物,在紫外线激发下产生桔红色。联合使用FDA与EB就构成了细胞双染色法。在荧光镜下可同时看到活的绿染细胞和死的桔红染细胞,死活分明,易于鉴别。
(二)方法
1.FDA/EB染液的配制
FDA贮存液:将100毫克FDA溶于20毫升丙酮中,终浓度为5毫克/毫升。按1毫升分装,避光保存于-20℃,活性可维持2年以上。
EB贮存液:溶20毫克EB于10毫升Hanks平衡盐水中(pH7.4),终浓度为2毫克/毫升。按1毫升分装,避光贮于-20℃,活性亦可维持2年以上。
FDA/EB染液(现用现配):将FDA贮液1毫升用丙酮做1:10稀释,得终浓度为500微克/毫升的FDA液,贮于-20℃其活性可维持6个月。用时,取此FDA液0.02毫升加0.1MPBS(pH7.2)至5毫升,得终浓度为2微克/毫升的FDA应用液。取0.01毫升EB液加至FDA应用液5毫升中(其终浓度为4微克/毫升)则得FDA/EB工作液,避光放置待用。
2.ML活力测定
人组织悬液:用钻孔法取瘤型病人皮肤活检,制成悬液,取10微升于载片上制成直径1厘米的菌膜,于空气中干燥后,加FDA/EB液染色。在荧光显微镜下判定绿染的百分数。
犰狳和鼠足垫组织悬液:犰狳组织含菌较多,鼠足垫组织含菌较少,视计数结果可制适宜浓度的菌悬液,按上法测定菌的活力。
以上方法简单易行、快速,菌量足够时用皮肤刮液涂片也可直接染色,但菌太少时不易判别。本法目前除探索应用于ML活力测定、抗麻风药物筛选(与测定巨噬细胞表面FC受体相结合)、疗效判定外,还有人用来研究伊蚊叮吸瘤型患者血液后其消化道中ML的存活时间,并发现蚊虫叮吸血中的ML很快出现红染(失去活力),故认为通过蚊虫叮咬将ML传播给人的可能性很小。