麻风病免疫病理
出处:按学科分类—医药、卫生 科学普及出版社《麻风病实验室工作手册》第116页(8062字)
一、麻风免疫病理概况
麻风菌引起的病理变化都是免疫反应,所以从广义上说整个麻风病理学,都在免疫病理的范畴内。但目前所指的免疫病理是狭义的,仅指用近代免疫学方法研究病理的情况。随着方法学的进展,免疫病理检查的内容和重点在不断地更新和深入。麻风免疫病理方面目前已开展的有以下几个方面:
(一)麻风损害中麻风菌抗原的检测
用抗卡介苗抗体检测组织切片内人ML的交叉抗原,再用辣根过氧化酶标记的第二抗体和底物来显示。也可采用PAP法。此法可使损害中完整或不完整的麻风菌都受染,阳性率高,但特异性差。这样特别是使一部分用抗酸染色查不到菌的结核样型和未定类麻风也可能证明抗酸菌抗原的存在,这有助于麻风病的诊断和疗效观察,目前进一步用特异性的麻风抗原单克隆抗体(McAb)MLO4,MLO6,分别检测麻风皮损冰冻切片中的特异性抗原MY2a和MY1a。也用过氧化酶标记的抗体和底物来显示。它可显示附着在浸润细胞表面的抗原,却不能使完整的麻风菌着色。可能因为它显示的是菌浆抗原的缘故。
(二)麻风损害内免疫活性物质的测定
用直接免疫荧光法在ENL皮损中发现有免疫球蛋白和补体沉积于血管周围。Ridley等发现ENL时只有一半病人有血管病变,严重时才有IgM、IgG和C3沉积。ENL时的免疫复合物分布在巨噬细胞周围,IgM在变性巨噬细胞中,IgG在中性白细胞内,从而认为ENL时免疫复合物是从组织到血管,而不是从血管到组织。活动性的或发生麻风反应的瘤型病人肾小球毛细血管壁上也可有免疫球蛋白及补体沉积。皮肤中沉积的免疫球蛋白以IgM为主,其次为IgG。
曾发现有的瘤型麻风皮损的真皮-表皮交界处显示带状免疫球蛋白荧光。
Ridley等测得皮损中,TT型IgG、IgM沉积的程度几乎与LL型一样高,BT和BB则低。
此外,对补体C4、C1q、C3d、溶菌酶、纤维蛋白溶酶元、低密度β脂蛋白、纤维结合素(fibronectin)、CRP、SAP、α-抗胰酶和α-抗巨球蛋白等均做过一些观察。
(三)麻风损害中免疫活性细胞的检测
免疫活性细胞的检测是当前免疫病理研究的重点。最早Ridley等(1978)用自然花瓣形成的方法(E、EA、EAC)来鉴别麻风皮损中的T、B淋巴细胞以及巨噬细胞。
目前常用的与人类淋巴细胞起反应的相应的McAb,见表3-5。
表3-5 与人类淋巴细胞起反应的McAb

表中“组标志(CD)”是近年来国际上重新修订简化了这些细胞表面标记的命各。OKT是美国Ortho公司提供的系列McAb产品。Leu是美国Becfon Dickinson公司制备的系列McAb。除此外还有Lyt等系列McAb以及许多其它实验室制备的多种McAb。除上表所列外,OKT6可用于识别具有Ia抗原的细胞,包括朗格罕细胞(Langerhans cell),OKTM1识别人单核细胞及无效应细胞,H-NK识别杀伤性T细胞。
上述一些单克隆已用于检测麻风损害中的各种免疫活性细胞,尤其在集中研究淋巴细胞亚群。这方面主要的较为一致的发现是结核样型麻风肉芽肿内TH占优势,而且TH分布特征在于围绕着上皮样细胞肉芽肿。瘤型肉芽肿内以Ts占优势,这是因为瘤型麻风肉芽肿内TH的绝对数与相对数均减少,在T型端TH渐增,而Ts的绝对数在各型麻风损害内均无不同的缘故。Ts与巨噬细胞混合存在。Th/Ts值,T型高,为2~4不等;L型无ENL者<1,发生ENL时Th增加则>1。有人测Th的绝对值,在皮损中T型为1400/平方毫米;L型为200/平方毫米。表皮内的朗格罕氏细胞(OKT6+),T型增高,瘤型减少,但这方面结果尚不一致。与病期也有一定关系。产生白细胞介素2(IL-2)的细胞,T型较多,L型减少。ENL时,IL-2细胞增加,表皮中白细胞介素2受体(IL-2R)也增多。近年来更进一步研究各型麻风损害内CD4和CD8阳性细胞内的不同亚群的百分比。这些对研究麻风病免疫调节机制具有重要意义。
(四)其它方面的研究
1.近年来有人用间接免疫荧光或酶标记的方法测定麻风病人血清内抗神经抗体,用正常神经切片作靶抗原,显示高百分比麻风病人血清中存在抗神经抗体,能与正常神经轴索结合。
2.已知用抗S-100蛋白的McAb,结合过氧化酶技术可证实起源于神经脊的组织。用此原理可以在石腊切片中观察到麻风损害中被破坏了的雪旺氏细胞残迹。此法有助于麻风性结核样肉芽肿的鉴别诊断。
3.Boddingius先用动物制备各种抗麻风药物的抗体,再用免疫病理、免疫电镜等方法并结合激光显微探针分析(AMMA)显示神经、肝、脾内抗麻风药物沉积情况。结果发现,给正常小鼠投予几种抗麻风药物数月后,神经内药物很少,甚至有的药物呈阴性。
4.Tausk等用McAb的放射免疫测定法测定红细胞表面C3b受体(CRI)的情况。结果观察到L型病例红细胞表面的C3b明显减少,平均每一个红细胞具有310个受体,而T型平均为577个,对照组平均为512个。说明L型病人清除血清中免疫复合物的功能降低。
二、免疫病理方法
抗原与相应的抗体接触后,立即结合形成不易分离的抗原抗体复合物,在结合之前如先使抗体(或抗原)与某种显色剂,如荧光素、过氧化物酶等标记,形成的抗原抗体复合物则由不可见成为可见,从而可以确定组织中是否存在某种抗原(或抗体),这就是免疫病理技术的基本原理。用模式图表示如图3-1。
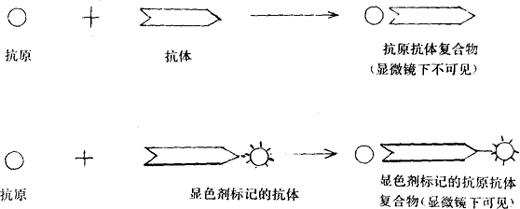
图3-1 抗原和抗体,显色剂标记的抗体结合模式
根据抗体(或抗原)标记物的不同,免疫病理研究方法分为两类,即免疫荧光技术和免疫酶标技术。现分别叙述如下:
(一)免疫荧光技术
免疫荧光技术(immunofluorescent technique,IFT)也称荧光抗体技术(fluorescent antibody technique,EAT),其原理是将荧光色素,特别是常用的异硫氰酸荧光黄(fluorescein isothiocyanate简称FITC)与某些特异性抗体(或抗原,但少用)以化学的方法结合起来,但不影响该血清抗体的免疫特性,而后将荧光标记了的抗体,作为一种试剂,在特定的条件下浸染标本,使之与标本中相应的抗原产生结合反应,结果产生含有荧光标记的抗体——抗原复合物,可用荧光显微镜来观察之。在镜下见到有特异荧光存在即表示有抗原抗体复合物的存在。根据已知的抗体(或抗原)即可推知未知抗体(或抗原)的存在。常用的有直接荧光抗体法和间接荧光抗体法。
1.直接荧光抗体法是最简单、最基本的方法,利用荧光色素标记的特异性抗体直接与相应的抗原结合,以鉴定未知抗原。优点:(1)方法简单,需时短;(2)特异性高。缺点:(1)不能用已知抗原检查未知抗体;(2)为了检查各种抗原,则要准备多种特异性荧光抗体;(3)敏感性较差。
2.间接荧光抗体法用荧光色素标记的抗球蛋白抗体,鉴定未知抗原或未知抗体。染色程序分两步,第一步,用已知未标记抗体(第一抗体)加到未知抗原上,或用未标抗体加到已知抗原上,一定时间后,洗脱掉未结合的抗体。第二步,加上标记的抗球蛋白抗体(第二抗体),如果第一步发生了抗原抗体反应,这个抗球蛋白抗体就会和已结合的抗体发生结合,从而推知抗原或抗体的存在。第一抗体对第二抗体来说是其抗原。因此,间接荧光抗体法又称双抗体法。优点:(1)能检查未知抗原和抗体;(2)用一种标记的抗球蛋白抗体,能检查多种以球蛋白作抗体的复合物;(3)敏感性较高,通常比直接法高5~10倍。缺点有:(1)由于参加的因素多,受干扰的机会也多,故判断结果有时较困难;(2)试验方法较麻烦,需要的对照多,所用时间也较长。
免疫荧光法虽然具有荧光素容易与抗体结合、操作简便、观察方便等优点,但其缺点有:(1)标记的荧光极易褪色,不能长久保存;(2)影响荧光强度的因素很多,而且判断阳性荧光与非特异性荧光有一定的主观性;(3)阳性荧光细胞无法与常规石蜡切片对照观察,组织学定位困维;(4)需要较好的设备如冰冻切片和荧光显微镜等。因此,它的应用受到一定的限制。
(二)免疫酶技术
此法是用酶,主要是过氧化物酶,代替荧光素来标记抗体,用3.3′-二氨基联苯胺(DAB)或3-氨基-9-乙基咔吧唑(AEC)与H2O2显示过氧化物酶的活性部位,其反应产物前者为棕黑色,后者为棕红色沉淀,用普通显微镜便能观察,颜色不易消退,标本可长期保存。免疫酶技术有直接法→间接法→桥法→单PAP→双PAP和ABC法等。
1.直接法 先将酶(常用辣根过氧化物酶horseradishperoxidase)与相应的抗体结合,形成酶标记抗体,再与组织切片内的抗原结合,形成酶标记的抗原抗体复合物,最后用该酶的特殊底物DAB或AEC显色。本法操作简单,需要的抗血清少,专一性强,但灵敏度低。当组织内抗原较弱时,常呈假阴性反应。
2.间接法 抗原与相应的抗体(第一抗体)结合后,形成了抗原抗体复合物。此抗原抗体复合物再与酶标记的抗第一抗体的第二抗体结合,成为酶标记的抗原抗体——抗抗体复合物,最后用底物显色后,即可在显微镜下观察。灵敏度较直接法高,且即使抗原不同而第一抗体的动物相同,均可应用酶联的第二抗体。
3.PAP法(酶-抗酶法) 是改进了的桥法。其原理是将桥法中抗体3(抗辣根过氧化物酶抗体)与辣根过氧化物酶结合而形成酶抗酶(PAP)复合物。此PAP复合物再与抗原-抗体1-2结合而成为酶联的抗原-抗体-3复合物。它的特点是预先已制成PAP复合物,因此标记切片过程缩短,其次,所形成复合物系由两个抗酶抗体分子和三个酶分子结合成为较大的PAP复合物,故其敏感性较桥法高,而且消耗的酶也更少。(图3-2)
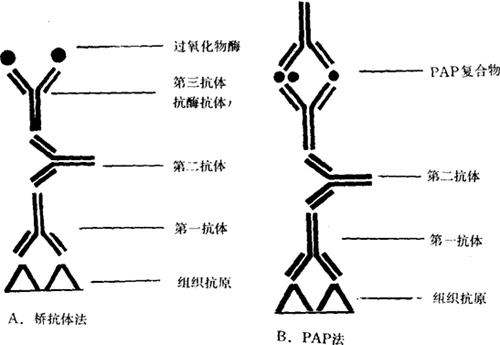
图3-2 桥法和PAP法原理示意图
4.ABC法(Avidin-Biotin-Peroxidase) 1981年HsuSu-Ming等建立了一种高度敏感的免疫酶标技术——ABC法。本法主要成分有:(1)第一抗体;(2)生物素(Biotin)标记的第二抗体;(3)亲和素(糖蛋白Avidin)-生物素-过氧化物酶复合物(ABC试剂)。
亲和素是一种大分子量(68,000)糖蛋白,对低分子量的生物素有高度的亲和力,有四个结合位置,能形成稳定复合物,而生物素是一种维生素(维生素H),存在于许多哺乳动物组织中,可以大量偶联过氧化物酶分子。由于相对大量的亲和素与生物素偶联的过氧化物酶相温育,亲和素连接生物素——过氧化物酶分子,生物素-过氧化物酶连接亲和素分子,形成“大格子”样巨大复合物,其间结合能力大约是抗原抗体结合能力的100万倍,而且复合物中亲和素结合生物素的部位并不完全被生物素-过氧化物酶分子所占据,游离的结合部位能连接标记第二抗体的生物素分子。(图3-3)

图3-3 ABC法原理示意图
由于ABC法不需要过量的生物素标记的第二抗体,因而除第一抗体可高度稀释外,同时可用高度稀释的第二抗体。据Hsu氏等报导,ABC法的敏感性较单PAP法高8~40倍。
A-B一步法 为顺序使用生物素标记的抗体及酶或生物素标记的亲和素。
A-B二步法 先用第一抗体,再用生物素标记的第二抗体,然后加酶或荧光素标记的亲和素。
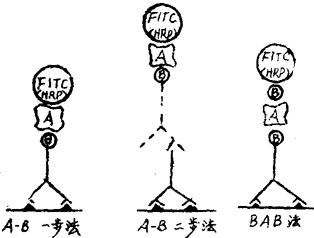
图3-4 几种ABC法示意图
亲和素-生物素桥(BAB)法先用生物素标记的抗体,再用亲和素,然后加酶或荧光素标记的生物素。亲和素充当生物素-抗体、结合物及生物素的酶结合物之间的桥。
(三)免疫荧光法,酶标法中的几个问题:
1.各方法中每步之间均要漂洗,漂洗液一般荧光法中用PBS0.01M、pH7.0~7.4,pH小于7.0或大于7.4则非特异性荧光强,酶标法则用TBS0.05M、pH7.6或PBS。
2.固定 免疫荧光法一般用冰冻切片,不固定,也可用95%乙醇或丙酮固定。若用石腊切片,非特异性荧光强,且阳性率低。免疫酶标法:用冰冻切片则要固定,丙酮或冷的10%中性福尔马林液固定5~15分钟。若用石蜡切片,则需经胰蛋白酶消化,时间不等,如λ、K为5分钟,CLA为30秒等。
3.免疫反应的温度与时间 一般37℃、30分钟;室温(20°~25℃)60分钟或过夜(石蜡切片酶标法);4℃则过夜。反应过程在湿盒内进行。
4.显色底物 免疫酶标法中,常用的显色底物有两种:(1)DAB(3.3’-二氨基联苯胺):50毫克+100毫升TBS用前加几滴3%H2O2或24毫克DAB+3.96毫升TBS用前加0.4毫升3%H2O2,搅拌并过滤。(2)AEC(3-氨基-9-乙基咔吧唑):167毫克AEC溶于100毫升二甲基亚砜,作为贮存液。用时取6毫升AEC贮存液加50毫升0.02M醋酸盐缓冲液(pH5.0~5.2)加0.4毫升3%H2O2过滤后即可。
5.切片要薄,一般4~6微米厚,若用石蜡切片则载玻片上要涂胶,以防脱片。
6.减少非特异性荧光方法(1)切片要薄,展平。(2)冰冻切片较理想。(3)漂洗要充分,一般浸泡2次,每次8~10分钟。(4)荧光染色过程中不能干。
7.增强特异性荧光(防止消褪)的方法——PPD封片法 PPD(para-phenylenediamine),即对苯二胺100毫克溶于10毫升PBS,加90毫升甘油,用pH9.0的碳酸盐-碳酸氢盐缓冲液调至pH到8.0即可,用作封片液。
8.冰冻切片保存问题 通常切片后吹干,放干燥器中,如作免疫荧光检查,环境温度-20℃(低温冰箱)可保存一年左右;10°~4℃(冰箱)可保存3个月,10°~20℃为一周到10天,接近30℃,则切片后3天内必须做,否则阳性就可能变为阴性。作酶标用的切片,一般置10℃以下或放冰箱为好,且不能久放,通常7~10天。
(四)几种免疫病理技术
1.皮肤标本直接免疫荧光(direct immunofluorescence,DIF)(1)冰冻切片:5~6微米厚、吹干。(2)PBS洗2次,每次8~10分钟,(3)滴加适当稀释的FITC标记的抗人IgG、IgA、IgM、纤维元素(fibrinogen)……及补体C3等,37℃,30分钟。(4)PBS洗2次,每次8~10分钟。(5)甘油缓冲液封片(9份甘油加1份pH8.0磷酸盐缓冲液)。(6)荧光显微镜观察。
DIF染色时应作以下对照:(1)正常人皮肤阴性对照;(2)只加抗体,不加荧光抗体,应为阴性;(3)标本自发荧光对照,即不加荧光抗体,其它步骤同前;(4)“封闭试验”:即先滴加未标记的抗体,再加荧光抗体;(5)阳性标本作阳性对照。
2.皮肤标本间接免疫荧光法(indirect immunofluorescence,IF)(1)正常人皮肤冰冻切片4~6微米厚,吹干作底物;(2)PBS洗,8分钟,2~3次,吹干;(3)滴加各种稀释度的患者血清,37℃,30分钟(1:16;32;64;12;256;……或1:20;40;80;160;320;640;……)(4)PBS洗。以下同DIF法。也需设以下几种对照:(1)底物切片,自发荧光对照;(2)底物切片,DIF法染色;(3)正常人血清代替患者血清,结果为阴性;(4)用已知病人阳性血清作阳性对照。
3.ABC法(1)标本冷冻切片5~6微米;(2)丙酮固定5分种;(3)TBS(或PBS)换洗2~3次,每次5~8分钟;(4)正常马血清1%15~20分钟,室温;(5)TBS漂洗,2~3次,每次5~8分钟;(6)IAb(第一抗体如鼠抗人单克隆抗IgG)1:×××,1小时20°~50℃,或4℃过夜;(7)TBS漂洗;(8)Bi-ⅡAb(生物素标记的第二抗体如生物素标记的马拉鼠IgG),室温,1小时;(9)TBS漂洗;(10)ABC.试剂:(试剂A加等量的试剂B稀释100倍)1小时室温;(11)TBS洗;(12)显色适时约5~10分钟;(13)复染(AEC显色、苏木素复染;DAB显色则用甲基缘复染);(14)封片观察(AEC显色的,用甘油明胶封片,DAB显色的,则可脱水,中性树胶封片)。
4.PAP法(1)标本冷冻切片,5微米厚;(2)丙酮固定5分钟;(3)TBS(或PBS)漂洗;(4)IAb(如鼠抗人各种单克隆抗体)1:×××4℃过夜或室温1小时;(5)TBS漂洗;(6)ⅡAb(如兔抗鼠IgG)1:×××,室温、1小时;(7)TBS漂洗;(8)PAP试剂(如鼠PAP,国内已有单克隆抗体出售);(9)显色;(10)封固观察。