番木瓜
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第590页(9940字)
番木瓜(Carica papaya L.)属番木瓜科(Caricaceae)。番木瓜属(Carica)共有22种,2n=18。番木瓜是C.peltafa与野生种自然杂交产生的。番木瓜种广泛栽培,高产,不仅用作果食,也有生物化学剂之源。是原维生素A和抗坏血酸的好给源。
(一)研究进展
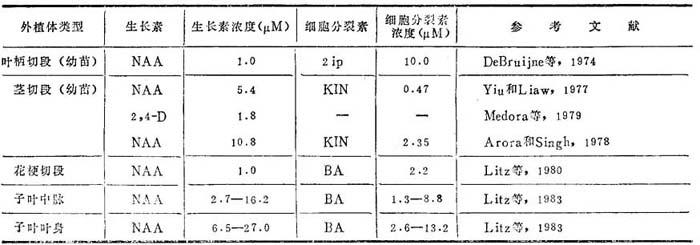
1.愈伤组织诱导 不同类型番木瓜外植体产生了愈伤组织,如幼苗叶柄,幼苗茎切断,子叶和胚珠。Litz等(1980)报道C.stipulata花梗切段诱导产生愈伤组织。大多数学者采用MS也有用WH的。Medora等(1979)诱导幼苗茎段愈伤组织和生长的最适生长调节剂是1.8μM 2,4-D。也证实了NH4NO3对愈伤组织生长有重要性,提出BA有抑制作用。另一方面DeBruijne等(1974),Arora等(1978),和Yie等(1977)肯定了NAA有利愈伤组织生长。Arora等(1978)肯定了IAA和2,4-D抑制愈伤组织形成。再者,Arora等(1978)和Yie等(1977)在其培养基中加KIN0.5-2.2μM。DeBruijne等(1974)用培养基加10μM2iP取得最高愈伤组织产量。C.stipulata花梗外植体培养在2.2μM BA和0.54μM NAA取得优质愈伤组织培养体。显然NAA加KIN,2iP或BA是番瓜愈伤组织诱导和生长最适条件。
番瓜愈伤组织淡棕色或白色,海绵状结构。接种后6-7天可见愈伤组织,生长相对旺盛。Litz等(1983)番木瓜子叶培养在含有不同组合的NAA和BA培养基上,区分出三种不同愈伤组织诱导反应。中脉和脉组织诱导最适条件是1.3-8.8μM BA和2.7-16.2μM NAA,而叶身则需要6.5-27.0μM NAA和2.6-73.2BA。在低浓度0-1.1NAA和中等浓度0.2-4.4μMBA上二者产生硬、深绿色愈伤组织。诱导愈伤组织对生长调节剂要求视外植体源或性质而不同(表23-5)。
表23-5 不同外植体类型的愈伤组织诱导和生长所需生长调节剂比较
2.体细胞胚胎发生 DeBruijne等(1974)用三步程序培养番木瓜幼苗叶柄切段产生的愈伤组织诱导体细胞胚。先将外植体暗培在MS加1.0μM NAA和10.0μM 2iP。建立了胚胎发生感受性,转入光暗,愈伤组织继代在WH加0.01μM BA,0.1/μM NAA和29.0mM蔗糖,或WH不加维生素,但加0.001μM ZEA,0.01μM BA和0.58M蔗糖培养基上,再生球形胚。再转入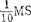 不加维生素但加0.01μM BA和0.10mM NAA发育成熟胚。提出胚胎发生似乎有赖于低蔗糖浓度(29.0mM)。Litz等(1981)虽证实了WH加更高蔗糖(175mM)和20%CW高频率再生体细胞胚。
不加维生素但加0.01μM BA和0.10mM NAA发育成熟胚。提出胚胎发生似乎有赖于低蔗糖浓度(29.0mM)。Litz等(1981)虽证实了WH加更高蔗糖(175mM)和20%CW高频率再生体细胞胚。
Yie等(1977)采用二步程序诱导幼苗茎愈伤组织体细胞胚胎发生。在MS加5.4μM NAA和0.5μMKIN诱导产生愈伤组织后,转入第二培养基含0.3μM IAA和4.7-9.4μM KIN再生体细胞胚。
Litz等(1981)报道培养番木瓜胚珠诱导多胚性,和控制胚珠愈伤组织的体细胞胚胎发生。WH加不同生长调节剂成分:不加生长调节剂,0.4,0.9,2.2和4.4μM BA;和CW20%诱导胚珠愈伤组织的胚胎发生感受性。继代在固体或液体WH加175mM蔗糖和2.7mM谷酰胺,结果产生很高频率的体细胞胚胎发生。液培效果更突出。转入固体WH加87.6mM蔗糖,2.7mM谷酰胺,0.5-10.8μM NAA和0.2-0.9μM BA诱导成熟胚发芽,并进行液培WH加175mM蔗糖,2.7mM谷酰胺和5%CW取得体细胞Carica胚的未熟发芽。
C.slipulata花梗外植体培养在液体MS产生的悬浮培养体,观察到体细胞胚胎发生,但只有在转入2.2μM BA,0.5μM NAA和10g/l活性炭后才有发生。这种程度尚未试图应用于番木瓜愈伤组织培养体。
3.器官发生 Yie等(1977)不仅从番木瓜茎愈伤组织诱导产生体细胞胚,但在相同培养基上也观察到不定芽(MS加0.3μM IAA和4.7μM KIN或单用9.4μM KIN)。Arora等(1978)发现必须将诱导培养基(LS加10.8μM NAA,2.3μM KIN,0.74mM硫酸腺嘌呤和其它附加物)的愈伤组织μM KIN和1.1μM NAA的愈伤组织转入芽诱导培养基(LS加9.2μM KIN和1.1μM NAA,而0.9μMKIN和2.7μM KIN诱导生根。
Litz等(1983)证实了番木瓜子叶培养在MS加0.5-81.0μM NAA和0-2.2μM BA,从其中脉愈伤组织形成不定芽。从培养在含0-1.1μM NAA和0.2-4.4μM BA培养基上叶身和中脉愈伤组织形成不定分生组织。
4.茎尖培养 Mehdi等(1976)在MS加4.7μM KIN的番木瓜幼苗茎尖建立了培养体,移至4.7μM KIN和24.5μM IBA诱导生根。未见多芽形成。Yie等(1977)建立离体培养番木瓜幼苗茎尖增殖生长。
Litz等(1977,1978)提出大田成年番瓜茎尖培养程序,取2-3mm茎尖培养在MS加87.6mM蔗糖147μM KIN,和10.8μM NAA培养基上。2-3个月后,取胀大的外植体继代在芽增殖培养基上:MS加2.2μM BA和0.54μM NAA。培养体建成时间和增殖率视母株年龄、年内季节、性类型和是否有细菌和病毒(rhabdovirus)污染而异。雄株的反应比雌株快,增殖较甚。在母株很快生长期间取的外植体反应最好。克隆间增殖速度不同,一般继代间增殖7-8倍。维持增殖培养体能力,经8-13次继代后消化。将侧芽继代在MS加5.4-16μMNAA,87.6mM蔗糖诱导产生顶端优势和生根。再生植株移栽大田成功。
5.胚培养 Phadnis等(1970)培养成熟番木瓜胚在WH加0.24μM KIN单用,或0.24μM KIN,0.3μM GA和0.6μM IAA取得成功。DeBruijne等(1974)用MS不加肌醇,CH或维生素,加58.4mM蔗糖也显然成功。Khuspe等(1980)证实了采用胚培养拯救C.papaya×C.cauliflora未成熟胚的实用性。用固体WH不加维生素,但加58.4mM蔗糖12.0μM氯化铜和1.2μM钼酸钠,暗培使离体未成熟杂种胚发芽。继之,幼再生植株继代在液体WH加维生素和甘氨酸,生长到可移栽大小。这为把C.cauliflora的环斑病毒抗性用于有性不亲和番瓜种的改良创造了前提。
6.花药培养 Litz等(1978)报道了番木瓜花药培养产生单倍体植株。遮荫室生长植株上取聚伞雄花序,按花芽大小分类,一般7-8mm花芽的花药处于四分子形成期;16-20mm第一次有丝分裂。取反映各个发育时期的花芽,经4℃预培养3-4天后,接种在MS上。以16-20mm花芽的花药液培在MS加87.6mM蔗糖,8.8μM BA,2.7μM NAA,和10g/l活性炭,效果最好。约每1000培养的花药产生再生植株1株。再生株单倍体染色体为n=90。
7.原生质体分离和培养 Litz等(1979)虽已报道大规模分离番木瓜原生质体,培养程序中最适条件和分离步骤都已有改进。详见原生质体分离和培养原生克隆节。已取得有限的愈伤组织诱导发生和低植板效率(Litz等,未发表)。
(二)培养程序
1.器官发生(Yiu等,1977;Arora等,1978)
(1)发芽和生长6-12番木瓜幼苗于泥炭∶珍珠岩(1∶1)中。用0.5-1.0cm叶柄或茎切段为外植体。5%clorox(v/v)溶于蒸馏水加1-2滴吞温20表面消毒10min。无菌蒸馏水充分淋洗3次。无菌培养于营养液加3-5%蔗糖2-3天。除去污染培养物。
(2)外植体转入固体WH,LS或MS附加:5-6μM NAA和0.4-0.5μM KIN(Yiu等1977),或10-11μM NAA,2.0-3.0μM KIN和3.0μM GA,13.3μM甘氨酸,1.0g/lCH,500mg/l ME,740μM硫酸腺嘌呤,0.04M烟酸,3.0μM盐酸硫胺素和4.9μM盐酸毗哆醇。全加0.087M蔗糖和8 g/l琼脂。用0.1NHCl或NaOH调节pH到5.7。高压蒸气消毒1.1kg/cm2,120℃15min。培养物放入生长箱内,25℃,光周期16h,光强1000lx。
(3)每隔2-4周继代一次,用相同培养基。
(4)愈伤组织转入无菌培养基加∶0.3μM IAA和5-10μM KIN,或1.0μM NAA和10μM KIN,以诱导芽分化。
(5)取不定芽转入无细胞分裂素培养基重建顶端优势。在培养基加5-15μMNAA或IBA可同时诱导生根。
(6)把带根再生植株移入无土钵混合物,在保护区段内间歇喷雾,约2周。
2.茎尖培养(Litz和Conover,1978)
(1)从成年大田生长番木瓜植株取2-3cm茎尖。一般番瓜无分枝,但摘顶后,能诱导产生6个侧茎。茎尖3-5cm时,除去大叶柄和花序。
(2)5-10%clorox(v/v)溶于蒸馏水加1-2滴吞温20表面消毒茎尖约10min。无菌蒸馏水充分淋洗3次。无菌培养在营养液加87.6-146mM蔗糖2-3天。除去污染培养物。
(3)用清洁茎尖转入固体MS,WH或LS加:50μM KIN和11μM NAA,87.8mM蔗糖和8g/l琼脂。用0.1N HCl或NaOH调节pH到5.7,高压蒸气消毒1.1kg/cm2,120℃,15min。
(4)培养物放入生长箱,25℃,光周期16h,强光10001x。
(5)培养1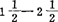 月后,茎尖长大,但顶端优势受抑制。用长大茎尖转入增殖培养基:MS加2.2μM BA,0.5μM NAA,87.6mM蔗糖,8g/l琼脂。
月后,茎尖长大,但顶端优势受抑制。用长大茎尖转入增殖培养基:MS加2.2μM BA,0.5μM NAA,87.6mM蔗糖,8g/l琼脂。
(6)增殖培养基上2周后,诱导产生侧芽生长。切取侧芽继代,每隔3周转入新鲜增殖培养基。
(7)侧芽继代在MS加5-15μM NAA或BA以重建顶端优势和形成再生植株。同样培养基取得生根。
(8)除去再生植株根部琼脂,移栽无土混合钵土内,在保护区段内间歇喷雾2周。
3.番木瓜胚珠愈伤组织有效的体细胞胚胎发生(Litz等,1982)
(1)已有可能未受精番木瓜胚珠诱导胚性发生,和从番瓜杂交胚珠内产生低频率胚性发生。为了取得最好结果,用C.cauliflora花粉授粉带有圆筒形果实的番瓜雌蕊,套袋30一120天,直到收获。
(2)将果实浸入20%(v/v)clorox表面消毒20min。无菌蒸馏水充分淋洗。
(3)解剖果实取出胚珠。放在无菌固体培养基100×15mm培养皿。培养基用1/2MS大元素和Fe·EDTA,MS微量元素和有机成分,2.7mM谷酰胺,175mM蔗糖,20%(v/v)过滤消毒的CW,高压蒸气消毒前用0.1N HCl或NaOH调节pH到5.7。高压蒸气消毒用1.1kg/cm2120℃15min。
(4)培养体放在生长箱25℃,光周期16h,光强10001x,最幼胚珠1.5月到最老胚珠3月。
(5)培养1.5月后,最幼胚珠破裂和放出体细胞胚和愈伤组织。最老胚珠必须解剖取出。
(6)从胚珠除去愈伤组织。愈伤组织硬和蜜色。用上法把愈伤组织继代在新鲜无菌培养基上。取得有限的体细胞胚胎发生。
(7)经1-2月后,愈伤组织继代在固体或液体培养基不加20%CW。液体培养物放在旋转振荡器上100rpm。产生体细胞胚胎发生。由此有可能取得充分成熟胚。
4.原生质体分离和培养
(1)番木瓜种子放在无土钵混合物中,在生长箱内25℃光周期16h。有规律地浇水和施肥。促使发芽。
(2)发芽后4-8天取子叶,漂浮在溶液上:1.0mM NH4NO3和1.0mM CaCl,·2H2O,22μ.M BA,5.4μM NAA,暗培1.5-2.5天。
(3)5%(v/v)Clorox加1-2滴吞温20消毒5min后,除去中脉,叶身撕成1mm条,浸入 加3.0mM CaCl2·2 H2O,0.3M甘露糖醇和500mg/l酪蛋白,在柔和光线下约1h。
加3.0mM CaCl2·2 H2O,0.3M甘露糖醇和500mg/l酪蛋白,在柔和光线下约1h。
(4)用过滤消毒的酶混合液代替浸液。酶混合液组成: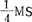 加3mM CaCl2·2H2O,500mg/l酪蛋白,200mg/l Garramycin,22.5mM四环素,1.1mM阿比西林,0.3M甘露糖醇,0.5%macerozyme和1.5%纤维素酶。叶组织用酶混合液真空渗入处理,暗培,旋转振荡器40rpm4h。
加3mM CaCl2·2H2O,500mg/l酪蛋白,200mg/l Garramycin,22.5mM四环素,1.1mM阿比西林,0.3M甘露糖醇,0.5%macerozyme和1.5%纤维素酶。叶组织用酶混合液真空渗入处理,暗培,旋转振荡器40rpm4h。
(5)原生质体悬浮液经63μM筛过滤,70-80×g离心5min,分离原生质体。除去上清液,换之以相同溶液,重复2-3次。
(6)原生质体再悬浮在培养基中,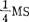 大量元素不加NH4NO3,加3mMCaCl2·2H2O.500mg/l酪蛋白,0.3M甘露糖醇,MS微量元素,
大量元素不加NH4NO3,加3mMCaCl2·2H2O.500mg/l酪蛋白,0.3M甘露糖醇,MS微量元素,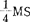 Fe·EDTA,MS有机成分,2.7mM谷酰胺,10%CW,58.4mM蔗糖和5mM NH4NO3,密度1-2×105原生质体/ml,用密度5×104-1×105原生质体/ml植板在薄层液基中(装在培养皿内)。
Fe·EDTA,MS有机成分,2.7mM谷酰胺,10%CW,58.4mM蔗糖和5mM NH4NO3,密度1-2×105原生质体/ml,用密度5×104-1×105原生质体/ml植板在薄层液基中(装在培养皿内)。
(三)展望
有些番木瓜属野生种具有有用特性,如抗病性、耐寒性、小果实、和生长习性矮,是改进番木瓜所需的。许多种和番木瓜的不亲和性性质尚不清楚,但应用胚或胚珠培养、人工受精、甚至控制下原生质体融合,应有可能予以克服。
能有效地再生体细胞胚或不定再生植株的悬浮培养物,将成为番木瓜开发离体培养选择体系最重要手段。番木瓜植株对杀虫剂和除莠剂损害极度敏感,对许多真菌病原菌例如Phytophthora sp.,Pythium sp。等等毫无抵抗能力。离体培养选择化学损害抗性和毒素抗性,将能大大地降低生产损失。
Medora等(1973)报道蛋白水解酶活性在幼苗茎愈伤组织培养物产生,表征了有些酶的基质专化性(Mellet等1979)。番木瓜果实愈伤组织未见这种活性,但在番木瓜成熟果实中很少papain。papain是硫氢基酶,和硫氢基是酶活性所必需。在酶制品中加半胱氨酸可克服硫氢基的破坏。在细胞培养体中加番木瓜酶的适宜前导物有可能产生番木瓜酶。另一方法,加半胱氨酸使硫氢基不受破坏,由此有可能在离体培养下活化已存在的蛋白水解酶。
经组织培养克隆产生的体细胞变异植株,可用于克服作物为害状态,包括番木瓜栽培品种。番木瓜属体细胞胚产生的再生植株出现一些有价值变异性,包括高比例的3或4子叶、叶柄色素差异和节间长度变化。也曾观察到培养的茎尖产生低比例的两性花植株转变成雌性类型。无论从叶原生质体经器官发生,或从增殖中的茎尖培养物,或从体细胞胚产生的番木瓜植株,可能具有满意有用变异,供番木瓜改良利用。
渴望花药培养产生有效单倍体植株产量的程序。大田条件抗病和逆境的单倍体植株,经染色体加倍可产生同质二倍体母系。用同质雄株产生杂种栽培品种,将消除雌雄异株番木瓜类型间的变异性。
研究番木瓜原生质体再生植株的完整程序,将有助于植物育种家,如遗传工程技术,好比重组DNA或细胞器吸取,变成直接应用于番木瓜改良。
【参考文献】:
〔1〕Arora,I.K.and R.N.Singh 1978 Growth hormones and in vitro callus formation of papaya.Sci.Hortic.8∶357-381.
〔2〕DeBruijne,E.,E.DeLanghe,and R.van Rijck 1974 Action of hormones and embryoid formation in callus cultures of Carica papaya.Int.Symp。Fytofarm.Fytiat。26∶637-645.
〔3〕Litz,R。E,and R.A.Conover 1978 In vitro propagation of papaya.Hortscience13∶241-242.
〔4〕Litz,R。E。1981 In vitro polyembryony in Carica papaya L。ovules.Z.pflanzen-physiol.104∶285-288.
〔5〕Yiu,S.an.d S.I.Liaw 1977 Plant regeneration from shoot tips and callus of papaya。In vitro 13∶564-567.〔6〕Krul,W.R.and J.Myerson 1980 In vitro propagation of grape.In∶Proc.Conf.on Nursery Production of Fruit Plants through Tissue Culture.Applications and Feasibility(R.Zimmerman,ed.)pp.35-43,USDA Sci.and Education Adm-inistrotion,Agric.Res.Results,ARR-NE-11,Beltsville,Margland.
〔7〕Lai,P.C.and H.T。I,1980 Studies on tissue culture of grape(Vitis viniferaL.):Influence of environmental factors on the growth and differentiat ion of gra pe callus.J.Agric.Res.China,29(2)∶157-165.
〔8〕Meredith,C.P.1981 Genetic engineering-The outlook for grapes,Wine Inves-tor 5∶1——4。
〔9〕Mowbray,G.H.1981 Clone me around again,Willie.Virginia Farm Vine-to-Wine letter 1∶4-5.
〔10〕Olmo,H.P.1976 Grapes.In∶Evolution of Crop Plants(N.W.Simmonds,ed.)pp。294——298,Acad.Press,New York.
〔11〕Hadaka,T。,Y.Yarnada and T.Shichijo 1979 In vitro differentiation of haploid plants by anther culture in Poncirus trifoliata(L.)Raf.Jpn. J.Breed.29∶248-254.
〔12〕Maheshwari,P.and N.S.Rangaswamy 1958 Polyembryony and in vitro Culture of embrvos of Citrus and mangifera.Zndian J.Hortic。15∶275-282.
〔13〕Navarro,L。,C.N.Roistacher and T.murashige 1975 Improvement of shoot-tip grafting in vilro for vitus free clones.J.Am。Soc.Hortic.Sci.100∶475-479.
〔14〕Spiegel-Roy,P.and J.Kochba 1980 Embryogenes is in Citrus tissue cultures.In Advances in Biochemical Engineering(A Fi echt er,ed)Vol。16,pp.27-48, Springer Verlag,Berlin,Heidelberg.
〔15〕Vardi,A.1982 Protoplast derived plants from different Citrus Species and cultivars.Proc.I ntern.Soc.Citicultune.(1981)1∶149-152.