除铁除锰
出处:按学科分类—工业技术 轻工业出版社《制浆造纸手册:第十二分册供水与供汽》第55页(2116字)
通用的方法有三种:(1)沉淀析出随后过滤;(2)离子交换;(3)使用弥散剂、使铁和锰稳定在悬浮状态、以防止这些金属的沉淀。
1.沉淀析出和过滤
使水通过曝气塔后进入沉淀池使之停留,絮凝,然后过滤,当水中含有FeSO4时,用曝气法是除不掉的,故多采用加石灰的方法予以除去。
铁成为胶状形态的Fe(OH)3或成为有机化合物(腐植酸铁)而存在于水中,籍凝聚剂之助进行沉淀或过滤。
有时为了氧化水中处于还原状态的二阶铁离子,用氯作氧化剂来代替溶解氧,这时的反应如下:
2Fe+1+C12+6H2O→2Fe(OH)3+2C1-十6H+
在这种情况下,氧化所需氯量是1mg/L的氯对1.6mg/L的Fe+3、所以比氧的用量要多些。但在pH值较低的时候(pH=4.0~5.0),氯与氧相比能在较短时期内进行氧化(表14-1-48)。
表14-1-48 pH值对氯氧化亚铁的影响

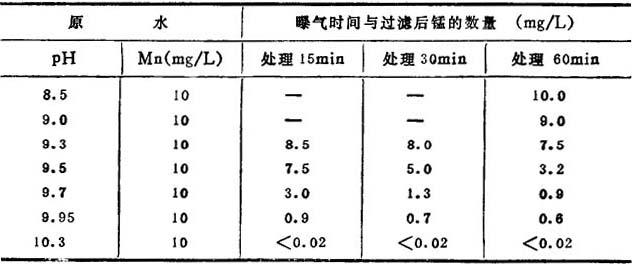
利用氯化处理除铁,一般多与曝气或接触过滤同时使用,在有机物和硅酸妨碍氧化的条件,用氯来氧化也是有效的。用于除锰,则pH值应在8.5以上,如表14-1-49所示。
表14-1—49
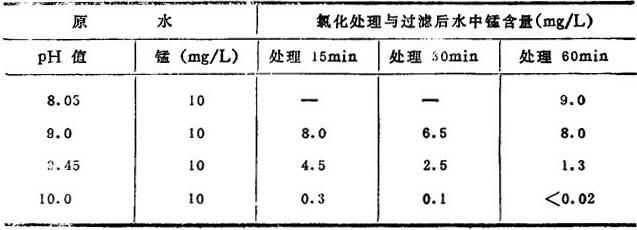
氯化处理时,投氯量一般是使游离的剩余氯为0.5~1mg/L左右。当pH值低时,原水中如果存在0.2mg/L以上的锰(以锰计),往往呈淡褐色,必须注意。
表14-1-50,14—1—51分别是典型的除铁、除锰数据。
表14-1-50
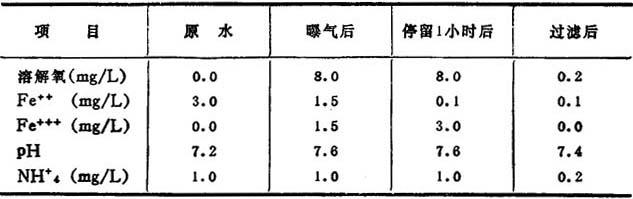
表14—1-51
接触过滤池是一种使铁、锰氧化和过滤同时进行的设备,其滤料是用含锰的高价氧化物,这种滤料一般是将锰砂(人为地将锰的氧化物附着在砂上),绿砂或人造沸石用硫酸锰,氯化锰与高锰酸钾溶液交替反复处理后所得到的锰沸石等。
其反应式如下:
Na2Z+MnSO4→MnZ+Na2SO4
沸石:
MnZ+2KMnO4→K2Z·MnO4·Mn2O7
水中的铁与锰沸石可以发生如下反应:
K2Z·MnO·Mn2O7+4Fe(HCO3)2→K2Z+3MnO2+2Fe2O3+8CO2+4H2O
而高锰酸钾进行再生的反应是:
MnZ+2KMnO4→K2Z·MnO·Mn2O7
锰砂上附着的MnO(OH)2或MnO2·H2O在中性或微酸性条件下,可与水中的锰结合,生成MnO2·MnO,因而丧失氧化能力。在碱性条件下与氧共存时,和锰结合生成MnO2·MnO以后,还能维持氧化能力。
锰沸石在外观上是黑褐色的硬质颗粒,粒度为15~50目,相对密度为1.3,除铁能力是每升锰砂能氧化去除0.9~1.5g的铁。再生时使用0.5~1%的KMnO溶液,用它把沸石层浸泡数小时。
换触过滤池滤床的厚度一般为1m,滤速为5~8m/h,最低反冲洗流速为20m/h,水头损失达5m时,就必须进行反冲洗,再生次数因原水中的含铁量而异,一般是每月3~4次,原水含铁量在10mg/L以下时,用锰沸石除铁是有效的,而2~3mg/L时最佳;当含有较多的CO2时,最好先曝气或加碱提高pH值。采用这一方法时水的pH值不能太低,不能含有H2S。处理完的水含铁量在0.2~0.3mg/L左右。
近年来在除铁除锰技术中,有人使用锻烧的菱镁矿和硅藻土过滤。把煅烧的菱镁矿(变成MgO)和硅藻土投到快速混合池中,接触5~10min,在这期间内Fe++和Mn++与MgO接触而被氧化。如要除锰,则加入高锰酸钾作氧化剂。然后再通过硅藻土滤池进行净化,这一方法的优点是每次过滤后,清除过滤介质,从而避免了过滤介质上的任何沉淀积累。
2.离子交换法
除铁时用的交换剂,大都是由食盐再生的沸石,磺化煤和离子交换树脂,这一方法仅适用于铁、锰含量较低的情况(小于0.5mg/L),因为铁锰离子的积累,可使交换剂失去交换能力。故单独除铁、除锰很少采用此法。