油菜籽、植株和土壤中残留量检测方法
出处:按学科分类—农业科学 中国农业出版社《农药残留量实用检测方法手册第3卷》第449页(4341字)
中国科学院上海昆虫研究所 徐乃旭 陈问达
油菜籽和土壤样本用甲醇/硫酸铜水溶液提取;植株样本用甲醇/水溶液提取。经三氯甲烷液-液分配和活性炭/硅藻土柱层析净化,液相色谱法(UV)测定烯草酮。
油菜籽和土壤样本用甲醇/硫酸铜水溶液浸渍提取,三氯甲烷萃取;植株样本用三氯甲烷提取。活性炭/硅藻土和弗罗里硅土/硅藻土柱层析净化,气相色谱法(FPD-S)测定代谢物DME-OH。
1.主要仪器及设备
气相色谱仪 火焰光度检测器(FPD-S)
高压液相色谱仪 紫外检测器(UV)
旋转蒸发器
大容量离心机
玻璃层析柱 Φ15mm×180mm
2.主要试剂
甲醇(重蒸或HPLC纯)、丙酮(重蒸)、石油醚(重蒸)、三氯甲烷(重蒸)、乙酸乙酯(重蒸)、盐酸、氯化钠、无水硫酸钠、硫酸铜、氢氧化钠、活性炭(黑色无定形粉末)、弗罗里硅土、硅藻土(100~120目)
烯草酮标准品、DME-OH标准品
3.检测步骤
3.1 提取
3.1.1 烯草酮的提取
3.1.1.1 油菜籽
称取50g样本,加入50mL0.5mol/L硫酸铜溶液、10g硅藻土和150mL甲醇浸泡过夜,过滤。再用100mL50%甲醇溶液洗涤残渣后过滤,合并滤液。
3.1.2 植株
称取20g样本,加入100mL50%甲醇水溶液,组织捣碎后倒入烧杯中。用50mL50%甲醇溶液洗涤残渣后并入玻璃烧杯中,加入100mL0.25mol/L氢氧化钠搅拌后过滤。再用100mL0.1mol/L氢氧化钠溶液洗涤残渣后过滤,合并滤液。
3.1.3 土壤
称取50g土壤样品,加入20mL0.5mol/L硫酸铜溶液和80mL甲醇浸泡过夜。过滤,用50mL50%甲醇溶液洗涤残渣过滤,合并滤液。
3.1.4 DME-OH的提取
3.1.4.1 油菜籽
同烯草酮的提取。
3.1.4.2 植株
称取20g植株样本,加入100mL三氯甲烷,组织捣碎,过滤。用50mL三氯甲烷洗涤残渣后过滤。合并滤液并经无水硫酸钠干燥收集,用旋转蒸发器减压浓缩至3mL左右,待柱层析净化。
3.1.4.3 土壤
同烯草酮的提取。
3.2 净化
3.2.1 烯草酮的净化
3.2.1.1 液-液分配
油菜籽滤液中加入150mL蒸馏水和2mL6mol/L盐酸;植株滤液中加入4mL6mol/L盐酸;土壤滤液中加入80mL蒸馏水和2mL6mol/L盐酸。用50mL×3三氯甲烷萃取,合并三氯甲烷相(如萃取后不能分相可用离心分离)。用10mL0.5mol/L氯化钙和50mL1mol/L氢氧化钠反萃取两次。合并水相,用100mL石油醚洗涤1次,弃去石油醚相。向水相中加入2mL6mol/L盐酸,用30mL、30mL、20mL三氯甲烷萃取3次。合并三氯甲烷萃取相,经无水硫酸钠干燥后,用旋转蒸发器减压浓缩至3mL左右,待柱层析净化。
3.2.1.2 柱层析净化
层析柱中依次装入2cm无水硫酸钠、5g活性炭/硅藻土(1∶4,W/W)和2cm无水硫酸钠。用150mL三氯甲烷预淋。将上述浓缩液移入层析柱中,用5mL三氯甲烷洗涤容器用于淋洗并弃去。用35mL三氯甲烷洗脱并收集,用旋转蒸发器浓缩至近干,加入3mL甲醇继续浓缩至近干。用甲醇定容,待测。
3.2.2 DME-OH的净化
3.2.2.1 液-液分配
油菜籽滤液中加入150mL蒸馏水和2mL6mol/L盐酸,用50mL×3三氯甲烷萃取。合并三氯甲烷相,用旋转蒸发器减压浓缩至3mL左右,待柱A净化。
土壤滤液中加入80mL蒸馏水和2mL6mol/L盐酸。用50mL×3三氯甲烷萃取。合并三氯甲烷相,用旋转蒸发器减压浓缩至3mL左右。加入3mL×215%乙酸乙酯石油醚溶液继续浓缩至近干,待柱B净化。
3.2.2.2 柱A净化
层析柱中依次装入2cm无水硫酸钠、5g活性炭/硅藻土(1∶4,W/W)和2cm无水硫酸钠,用50mL三氯甲烷预淋。将油菜籽和植株的三氯甲烷浓缩液移入层析柱中,用5mL三氯甲烷洗涤容器并淋洗柱子,流出液弃去。再用35mL三氯甲烷洗脱并收集,用旋转蒸发器减压浓缩至近干,加入3mL×215%乙酸乙酯石油醚溶液继续浓缩至近干,供柱B净化。
3.2.2.3 柱B净化
层析柱中装入2cm无水硫酸钠,然后依次加入50mL石油醚、5g弗罗里硅土、1g硅藻土和2cm无水硫酸钠。将石油醚液面降至柱顶,将柱A的洗脱浓缩液移入层析柱中。先后用50mL15%乙酸乙酯石油醚溶液和20mL50%乙酸乙酯石油醚溶液淋洗,流出液弃去。再用30mL50%乙酸乙酯石油醚洗脱并收集,用旋转蒸发器减压浓缩至近干,加入3mL甲醇继续浓缩至近干,用三氯甲烷定容,待测。
3.3 定量测定
3.3.1 液相色谱法测定烯草酮
检测器 UV,255nm
色谱柱 μBONDAPAKTMC18,Φ3.9mm×30cm不锈钢柱
流动相 乙腈/蒸馏水/醋酸(343∶150∶7,V/V/V)
流速 1.0mL/min
进样量 20μL
保留时间 6.7min
3.3.2 气相色谱法测定DME-OH
检测器 FPD-S
色谱柱 Φ4mm×0.4m玻璃柱,3%FFAP/GCS880 AW DMCS80~100目
检测温度 柱温230℃,进样口280℃,检测器255℃
载气 高纯氮,25mL/min
燃烧气 空气1.3kg/cm2,氢气1.2kg/cm2
保留时间 3.5min
4.结果计算
烯草酮 外标(峰面积)-标准曲线法定量。
DME-OH 外标(峰面积的平方根)-标准曲线法定量。
5.灵敏度、准确度和精确度
最小检出量 烯草酮1.5×10-9g;DME-OH5×10-10g。
最低检测浓度 0.01mg/kg。
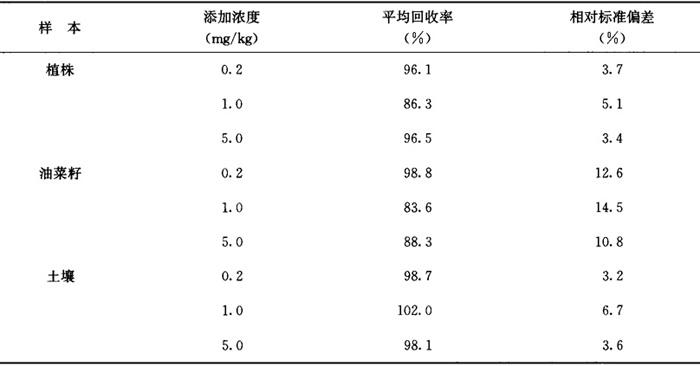
回收率 油菜籽、植株和土壤中添加烯草酮0.2~5.0mg/kg时,平均回收率分别为85.6%~101.6%、85.1%~90.1%和82.3%~89.6%,见表3-11-1。添加DME-OH0.2~5.00mg/kg时,平均回收率分别为83.6%~98.8%、86.3%~96.5%和98.7%~102.0%。见表3-11-2。
相对标准偏差 3.1%~16.5%,见表3-11-1、3-11-2。
表3-11-1 油菜籽、植株和土壤中烯草酮添加回收率及相对标准偏差实验结果

表3-11-2 油菜籽、植株和土壤中DME-OH添加回收率及相对标准偏差实验结果
6.油菜籽、植株和土壤中烯草酮和DME-OH测定谱图
见图3-11-1。

图3-11-1 油菜籽、植株和土壤中烯草酮和DME-OH测定谱图