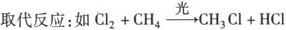氯气的化学性质
出处:按学科分类—文体、科学、教育 商务印书馆国际有限公司《高中数理化公式定理大全》第360页(1567字)
1.与金属反应:
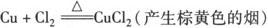
注意 ①除Pt、Au外的大多数金属都能与氯气反应生成相应的金属氯化物.
②Cl2与变价金属(如Cu、Fe)反应生成高价金属氯化物.
2.与H2反应:

注意 物质的燃烧不一定要有氧气参加,任何发光、发热的剧烈的化学反应,都是属于燃烧.
H2与Cl2反应生成的HCl气体具有刺激性气味,极易溶于水.HCl气体的水溶液叫氢氯酸,俗称盐酸.
3.与水反应:
氯气不仅能溶于水且溶解的Cl2有一部分与水反应.
新制氯水中存在三种分子(Cl2、H2OHClO),四种离子(H+、Cl—、ClO—、OH—).氯水成分的复杂性决定了氯水性质的多样性
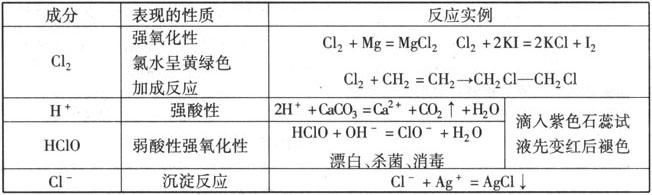
注意 ①久置的氯水由于Cl2不断与H2O反应和HClO的分解,最后变成稀盐酸.
②Cl2使湿润的有色布条褪色而不能使干燥的有色布条褪色.原因是Cl2本身没有漂白性,真正起漂白作用的是Cl2与H2O反应生成的HClO.
4.与碱溶液反应:
常温下,Cl2与碱溶液反应:
氯气+碱→氯化物+次氯酸盐+水
如:Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
注意 ①漂白精(或漂白粉)的主要成分为Ca(ClO)2和CaCl2,其有效成分为Ca(ClO)2.
②漂白精的漂白原理:
Ca(ClO)2+CO2+H2O=CaCO32HClO
Ca(ClO)↓(2+2HCl=CaCl2+2HClO
由于反应生成HClO,所以漂白精具有漂白作用,又由于Ca(ClO)2能与CO2、H2O反应所以漂白粉或漂白精应密闭保存.
5.与其他还原性物质反应:
Cl2+2KI=2KCl+I2
Cl2+H2S=2HCl+S
Cl2+2FeCl2=2FeCl3
Cl2+H2O+Na2SO3=Na2SO4+2HCl
6.与有机物反应:
加成反应:如Cl2+CH2=CH2→CH2ClCH2Cl