食品中BHA、BHT、PG的含量测定
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第44页(8130字)
(一)薄层色谱法
1.原理
用甲醇提取油脂或食品中脂肪的抗氧化剂,用薄层色谱定性,根据其在薄层板上显色后的最低检出量,与标准品最低检出量比较而概略定量,对高脂肪食品中的BHA、BHT、PG能定性检出。
2.试剂和溶液
2.1 甲醇。
2.2 石油醚(30~60℃)。
2.3 异辛烷。
2.4 丙酮。
2.5 冰乙酸。
2.6 正己烷。
2.7 二氧六环。
2.8 硅胶G 薄层用。
2.9 聚酰胺粉 200目。
2.10 可溶性淀粉。
2.11 BHT、BHA、PG混合标准溶液的配制 分别准确称取BHT、BHA、PG各10.0mg,分别用丙酮溶解转入3个10mL容量瓶中,用丙酮稀释至刻度。每毫升含1.0mgBHT,BHA、PG,吸取BHT(1.0mg/mL)1.0mL、BHA(1.0mg/mL)、PG(1.0mg/mL)各0.3mL,置于同一个5mL容量瓶中,用丙酮稀释至刻度。此溶液每毫升含0.20mgBHT、0.060mgHBA、0.060mgPG。
2.12 显色剂 2,6-二氯醌-氯亚胺的乙醇溶液(2g/L)。
3.仪器
3.1 减压蒸馏装置。
3.2 浓缩瓶具刻度的尾管。
3.3 层析槽。
3.3.1 24cm×6cm×4cm。
3.3.2 20cm×13cm×8cm。
3.4 玻璃板 5cm×20cm,10cm×20cm。
3.5 微量注射器 10μL。
4.测定方法
4.1 提取。
4.1.1 植物油(花生油、豆油、菜籽油、芝麻油):称取5.00g油置于10mL具塞离心管中,加入5mL甲醇,密塞振摇5min,放置2min,离心(3000~3500r/min)5min,吸取上层清液置25mL容量瓶中,如此重复提取5次,合并每次甲醇提取液,用甲醇稀释至刻度。吸取5mL甲醇提取液置一浓缩瓶中,于40℃水浴上减压浓缩至0.5mL,留作薄层色谱用。
4.1.2 猪油:称取5.00g猪油置50mL具磨口的锥形瓶中,加入25mL甲醇,装上冷凝管于75℃水浴上放置5min,待猪油完全熔化后,将锥形瓶连同冷凝管一起自水浴中取出,振摇30s,再加入水浴30s;如此振摇3次后放入75℃水浴,使甲醇层与油层分清后,将锥形瓶连同冷凝管一起置冰水浴中冷却,猪油凝固,甲醇提取液通过滤纸滤入50mL容量瓶中,再自冷凝管顶端加入25mL甲醇,重复振摇提取1次,合并2次甲醇提取液,将该容量瓶置暗处放置,待温度升至室温后,用甲醇稀释至刻度。吸取10mL甲醇提取液置一浓缩瓶中,于40℃水浴上减压浓缩至0.5mL,留作薄层色谱用。
4.1.3 食品(油炸花生米、酥糖、巧克力、饼干):按本章第三节食品中BHA与BHT的含量测定。
4.1.4 测定脂肪的含量,并称取约2.00g的脂肪,视提取出的油脂是植物油还是动物性脂肪而决定提取方法。可按4.1.1或4.1.2操作。
4.2 测定。
4.2.1 薄层板的制备:
4.2.1.1 硅胶G薄层板:称取4g硅胶G置玻璃乳钵中,加10mL水,研磨至粘稠状,铺成5cm×20cm的薄层板3块,置空气中干燥后于80℃烘1h,存放于干燥器中。
4.2.1.2 聚酰胺板:称取2.4g聚酰胺粉,0.6g可溶性淀粉置于玻璃乳钵中,加约15mL水,研磨至浆状,铺成10cm×20cm的薄层板3块,置空气中干燥后于80℃烘1h,放置干燥器中保存。
4.2.2 展开剂。
4.2.2.1 用10μL微量注射器在5cm×20cm的硅胶G薄层板上距下端2.5cm处点3点:标准溶液5μL,样品提取液6~30μL,标准溶液5μL。
4.2.2.2 另取一块硅胶G薄层板点3点:标准溶液5μL,样品提取液1.5~3.6μL,标准溶液5μL。
4.2.2.3 用10μL微量注射器在10cm×20cm的聚酰胺薄层板上距下端2.5cm处点:标准溶液5μL,样品提取液10μL,加标准溶液5μL,边点样边用吹风机吹干,点上1滴吹干后再继续滴加。
4.2.3 点样。
4.2.3.1 硅胶G薄层板:正己烷-二氧六环-乙酸(42+6+3),异辛烷-丙酮-乙酸(70+5+12)。
4.2.3.2 聚酰胺板:
a 甲醇-丙酮-水(30+10+10)。
b 甲醇-丙酮-水(30+10+12.5)。
c 甲醇-丙酮-水(30+10+15)。
对甲醇-丙酮-水系统,芝麻油只能用a,菜籽油用b,食品用c。展开系统中水的比例对花生油、豆油、猪油中PG的分离无影响。
将点好样的薄层板置预先经溶剂饱和的展开槽内展开16cm。
4.2.4 展开。
4.2.4.1 硅胶G板自层析槽中取出,薄层板置通风橱中,挥干至PG标准点显示灰黑色斑点。即可认为溶剂已基本挥干,喷显色剂,置110℃烘箱中加热10min,比较色斑颜色及深浅,趁热将板置氨蒸气槽中放置30s,观察各色斑颜色变化。
4.2.4.2 聚酰胺板:自层析槽中取出薄层板置通风橱中吹干,喷显色剂,再通风挥干,直至PG斑点清晰。
4.2.5 评定。
4.2.5.1 定性:根据样品中显示出的BHT、BHA、PG点与标准BHT、BHA、PG点比较Rf和显色后斑点的颜色反应定性。如果样液点显示检出某种抗氧化剂,则样品中抗氧化剂的斑点必须与加入内标的抗氧化剂斑点重叠。
当点大量样液时,由于杂质多,使样品中抗氧化剂点的Rf略低于标准点。这时必须在样品点上滴加标准溶液作内标,比较Rf。
4.2.5.2 概略定量及限度试验:根据薄层板上样液点抗氧化剂所显示的色斑深浅与标准抗氧化剂色斑比较而估计含量,如果在4.2.2.1中硅胶G薄层板上,样品中各抗氧化剂所显色斑浅于标准抗氧化剂色斑,则样品中各抗氧化剂含量在本方法的定性检出限量以下(BHA、PG点样量为6μL,BHT点样量为30μL)。如果在4.2.2.2中硅胶G薄层板上,样品中各抗氧化剂所显色斑的颜色浅于标准抗氧化剂色斑,则样品中各抗氧化剂的含量没有超过使用卫生标准(BHA、PG点样量为1.5μL,BHT点样量为3.6μL)。如果样品点色斑颜色较标准点深,可稀释后重新点样,估计含量。
表2-1 BHT、BHA、PG在薄层板上的最低检出量、Rf及斑点颜色

注:PG在硅胶G板上定性及半定量不可靠,有干扰,且Rf太小,需进一步用聚酰胺板展开。
5.分析结果的表述

式中 x——样品中抗氧化剂(BHA、BHT、PG)以脂肪汁的含量,g/kg
m1——薄层板上测得样品点抗氧化剂的质量,μg
V1——供薄层层析用点样液定容后的体积,mL
V2——滴加样液的体积,mL
D——样液的稀释倍数
m2——定容后的薄层层析用样液相当于样品的脂肪质量,g
表2-2 所示样品中各抗氧化剂定性检出限度

(二)比色法
1.原理
比色法是选用石油醚将食品中的PG、BHA、BHT三种混合物萃取出来,然后用水从萃取液中萃取PG,再经柱层析分离BHA、BHT,用石油醚洗提BHT,无水乙醇洗提BHA,最后分别用福林-酚试剂显色,用分光光度计比色定量。
2.试剂和溶液
2.1 石油醚 30~60℃。
2.2 1%碳酸钠溶液。
2.3 无水乙醇 分析纯。
2.4 硅胶 柱层析用,过60目筛。
2.5 福林-酚试剂 称取钼酸钠25g,钨酸钠100g,加入85%磷酸50mL,浓盐酸100mL,水700mL,回流加热10h。然后加入硫酸锂150g,水50mL,溴数滴,煮沸15min,使过剩的溴逸出,加水稀释到1000mL。
2.6 PG、BHA、BHT标准溶液 准确称取这3种标准品各100mg,用80%乙醇配制成100mL,混匀,每毫升含PG、BHA、BHT各1000μg,置于冰箱备用。
3.仪器
3.1 蒸馏烧瓶 1000mL。
3.2分液漏斗 250mL。
3.3 层析柱 直径1.5cm,下具活塞。
3.4 分光光度计。
4.测定方法
4.1 样品制备和提纯 将样品用研钵研细,称取5~10g于250mL碘价瓶中,加石油醚50mL,不断振摇0.5h,倒入50mL具塞量筒中,使其澄清,吸取上清液25mL入分液漏斗中,加水萃取(糖果、巧克力、花生米等加3mL水萃取,饼干加10mL水萃取),充分振摇约20min,静置分层后,将下层水液放入50mL容量瓶中,定容至刻度作为PG检液。
在直径2cm层析管中,下填玻璃棉,加少量无水硫酸钠,加13g硅胶,上层再加少量无水硫酸钠(硅胶吸附层总高度为10cm),先用石油醚湿润,然后将分液漏斗中的石油醚层(BHA、BHT混合液)一起倒入层析柱中,加石油醚洗提,将最初洗提出来的50mL倒回层析柱中,然后用150mL容量瓶收集至刻度,作为BHT检液。
待柱内剩余洗提液基本流尽,再用无水乙醇洗提,收集在100mL容量瓶中,作为BHA检液。
4.2 显色和比色 分别吸取适量PG、BHA、BHT检液于50mL瓷蒸发皿中(内含抗氧化剂20~50μg),各加10%碳酸钠溶液0.5mL、蒸馏水5mL、福林-酚试剂0.5mL(用蒸馏水将其总体积调至6mL),充分搅匀,加表面皿,放置暗处2h,使之充分显色(3种抗氧化剂溶液均呈现蓝色,同时做一空白作参比液)。
然后分别在吸收波长730nm下测定其吸光度。但灵敏度不一,次序为PG<BHA<BHT。
4.3 标准曲线 精确吸取不同浓度的抗氧化剂标准溶液1mL(PG、BHA、BHT含量分别为0、5μg、10μg、20μg、30μg、40μg、50μg)于10mL刻度试管中,各加10%碳酸钠0.5mL、蒸馏水4mL、福林-酚试剂0.5mL,充分搅匀(体积为6mL),在避光处放置2h,用1cm比色杯,以零管作参比液,在730nm下测定其吸光度。
5.分析结果的表述
以所得样液吸光度,在标准曲线上分别查出对应PG、BHA、BHT浓度(μg/mL),然后按式(2-13)计算样品中PG、BHA、BHT含量(μg/g)。

式中 x——样品中抗氧化剂含量,μg/g
ρ——从标准曲线上查得PG、BHA、BHT的浓度,μg/mL
V1——定容体积,mL
V2——显色时取样体积,mL
m——样品质量,g
(三)液相色谱法
1.原理
样品用己烷溶解,用乙腈萃取抗氧化剂,萃取液浓缩后,用等体积异丙醇稀释,再注入液相色谱仪经反相柱分离,用紫外检测器波长280nm检测。
2.试剂和溶液
2.1 乙腈 紫外光谱纯。
2.2 正己烷 优级纯。
2.3 萃取溶剂 乙腈的正己烷饱和液。
2.4 标准溶液。
2.4.1 贮备液:1mg/mL,准确称取各种抗氧化剂10mg,置于10mL棕色容量瓶中,加入2-丙醇-乙腈(1∶1)混合液溶解,并稀释至刻度,摇匀。于5℃贮存备用。
2.4.2 工作标准溶液:10μg/mL,移取贮备溶液1mL置于100mL棕色容量瓶中,用2-丙醇-乙腈(1∶1)混合液稀释至刻度,摇匀。
2.5 流动相
2.5.1 蒸馏水加5%乙酸。
2.5.2 乙腈加5%乙酸。
3.仪器
液相色谱仪,备有进样器、紫外检测器、记录仪或积分仪。
3.1 液相色谱条件。
3.1.1 柱:Li ChrosorbRF-18(10μm粒25cm×4.6mmid)。
3.1.2 流动相梯度:B液30%~100%/10min,并保持4min,流速2mL/min。再将流速升至6mL/min,保持5min,然后降至2mL/min,在1min内B液由100%降回30%,维持10min,再进入另一试样测定。
3.1.3 检测器:UV280nm,0.05Aufs。
4.操作步骤
4.1 液体油 称取试样20g于50mL烧杯中,用正己烷溶解,定量转放100mL容量瓶中,并用正己烷稀释至刻度,混匀。取25mL放入125mL分液漏斗中,用乙腈萃取3次,每次50mL,如有乳化,可将分液漏斗置于急骤的自来水下5~10s破坏。用250mL分液漏斗收集萃取液,萃取液可在冷却条件下保存过夜。
用减压浓缩仪在40℃水浴中10min内迅速蒸发至剩余3~4mL,再用乙腈稀释至刻度。混匀,立即进行HPLC测定。
4.2 猪油或脂油 准确称取10g试样,放入50mL烧杯中,加入30mL正己烷,必要时加热溶解,定量转入100mL容量瓶中,用正己烷稀释至刻度,混匀,以下同液体油操作。
5.测定方法
取制备好的试样溶液20μL注入色谱仪,按规定程序测定。在每个试样前后注入抗氧化剂标准溶液20μL,按规定程序测定。根据测得的峰高或峰面积按外标法定量。
6.分析结果的表述
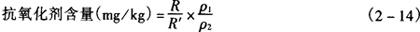
式中 R——样品中抗氧化剂的峰高或面积,mm或mm2
R′——标准品中抗氧化剂峰高或面积,mm或mm2
ρ1——标准品的浓度,μg/mL
ρ2——样品液的浓度,g/mL