β-胡萝卜素
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第119页(8165字)
结构式
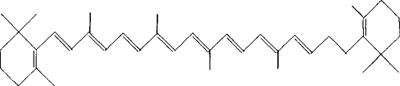
分子式:C40H56
相对分子质量:536.89
一、β-胡萝卜素的鉴别
1.试剂和溶液
1.1 三氯甲烷 分析纯。
1.2 环己烷 分析纯。
2.操作步骤
2.1 溶液的制备 精密称取0.05g样品,置于100mL棕色容量瓶中,加10mL三氯甲烷使之溶解,立即用环己烷稀释至刻度,摇匀。取5.0mL此液,置于100mL棕色容量瓶中,用环己烷稀释至刻度,摇匀得溶液A。
取5.0mL溶液A置于50mL棕色容量瓶中,用环己烷稀释至刻度,摇匀得溶液B。
2.2 测定 取溶液B在波长(455+1)nm和波长(483±1)nm处测定吸光度(A),A455/483的比值应为1.4~1.18。取溶液B在波长(455±1)nm处测定吸光度(A);与溶液A在波长340±1nm处测定吸光度A的比值A455×10/A340应不低于15。
二、β-胡萝卜素的含量测定
1.原理
β-胡萝卜素是共轭双键的化合物,在波长(455±1)nm处有最大吸收,样品溶液于该波长处测定吸收度,以标准百分吸收系数(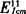 )计算质量分数。
)计算质量分数。
2.试剂和溶液
2.1 环己烷 分析纯。
2.2 样品溶液
溶液A:取0.05g样品,精密称定,置100mL棕色容量瓶中,加三氯甲烷10mL,先溶解,立即用环己烷稀释至刻度,摇匀。取5.0mL此液。置100mL棕色容量瓶中,用环己烷稀释至刻度,摇匀,即得。
溶液B:取5.0mL溶液A,置于50mL棕色容量瓶中,用环己烷稀释至刻度,摇匀,即得。
3.仪器
3.1 紫外分光光度计。
3.2 石英比色杯(1cm)。
4.操作步骤
取溶液B用适宜的紫外分光光度计,在1cm石英比色杯中,测定在波长(455±1)nm处的吸收度(A)。以环己烷为空白对照。
5.分析结果的表述
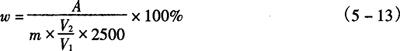
式中 w——样品中β-胡萝卜素质量分数,%
A——样品溶液吸收度读数
m——样品的质量,g
V1——样品稀释的总体积,mL
V2——测定用吸取样品溶液体积,mL
2500——β-胡萝卜素标准品的百分吸收系数(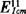 )
)
三、食品中β-胡萝卜素的测定
(一)第一法 高效液相色谱法
1.原理
样品中的β-胡萝卜素,用石油醚+丙酮(80+20)混合液提取,经三氧化铝柱纯化,然后以高效液相色谱法测定,以保留时间定性,峰高或峰面积定量。
2.试剂和溶液
2.1 石油醚 沸程30~60℃,分析纯。
2.2 甲醇 分析纯,需重蒸。
2.3 丙酮 分析纯。
2.4 己烷 分析纯。
2.5 四氢呋喃 分析纯。
2.6 三氯甲烷 分析纯。
2.7 乙腈 色谱纯。
2.8 三氧化二铝 层析用,100~200目,140℃活化2h,取出放入干燥器备用。
2.9 含碘异辛烷溶液 精确称取碘1mg,用异辛烷溶解并稀释至25mL,摇匀备用。
2.10 α-胡萝卜素标准溶液 精确称取1mgα-胡萝卜素(Sigma公司生产),加入少量三氯甲烷溶解,然后用石油醚溶解并洗涤烧杯数次,溶液转入25mL容量瓶中,用石油醚定容,浓度为40μg/mL,放入-18℃储存备用。
2.11 β-胡萝卜素标准溶液 精确称取β-胡萝卜素12.5mg于烧杯中,先用少量三氯甲烷溶解,再用石油醚溶解并洗涤烧杯数次,溶液转入50mL容量瓶中,用石油醚定容,浓度为250μg/mL,-18℃储存备用,二个月内稳定。根据新需浓度取一定量的β-胡萝卜素标准液用移动相稀释成100μg/mL。
2.12 β-胡萝卜素标准使用液 分别吸取β-胡萝卜素标准溶液0.5mL,1.0mL,2.0mL,3.0mL,4.0mL,5.0mL于10mL容量瓶中,各加移动相至刻度,摇匀后,即得β-胡萝卜素标准系列,分别含β-胡萝卜素5μg/mL,10μg/mL,20μg/mL,30μg/mL,40μg/mL,50μg/mL。
2.13 β-胡萝卜素异构体 精确称取1.5mgβ-胡萝卜素于10mL容量瓶中,充入氮气,快速加入含碘异辛烷溶液10mL,盖上塞子,在距20W的荧光灯30cm处照射5min,然后在避光处用真空泵抽去溶剂,用少量三氯甲烷溶解结晶,再用石油醚溶解并定容至刻度,浓度为150μg/mL,-18℃保存。
3.仪器
3.1 高效液相色谱仪。
3.2 离心机。
3.3 旋转蒸发仪。
4.测定方法
4.1 样品提取。
4.1.1 淀粉类食品:称取10.0g样品于25mL带塞量筒中(如果样品中β-胡萝卜素量少,取样量可以多些),用石油醚或石油醚+丙酮(80+20)混合液振摇提取,吸取上层黄色液体并转入蒸发器中,重复提取直至提取液无色,合并提取液,于旋转蒸发器上蒸发至干(水浴温度为30℃)。
4.1.2 液体食品:吸取10.0mL样品于250mL分液漏斗中,加入石油醚+丙酮(80+20)20mL提取,然后静置分层,将下层水溶液放入另一分液漏斗中再提取,直至提取液无色为止。合并提取液,在旋转蒸发器上蒸发至干(水浴温度为30℃)。
4.1.3 油类食品:称取10.0g样品于25mL带塞量筒中,加入石油醚+丙酮(80+20)提取。反复提取,直至上层提取液无色,合并提取液,于旋转蒸发器蒸发至干。
4.2 纯化 将4.1.1、4.1.2、4.1.3的样品提取液残渣,用少量石油醚溶解,然后进行氧化铝柱层析。氧化铝柱为1.5cm(内径)×4cm(高)。先用洗脱液丙酮+石油醚(5+95)洗氧化铝柱,然后再加入溶解样品提取液的溶液,用丙酮+石油醚(5∶95)洗脱β-胡萝卜素,控制流速为20滴/min,收集于10mL容量瓶中,用洗脱液定容至刻度。用0.45μm微孔滤膜过滤,滤液作HPLC分析用。
4.3 测定。
4.3.1 HPLC参考条件如下:
分析柱:大连化物所生产的spherisorbC18柱4.6×150mm
移动相:甲醇+乙腈(90+10)
流速:1.2mL/min
波长:448nm
4.3.2 样品测定:吸取4.2项下已纯化的溶液20μL,注入高效液相色谱仪,依法操作,从标准曲线查得或回归求得所含β-胡萝卜素的量。
4.3.3 标准曲线:分别注射标准使用液各20μL,进行HPLC分析,以峰面积对β-胡萝卜素浓度画标准曲线或进行回归。
5.分析结果的表述
5.1 计算:
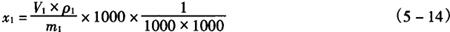
式中 x1——样品中β-胡萝卜素的含量,g/kg或g/L
V1——定容后的体积,mL
ρ1——样品中β-胡萝卜素的量(在标准曲线上查得),μg/mL
m1——样品的质量,g(mL)
5.2 本方法检出限 仪器检出限0.1μg。方法检出限5.0mg/kg(L)。标准曲线范围为0~100mg/L,方法回收率为88.8%~99.0%。相对标准差为2.4%。
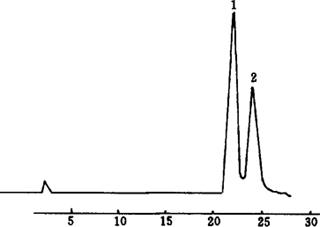
图5-4 α-、β-胡萝卜素色谱图
1—α-胡萝卜素 2-β-胡萝卜素
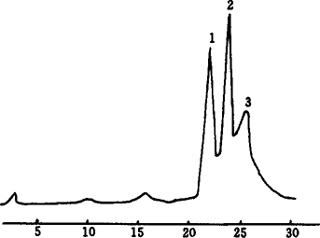
图5-5 α-、β-胡萝卜素异构体色谱图
1-α-胡萝卜素 2-β-胡萝卜素 3-β-胡萝卜素异构体
(二)第二法 纸层析法
1.原理
以丙酮和石油醚提取食物中的胡萝卜素及其它植物色素,以石油醚为展开剂进行纸层析,胡萝卜素极性最小,移动速度最快,从而与其它色素分离,剪下含胡萝卜素的区带,洗脱后于450nm波长下定量测定。
2.试剂和溶液
2.1 石油醚(沸程30~60℃) 同时是展开剂。
2.2 丙酮 分析纯。
2.3 丙酮-石油醚混合液 3+7(体积分数)。
2.4 无水硫酸钠 分析纯。
2.5 5%硫酸钠溶液。
2.6 1∶1氢氧化钾溶液 取50g氢氧化钾溶于50mL水。
2.7 无水乙醇 需经脱醛处理。
2.8 β-胡萝卜素标准溶液 取5mgβ-胡萝卜素标准品,溶于10mL三氯甲烷中,浓度为500μg/mL,准确测其浓度。
取标准溶液10.0μL,加3.00mL正己烷,混匀,测吸光度,比色杯厚度1cm,以正己烷为空白,波长为450nm,平行测定3份,取平均值。
2.9 分析结果的表述

式中 ρ——胡萝卜素标准溶液浓度,mg/mL
A——吸光度
E——β-胡萝卜素在正己烷中,波长450nm,比色杯厚度1cm,溶液浓度为1μg/mL的吸光系数为0.2638
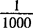 ——将μg/mL换算成mg/mL
——将μg/mL换算成mg/mL
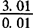 ——测定过程中稀释的倍数
——测定过程中稀释的倍数
2.10 β-胡萝卜素标准使用液 将已标定的标准溶液用石油醚准确稀释后,每毫升溶液相当50μg,避光保存于冰箱中。
3.仪器
3.1 实验室常用设备。
3.2 玻璃层析缸。
3.3 分光光度计。
3.4 旋转蒸发器 具150mL球形瓶。
3.5 恒温水浴锅。
3.6 皂化回馏装置。
3.7 点样器或微量注射器。
3.8 新华滤纸 定性,快速或中速101号。
4.样品的采集和处理
4.1 粮食 样品用水洗3次,置60℃烘箱中烤干,磨粉,储于塑料瓶中,放一小包樟脑精,盖紧瓶塞保存,备用。
4.2 蔬菜与其他植物性食物 取可食部分用水冲洗3次后,用纱布吸去水滴、切碎,用匀浆器制成匀浆,贮于塑料瓶内,冰箱内保存用。
5.测定方法(以下步骤需在避光条件下进行)
5.1 样品提取。
5.1.1 取适量样品,相当于原样1~5g(含胡萝卜素约20~80μg)的匀浆。粮食样品视其含胡萝卜素量而定,置100mL带塞锥瓶中,加入丙酮20mL,石油醚5mL,振摇1min,静置5min。将提取液转入盛有100mL5%硫酸钠溶液的分液漏斗中,再于锥形瓶中加入10mL丙酮-石油醚混合液,振摇1min,将提取液并入分液漏斗中,如此提取2~3次,直至提取液无色为止。
5.1.2 植物油和高脂肪样品:需先皂化,取适量样品(<10g),加脱醛乙醇30mL,再加10mL1∶1氢氧化钾溶液,回流加热30min。然后用冰水使之冷却,皂化后样品用石油醚提取,直至提取液无色为止。
5.2 洗涤。
5.2.1 将提取液(5.1.1)静置分层,弃去下层水溶液,反复用5%硫酸钠溶液振摇洗涤,每次约15mL,直至下层水溶液清亮为止。
5.2.2 将皂化后样品提取液(5.1.2)用水洗涤至中性。
5.2.3 将5.2.1或5.2.2的石油醚提取液通过盛有10g无水硫酸钠的小漏斗,漏入球形瓶,用少量石油醚分次洗净分液漏斗和无水硫酸钠层内的着色剂,洗涤液并入球形瓶内。
5.3 浓缩与定容 将上述球形瓶内的提取液于旋转蒸发器上减压蒸发,水浴温度为30℃,蒸发至约1mL时,取下球形瓶,用氮气吹干,立即加入2.0mL石油醚定容,备层析用。
5.4 纸层析。
5.4.1 点样:在18cm×30cm滤纸下端距底边4cm处作一基线,在基线上取A、B、C、D四点(见图5-6),吸取0.10~0.40mL浓缩液(5.3)在AB和CD间迅速点样。
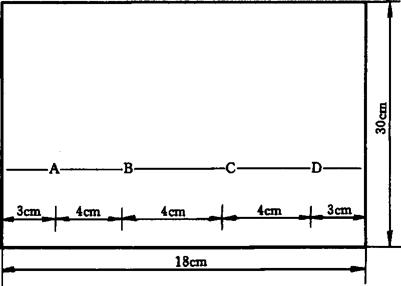
图5-6 点样示意图
5.4.2 展开:待纸上所点样自然挥干后,将滤纸卷成圆筒状,置于预先用石油醚饱和的层析缸中,进行上行展开。
5.4.3 洗脱:待胡萝卜素与其他色素分开后,取出滤纸,自然挥干石油醚,将位于展开剂前沿的胡萝卜层析带剪下,立即放入盛有5mL石油醚的具塞试管中,用力振摇,使胡萝卜素完全溶入溶剂中。
5.5 比色测定 用1cm比色杯,以石油醚调节零点,于波长450nm下,以其值从标准曲线上查出β-胡萝卜素的含量,供计算时用。
5.6 标准曲线绘制 取β-胡萝卜素标准使用液(浓度为50μg/mL)1.0mL,2.0mL,3.0mL,4.0mL,6.0mL,8.0mL分别置于100mL具塞锥形瓶中,按样品测定步骤进行操作,点样体积为0.100mL,标准曲线各点β-胡萝卜素含量为2.5μg,5.0μg,7.5μg,10.0μg,15.0μg,20.0μg。为测定低含量样品,可在0~2.5μg间加几点,以β-胡萝卜素含量为横坐标,以吸光度为纵坐标绘制标准曲线(见图5-10)。
6.分析结果的表述

式中 x3——样品中β-胡萝卜素的含量,以β-胡萝卜素计,mg/100g
m1——在标准曲线上查得的胡萝卜素的含量,μg
V1——点样体积,mL
V2——样品石油醚提取液浓缩后的定容体积,mL
m——样品质量,g
7.允许差
同一实验室平行测定或重复测定结果的相对偏差绝对值<10%。
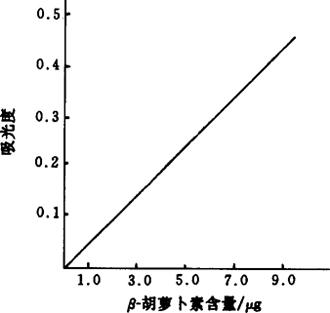
图5-7 胡萝卜素标准曲线图