烟酸的测定方法
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第275页(13494字)
化学名:氮苯酸-3;吡啶酸-3(nicotinic acid)。又名维生素pp,尼克酸
结构式:

分子式:C6H5NO2
相对分子质量:123.11
一、烟酸的鉴别
1.试剂和溶液
1.1 2,4-二硝基氯苯。
1.2 0.4%氢氧化钠溶液。
1.3 硫酸铜。
1.4 氢氧化钾。
2.操作步骤
2.1 取本品约4mg,加2,4-二硝基氯苯8mg,研匀,置试管中,缓缓加热熔化后,再加热数秒钟,放冷,加乙醇氢氧化钾试液3mL,即显紫红色。
2.2 取本品约50mg,加水20mL溶解后,滴加0.4%氢氧化钠溶液至遇石蕊试纸显中性反应,加硫酸铜试液3mL,即缓缓析出淡蓝色的沉淀。
2.3 取本品,加水制成每1mL中含20μg的溶液,照分光光度法测定,在波长262nm处有最大吸收峰,在波长237nm处有最小吸收;吸光度237nm与吸光度262nm的比值应为0.35~0.39。
二、烟酸含量的测定
取本品约0.3g,精密称定,加新沸过的冷水50mL溶解后,加酚酞指示液3滴,用0.1mol/LNaOH滴定液滴定。每1mL0.1mol/LNaOH滴定液相当于12.31mgC6H5NO2。
(一)高压液相色谱法
1.试剂和溶液
1.1 95%乙醇 特级。
1.2 60%高氯酸 特级。
1.3 高氯酸-甲醇溶液 向95mL0.003mol/L HClO4中加入5mL甲醇溶液。
1.4 0.003mol/LHClO4溶液 0.5mL高氯酸,加水成1000mL。
1.5 无水硫酸钠 特级。
1.6 甲醇 色谱纯。
2.仪器
高压液相色谱仪。
3.测定方法
3.1 样品溶液的制备 称取1~5g相当0.1~0.5mg烟酸的样品,放入50mL离心管中,加30mL乙醇混合,然后在超声波发生器中时时振摇,萃取15min后离心分离(10min, 3000r/min)。上清液倒入事先装有约10g无水硫酸钠的层析柱中,用200mL圆底烧瓶接收流出液。每次用30mL乙醇反复洗残渣及层析柱。然后在60℃水浴中减压浓缩,除去乙醇,再加入10mL高氯酸-甲醇溶液,然后放入超声波发生器中30s。溶解液移入50mL容量瓶中,残渣用上述方法反复处理,将全部溶解液合并,用10mL高氯酸-甲醇溶液稀释至刻度。过0.45μm膜,作为样品溶液。
3.2 标准液的制备 准确称量烟酸10mg,加水溶解成100mL,作为标准液(1mL相当于烟碱酸100μg)。分别吸取此液1mL、2mL、3mL、4mL、5mL,用高氯酸-甲醇溶液稀释至50mL,作为标准曲线用工作液(1mL分别相当于烟酸2μg、4μg、6μg、8μg、19μg)。
3.3 测定。
3.3.1 测定条件:高压液相色谱测定条件。
填充剂:化学结合型硅胶;
色谱柱:内径4.6mm,长15cm;
柱温:50℃;
洗脱液:高氯酸-甲醇溶液;
流速:1.0mL/min;
鉴定器:紫外,波长261nm。
3.3.2 标准曲线:分别取标准曲线用工作液10μL,注入高压液相色谱中,根据峰高绘制标准曲线。
4.分析结果的表述
取10μL样品溶液,注入高压液相色谱中,根据所得峰高在标准曲线上求出样品溶液中烟酸浓度,按式(9-65)计算样品中含量(mg/100g)。
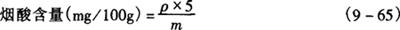
式中 ρ——样品溶液中烟酸浓度,μg/mL
m——取样量,g
(二)比色法
1.原理
烟酸在食物中常与其他化合物结合。样品经酸水解后,烟酸成游离态,利用它与溴化氰作用后可与对氨基苯磺酸产生黄色化合物,在一定条件下,颜色深浅与食物中烟酸含量成正比,可在波长440nm处,测其消光度与标准液比较。
2.试剂和溶液
2.1 标准烟酸溶液。
2.1.1 贮备液(100μg/mL):精确称取标准烟酸5.0mg(预先在有五氧化二磷的干燥器中过夜,暗室内贮藏),溶于25%乙醇溶液中,移入500mL容量瓶,并用25%乙醇溶液定容,贮存在10℃处。
2.1.2 中间液(10μg/mL):取部分贮备液,回至室温后吸10mL,用水定容至100mL。
2.1.3 工作液(4μg/mL):吸2mL贮备液,用水定容至50mL。
2.2 氨水 取5mL浓氨水,用水稀释至250mL。
2.3 盐酸(1→5)。
2.4 磷酸缓冲液pH8 溶解60g磷酸氢二钠,10g磷酸二氢钾于温水,稀释至200ml。
2.5 10%的溴化氰液 加热370mL水至40℃,加40g溴化氰结晶,摇匀,至溶解,冷却后稀释至400mL(在毒气柜中操作,注意其毒性),贮冰箱内。
2.6 10%对氨基苯磺酸 在170mL水中,加入20g对氨基苯磺酸,同时加氨水溶解,每次1mL,直至全部溶解,用1:1盐酸调节pH至4.5,以溴甲酚绿为外指示剂。
2.7 溴甲酚绿指示剂 称取0.1g溴甲酚绿,在研钵中研细,加2.8mL0.05mol/LNaOH溶液溶解,以水稀释至200mL,pH4时为绿色,pH5.8时为蓝色。
2.8 55%对氨基苯磺酸 加27mL水和27mL氨水于55g氨基苯磺酸,冷溶解,若不溶,可加热调节pH为7(用数滴氨水或5mol/L HCl溶液)稀释至100mL,贮于避光处。
2.9 1mol/L(1/2H2SO4)。
2.10 硫酸铵 分析纯。
3.仪器
分光光度计或比色计。
4.测定方法
4.1 以乳为主的婴儿食品。
4.1.1 抽提。
4.1.1.1 准确称取15~20g(要求在比色时抽提液中含烟酸3~4μg/mL)于1000mL三角瓶中,加200mL1mol/L( H2SO4)混匀。98kPa压力下,加热30min,冷却后用10mol/L〔
H2SO4)混匀。98kPa压力下,加热30min,冷却后用10mol/L〔 Ca(OH)2〕调节pH至4.5(用溴甲酚绿为外指示剂),加水稀释定容至250mL,过滤,备用。
Ca(OH)2〕调节pH至4.5(用溴甲酚绿为外指示剂),加水稀释定容至250mL,过滤,备用。
4.1.1.2 称取17g硫酸铵于50mL容量瓶内,准确加入上述过滤样液40mL,加水定容,猛烈摇匀,过滤,备用(测定样液)。
4.1.1.3 吸取工作液40mL于内有17g硫酸铵的50mL容量瓶,用水稀释定容,过滤,此标准含烟酸3.2μg/mL。
4.1.2 测定:按下列顺序分别加入溶液。
(1)标准液对照
1.0mL标准液
5.0mL水
0.5mL稀氨水(2.2)
2.0mL10%对氨基苯磺酸
0.5mL稀盐酸(2.3)
(2)标准液
1.0mL标准液
0.5mL稀氨水(2.2)
5.0mL溴化氰
2.0mL10%对氨基苯磺酸
0.5mL水
(3)样品对照液
1.0mL样品液
5.0mL水
0.5mL稀氨水(2.2)
2.0mL10%对氨基苯磺酸
0.5mL稀盐酸(2.3)
(4)样品液
1.0mL样品液
0.5mL稀氨水(2.2)
5.0mL溴化氰
2.0mL10%对氨基苯磺酸
0.5mL水
测定每一样品时应同时作一对照管,加试剂时应按次序一管加完比色后再加第二管,每加完一种试剂均应旋转试管、摇匀,溴化氰加完0.5min后再对加氨基苯磺酸,摇匀,塞好塞子。
4.1.3 比色:440nm,1cm杯。蒸馏水调零及满量程、测定标准液对照、标准液、样品液对照及样品液的吸光度,应反复测定多次,选择最大值,一般测定标准液及样品液的消光值最大值,费时较长。
溴化氰有剧毒,操作应在毒气柜中进行。
4.2 谷类婴儿食品。
4.2.1 步骤如下: 绘制标准曲线:准确吸取标准中间液(10μg/mL烟酸)0.0,5mL,10mL,15mL,20mL和25mL于6只250mL三角瓶内,三角瓶先加入1.5g氢氧化钙。然后每瓶均加水至90mL,在9.8kPa压力下水解2h。取出,冷却后,加水定容至100mL,放冰箱中过夜。
自每一量瓶吸取上清液50mL左右,移入离心管,再放冰浴15min或冰箱2h,取出离心15min,从每一离心管吸取上层清液20mL移入放有8g硫酸铵及2mL磷酸缓冲液的离心管中,摇匀,溶解,加热至55~60℃离心5min,过滤,若滤液不清,再过滤备用。
分别吸取上述不同浓度的标准抽提液各5mL,一式两份,移入甲、乙二组试管中,甲组作为标准液对照管,各加10mL水,所有管均置冰浴中30min,逐个取出进行测定;乙组标准液试管内分别加入10mL冷溴化氢液,摇匀,30s时再加1mL55%对氨基苯磺酸摇匀,再置冰浴数分钟,取出于波长470nm测定吸光度(以试剂空白校正管调零),标准液对照管则只需各加1mL55%氨基苯磺酸即可测定其吸光度。
以不同浓度的标准液的吸光度为纵坐标,以相应的烟酸微克数为横坐标绘制标准曲线。
4.2.2 样品测定:准确称取样品2.5~5g(约含100mg烟酸)于250mL三角瓶,瓶内预先加入1.5g氢氧化钙,加水90mL,在100kPa压力下水解2h,取出趁热摇匀,冷却后加水定容至100mL,放冰箱过夜,以下按4.2.1自“自每一量瓶中吸取上清液50mL……测定吸光度”依法操作,绘制标准曲线。样液测定与作标准曲线同时进行。
5.分析结果的表述
5.1 以乳为主的婴儿食品:

式中 ρ——所加标准溶液浓度,μg/mL
E0——样品液对照管的吸光度
E——样品液管的吸光度 ——标准液对照管的吸光度
——标准液对照管的吸光度
Es——标准液管的吸光度
m——样品质量,g
5.2 各类婴儿食品。
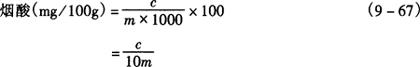
式中 m——样品质量,g
c——根据样液吸光度,从标准曲线上查出的烟酸微克数
三、肉与肉制品中维生素pp含量测定
1.原理
维生素pp经氢氧化钙溶液提取,与溴化氰结合,在对氨基苯乙酮作用下,生成黄色化合物,在波长420nm处有最大吸收。其吸光度与维生素pp浓度成正比,以此测定维生素pp含量。
2.试剂和溶液
2.1 维生素pp(尼克酸或尼克酰胺)标准溶液 1mg/mL。
精确称取维生素pp100mg,用5mol/L(1/2H2SO4)1mL溶解,转移到100mL容量瓶中,用水定容。在4℃冰箱内保存。
2.2 硫酸锌 饱和溶液。
2.3 溴化氰〔注〕 10%溶液。
2.4 对氨基苯乙酮 2%溶液。称取对氨基苯乙酮2g,用少量盐酸溶解,稀释至100ml。
2.5 氢氧化钙 1mol/L溶液。
2.6 氢氧化钠(GB629) 3mol/L、1mol/L溶液。
2.7 盐酸(GB622) 6mol/L溶液。
2.8 酚酞指示剂 1%乙醇溶液。
2.9 硫酸(GB625) 5mol/L、1mol/L溶液。
2.10 乙醇(GB679)。
2.11 戊醇。
注:溴化氰是剧毒试剂,应戴上手套在通风橱里配制。
3.仪器设备
3.1 实验室常规设备。
3.2 恒温水浴。
3.3 分光光度计。
3.4 绞肉机 孔径不超过4mm。
4.操作步骤
4.1 试样 取具有代表性试样200g,于绞肉机中至少绞2次,并使其混匀,在密闭容器中于4℃下贮存备用。
4.2 提取 称取试样2g(精确到0.001g)于三角瓶中,加1mol/LCaOH溶液10mL,水40mL,混匀后,在沸水浴上提取90min,冷却后移入100mL容量瓶中,定容。混匀过滤,滤液备用。
4.3 中和 吸取滤液25.00mI于50mL容量瓶中,加酚酞指示剂2滴,用6tool/L HCl
溶液中和至红色刚刚褪去。加入饱和硫酸锌溶液2mL及几滴戊醇(清泡剂),用3mol/L和
1mol/L NaOH溶液调至粉红色。滴加1tool/L(1/2HzSO4)溶液。使粉红色刚好褪去,水定容,
混匀,放置10min后过滤,滤液备用。
4.4 测定。
4.4.1 标准曲线的绘制:吸取维生素pp标准液0.25mL。,0.50mL,1.00mL,
2.00mL,2.50mL.分别于100mL.容量瓶中并定容,摇匀。浓度分别为2.5ug/mL,5.0ug/mL,
10.0ug/mL,20.0ug/mL,25.Oug/mL。 .
分别吸取上述稀释液1.00mL于具塞试管中,加水4mL,10%溴化氰溶液2m1.摇匀。置
60~70~C水浴中保温15min后,迅速冷却。加入2%对氨基苯乙酮溶液1mL,摇匀,在暗处放
置15min。在波长420nm处测定吸光值,以吸光值为纵坐标,维生素pp为横坐标绘制标准曲
线。
4.4.2 试样溶液的测定:吸取试样液5.00m1.于具塞试管中,加入10%溴化氰溶液
2mI。混匀。以下操作按4.4.1步骤进行。
5.分析结果的表述

式中 x——样品中维生素pp含量,mg/100g
m1——从标准曲线上查得维生素pp质量,μg
m0——试样质量,g
40——试样溶液的稀释倍数
当符合允许差所规定的要求时,取两次测定结果的算术平均值作为结果,精确到0.01μg/100g。
6.允许差
同一分析者同时或相继两次测定结果之差不得超过平均值的10%。
四、微生物法
1.原理
烟酸广泛存在于食物中,并常与其他化合物结合,在动物组织内又常以烟酰胺形式存在,烟酰胺为辅酶Ⅰ与辅酶Ⅱ的组成部分,此烟酰胺乃是一种生物活动形式。测定前,样品先经过酸、碱处理,游离出烟酸。利用阿拉伯乳酸杆菌对烟酰胺具有相等活性,用标准液对照测定。
2.试剂和溶液
2.1 菌种 阿拉伯乳酸杆菌。
2.2 不含维生素的酪蛋白 称取250g酪蛋白,放于5L容器中,慢慢加入3.6L水以防结块,加1mol/LHCl2.77mL,搅拌3min,用虹吸法除去上层清液,再加入3.6L水,1mol/LHCl2.77mL,如此反复3次后,再加入3.6L水,1.2mol/L氨水55.5mL,过夜,使酪蛋白溶解成浆状,用布过滤,滤液用1mol/LHCl调至pH4.5,使酪蛋白全部沉淀,过滤,除去水,用50~60℃热水冲洗沉淀几次,挤压去水,放烘箱烘干。
2.3 酸解酪蛋白 称50g不含维生素的酪蛋白,加200mL3mol/LHCl于98kPa压力下水解6h,水解物盛于蒸发皿内,在水浴上蒸发至膏状,加水溶解再蒸发,反复3次,以除去HCl(不可蒸干或焦糊),用氢氧化钠溶液调节pH至3.5,以溴酚蓝作外指示剂(pH2.6~4.6黄~蓝,pH3.5为紫色),加20g活性炭吸附至水解液为无色或略呈淡黄色,过滤,加水至500mL,加甲苯少许保存。
活性炭在pH3.5时,可吸附酪蛋白中的烟酸,脱色力也较强。
2.4 胱氨酸、色氨酸溶液 称4gL-胱氨酸、1gL-色氨酸(或2gDL-色氨酸)于800mL水中,加热至70~80℃,滴加20%盐酸,不断搅拌,直至完全溶解为止(约12mL),冷至室温,加水至1000mL。
2.5 腺嘌呤、鸟嘌呤、尿嘧啶溶液 称硫酸腺嘌呤、盐酸鸟嘌呤及尿嘧啶各0.1g于250mL烧瓶中,加75mL水及2mL浓盐酸,然后加热使其完全溶解,冷却。若有沉淀发生,加浓盐酸数滴,再加热,如此重复,直至冷却无沉淀发生为止,移入100mL容量瓶,用水定容。
2.6 混合液 D-泛酸钙、对氨基苯甲酸、盐酸吡哆醇各10mg,置1000mL容量瓶中,用水定容,保存于棕色瓶中。
2.7 核黄素、盐酸硫胺素、生物素溶液 溶解1mg生物素结晶(无酸者)于100mL0.02mol/LCH3COOH溶液中,取此液4mL(相当于40μg)于1000mL容量瓶中,加入20mg核黄素、10mg盐酸硫胺素,以0.02mol/LCH3COOH溶液定容,保存于棕色瓶中。
2.8 甲盐溶液 溶25g磷酸氢二钾和25g磷酸二氢钾于水中,加水至500mL,加少许甲苯保存。
2.9 乙盐溶液 10g硫酸镁(MgSO4·7H2O),0.5g硫酸亚铁(FeSO4·7H2O),0.5g硫酸锰(MnSO4·4H2O)溶于水,至500mL,加5滴盐酸,少许甲苯保存。
2.10 烟酸标准溶液。
2.10.1 贮备液:精确称取标准无水结晶烟酸50mg(在P2O5干燥器中过夜),以25%乙醇稀释,并定容至500mL(0.1mg/mL),加少许甲苯,保存于冰箱。
2.10.2 工作液:取贮备液1mL,用水稀释定容为1000mL(0.1μg/mL),用时现配。
2.11 基本培养贮备液。
水解酪蛋白 50mL
胱氨酸,色氨酸液 50mL
腺嘌呤,鸟嘌呤,尿嘧啶液 10mL
D-泛酸钙、对氨基苯甲酸,吡哆醇液 10mL
核黄素,盐酸硫胺素,生物素液 10mL
甲盐液 10mL
乙盐液 10mL
无水葡萄糖 10g
无水乙酸钠 10g
上列物质混合于1000mL容量瓶内,加水450mL,用浓氢氧化钠液调节pH至6.8,加水定容。
2.12 琼脂培养基。
乙酸钠(NaAc·3H2O) 1.7g
无水硫酸钠 1g
蛋白 0.8g
酵母提取物的干粉 0.2g
甲盐溶液 0.2mL
乙盐溶液 0.mL
琼脂 1.2g
称以上物质,加水至100mL,于水浴上加热至琼脂溶化,趁热调节pH至6.8,倒入试管,每管3~5mL,塞棉塞,灭菌(100kPa,10min),冷后存冰箱备用。
2.13 贮备菌种的制备 以Iact、A纯菌种接入2个或多个琼脂培养基管中;于(37±5)℃保温箱中16~24h;贮于冰箱至多不超过2星期,最好每星期移种一次,保存数星期以上的菌种,不能立即作制备菌种用,一定要在使用前每天移种一次,连续2~3天方可使用。
2.14 种子培养液 取基本培养基(2.11)5mL,加0.2μg/mL烟酸标准液5mL,装入15mL离心管中,塞棉塞,消毒(100kPa,10min)后,贮于冰箱备用(可贮放数星期)。
2.15 生理盐水 称9g氯化钠溶于1000mL水中,用时取出部分,在100kPa压力下,消毒10min。
2.16 0.04%溴麝香草酚蓝指示剂 称0.1g麝香草酚蓝于研钵中,加1.6mL0.1mol/LNaOH溶液,研磨,加水少许,至完全溶解,加水至250mL。
2.17 1mol/L( H2S04)。
H2S04)。
3.仪器设备
3.1 保温箱 37℃。
3.2 混浊度计或比色计。
3.3 压力锅(100kPa以上)。
3.4 离心机 3000r/min。
3.5 培养皿。
4.操作步骤
4.1 接种液的制备 使用前一天,将Iact、A菌种由贮备种管移种于已消毒的种子培养液中,同时制备两管,于37℃保温16~24h,不能超过24h。如不能按时接种,可将接种液取出放冰箱,24h可用。
于3000r/min离心10min,倾去上清液,用已消毒的生理盐水淋洗2次,再加10mL生理盐水,摇动,使菌种成混量体。
将此液吸入已消毒的注射器内,立即应用。
4.2 样品的制备 称取含烟酸0.2mg的样品,置于250mL烧瓶中,加1mol/L(1/2H2SO4)100mL,混合均匀,在100kPa压力下,加热30min。1mol/L(1/2H2SO4)水解足可使烟酸和其它物质结合链分开而游离出。
冷至室温,用氢氧化钠溶液调节pH至6.8,稀释到50mL,过滤,即可作分析用。
4.3 标准管的制备 在三组试管中,每管各加0.1μg/mL标准烟酸工作液:0.0,0.5mL,1.0mL,1.5mL,2.0mL,2.5mL和3.0mL。加水至5mL。各加5mL基本培养基(2.11)。
4.4 样品试液管的制备 二组试管中分别加入1mL、2mL、3mL、4mL样品试液;各加蒸馏水至5mL,各加基本培养基(2.1.1)5mL
4.5 消毒 标准管及样品管,塞上棉塞,于98kPa压力下,灭菌15min。
4.6 接种和培养 待试管冷至室温,所有试管温度相同,且均匀,混浊度测定更应注意。
每管接种一滴接种液,直接滴在培养液内,勿碰管壁,于37℃培养72h,最短可减少12h或延长18h,必要时可在冰箱保存一夜再滴定,若用混浊度法,以培养18~24h为宜。
4.7 滴定 将试管中培养液倒入50mL三角瓶中,用0.001%溴麝香草酚蓝溶液5mL,分2次淋洗试管,洗液倒入三角瓶中,以0.1mol/LNaOH溶液滴定,呈绿色即为终点,pH约6.8。以一瓶滴至终点的溶液作比较标准,30min后更换,时间久颜色变浅。
混浊度测定法,用混浊度计或640nm的比色计测定。
5.分析结果的表述
用不同浓度的标准烟酸液和滴定时所需的0.1mol/LNaOH毫升数,作标准曲线。
由样液滴定所需的0.1mol/LNaOH溶液毫升数在标准曲线上查出每管试液含烟酸量。
用不超过平均数10%的滴定值求出每毫升样液含烟酸量。

式中 ρ——样品提取液平均浓度,μg/mL
V——最终体积,mL
K——稀释倍数
m——样品质量,g