仲丁胺
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第320页(7650字)
结构式:
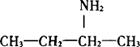
分子式:C4H12N
相对分子质量:74
一、概述
仲丁胺又名2-氨基丁烷(2-AB),为一无色液体,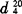 0.7241,沸点63℃,可与水、醇、醚及多种其他有机溶剂混溶。2-AB为一伯胺,碱性电离常数Kb=4.4×10-4(35℃),为较NH3稍强的碱。
0.7241,沸点63℃,可与水、醇、醚及多种其他有机溶剂混溶。2-AB为一伯胺,碱性电离常数Kb=4.4×10-4(35℃),为较NH3稍强的碱。
Eckert等在60年代初发现了2-AB的防腐作用,以后广泛应用于柑橘、苹果、梨等水果和土豆等的贮藏期防腐,也应用于花卉。市售的2-AB制剂为26%2-AB碳酸盐的水溶液(相当于含15.5%游离碱)或25%2-AB醋酸盐溶液。游离碱为液体,通常含2-AB98%。使用时是将游离碱或其制剂用水冲稀至含2-AB0.5%~1%。
二、仲丁胺的含量测定
(一)蒸馏一滴定法
1.原理
含有2-AB的待测溶液加NaOH至呈碱性,然后用常规方法蒸馏,馏出液被硼酸溶液吸收,该弱酸性盐用标准盐酸滴定。
2.试剂
2.1 1mol/LNaOH溶液。
2.2 40g/LH3BO3溶液。
2.3 0.1mol/LHCl标准溶液。
2.4 石蕊试纸。
2.5 甲基红指示剂。
3.仪器
蒸馏中均用标准磨口仪器,以防2-AB损失。
4.测定方法
4.1 蒸馏 将50.0mL待测溶液或10.0mL制剂加到一个500mL圆底烧瓶中,然后加入50mL1mol/LNaOH及100mL无离子水。加入沸石后进行蒸馏。量取100mL硼酸溶液于250mL量筒中,将冷凝器连好尾接管,使其浸入硼酸溶液内。
加热使烧瓶内溶液平稳沸腾,收集馏出液至量筒内的液面上升至200mL刻度处,拆开尾接管,用pH试纸由冷凝管下口测试馏出液的酸碱性,如蒸出液仍是碱性,则接好尾管再蒸出10~20mL溶液,直至馏出液呈中性即停止蒸馏(停止蒸馏时要注意防止倒吸)。
4.2 滴定 定量量取以上量筒中的溶液于500mL锥形瓶中,加5滴甲基红指示剂,用0.1mol/L HCl溶液滴定。终点时溶液颜色由绿变为蓝或紫色。
5.分析结果的表述
样品中的2-AB含量可用式(10-21)计算得出:
2-AB质量分数=c×V2×7.314/V1×100% (10-21)
式中 c——HCl的浓度,mol/L
V2——滴定用盐酸的体积,mL
V1——通过蒸馏处理的样品的总体积,mL
6.说明
蒸馏-滴定法对挥发性的强碱性胺的测定不很合适。从以上计算可以看出,所有滴定溶液都是由2-AB消耗的,而2-AB是一个极易挥发的物质。所以,在蒸馏过程中要避免2-AB的损失。所有仪器接口都要用活塞硅油密封。
(二)分光光度法
1.原理
稀的2-AB溶液与DNFB在硼砂缓冲溶液中反应生成N-仲丁基-2,4-二硝基苯胺(BDNA),水解除去多余的试剂,用环己烷抽提BDNA,然后用分光光度计在334nm处测定。
2.试剂和溶液
2.1 2-AB·HCl标准溶液 2-AB·HCl可很容易地由干燥氯化氢通入溶有2-AB的己烷溶液,抽滤,在110℃下干燥而制得。然后配制成相当于含有游离碱100和0.1μg/mL的盐酸盐溶液。(1.5g盐酸盐相当于1.0g游离碱)。
2.2 硼砂缓冲液 2.5g硼砂(Na2B4O7·10H2O)溶于100mL水中。
2.3 DNFB试剂 0.75mLDNFB溶于50mL光谱纯或二次蒸馏的二氧六环中。本试剂需在使用时当天配制。
2.4 2mol/L NaOH溶液 8g氢氧化钠溶于100mL水中。
2.5 环己烷 将500mL分析纯的环己烷通过装有40g硅胶(0.2~0.5mm)的柱进行纯制,弃去最初分出的25mL。
2.6 0.05mol/L Na2CO3溶液 5.3gNa2CO3溶于1L水中。
2.7 无水Na2SO4 分析纯。
3.仪器
3.1 水浴可以控温在(60±2)℃范围。
3.2 分光光度计。
4.测定方法
选择适当样品,以适于配制最终可稀释至2-AB浓度为1μg/mL的溶液。为测定质量分数需准确称量1g2-AB样品,置于一带塞的100mL锥形瓶中,连续以1∶100的水稀释2次,以得到1μg/mL的溶液。若为测定溶液中2-AB的质量浓度,可简单地稀释至约1μg/mL。
2,4-二硝基苯基化:吸取2份各10.0mL的标准溶液、水、样品溶液。分别置于25mL锥形瓶中,加入2mL硼砂缓冲溶液及2mLDNFB试剂于每一瓶中,摇动锥形瓶,并在60℃水浴中加热20min,然后加入2mL2mol/LNaOH溶液于每一瓶中,加热30min,以水解过量的试剂。
由水浴中取出锥形瓶冷至室温,迅速将反应液转移至125mL的分液漏斗中,吸取10.00mL纯制的环己烷于每一漏斗中,激烈振荡、分层、弃去水层,以每次15mL0.05mol/L(1/2Na2CO3)溶液洗涤环己烷萃取液3次。
将环己烷萃取液倾入干燥、洁净的25mL三角瓶中,用无水硫酸钠干燥,最后用1cm的石英比色杯在334nm下测量吸光系数,用纯制的环己烷作空白对照。
5.分析结果的表述
5.1 质量分数(w)
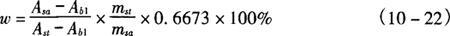
式中 Asa——样品溶液吸光系数
Ast——标准溶液吸光系数
Aa1——空白试剂平均吸光系数
mst——标准2-AB·HCl在100mL溶液中的重量,g
msa——样品质量,g
5.2 质量浓度ρ

式中 Asa、Ast、Abl和mst——与5.1中相同
D——样品的稀释系数
Vsa——样品溶液的体积,mL
6.说明
用高纯度(保证试剂)的二氧六环为DNFB的溶剂是必要的条件,这样可得到低的空白和好的重现性。如无光谱纯的二氧六环,则必须用加钠重蒸馏而得到的二氧六环。反应液的pH应十分严格,并必须加入硼砂缓冲液。在高pH时试剂会水解,同时造成2-AB的挥发损失。但这个反应在低pH下重复性很差。当纯制后的优级环己烷还不符合要求时,可用光谱纯的环己烷。
用Na2CO3溶液洗涤是为了除去二硝基苯胺,它可能是由于存在于样品中的NH3所生成的。N-仲丁基-2,4-二硝基苯胺不能被0.05mol/LNa2CO3溶液从环己烷溶液中萃取出来。
三、食品中仲丁胺的测定
2-AB的残留量分析有两个方法是可用的:一个是Kolbenzen等的分光光度法,利用DNFB与2-AB的反应。这个方法缺乏专一性,因为所有的伯胺、仲胺均可与DNFB反应生成有色的产物,并且有基本相同的吸收峰;另一个被推荐的方法是Day等所提供的方法,也是利用DNFB与2-AB作用形成DNP-2-AB,然后再利用薄层层析和带有电子捕获检测器的气相色谱仪联合使用,来达到具有选择性的目的。
1.原理
利用KD浓缩器将2-AB和其他易挥发的胺由细胞组织浆中分离出来,用CCl4洗涤除去一些干扰物质,然后进行2,4-二硝基苯基化,所形成的DNP衍生物必须先经薄层层析提纯,再利用带有电子捕获检测器的气相色谱仪测定2-AB的含量。
2.试剂和溶液
2.1 苯 分析纯。
2.2 乙醚 分析纯。
2.3 四氯化碳 分析纯。
2.4 己烷 分析纯。
2.5 氧化镁。
2.6 0.3mol/LNaOH溶液。
2.7 1mol/L(1/2CaCl2)溶液 将147gCaCl2·2H2O溶于水,然后稀释至1.0L。
2.8 0.05mol/L(1/2Na2CO3)溶液。
2.9 2mol/LNaOH溶液。
2.10 0.3mol/L(1/2H2SO4)溶液。
2.11 消泡60硅乳胶。
2.12 硼酸缓冲液(Na2B4O7·10H2O) 将2.5g硼砂(Na2B4O7·10H2O)粉末溶于100mL水。
2.13 DNFB试剂 0.75mL2,4-二硝基氟苯(蒸馏过的)溶于50mL光谱纯的二氧六环中(当天配制)。
2.14 环己烷 将500mL环己烷保证剂通过125mm长、直径25mm,用0.2~0.5mm硅胶填充的层析柱,弃去开始25mL,其余收集在一个干燥洁净的试剂瓶中。
2.15 标准溶液 将干燥氯化氢通入2-AB的环己烷溶液,过滤,在10℃干燥制得2-AB的盐酸盐,然后配成相当于100μg/mL和1μg/mL游离碱的2-AB盐酸盐溶液。1.5g2-AB盐酸盐相当于1g2-AB。
3.仪器
3.1 组织捣碎机。
3.2 水浴(可恒温60℃)。
3.3 KD浓缩器或体积大于200mL的普通蒸馏装置。
3.4 毛细移液管。
3.5 层析薄板 硅胶G0.25mm。
4.测定方法
4.1 样品处理 将全果或果肉、果皮的样品切成小块,在组织捣碎机中捣成浆状,将50g这样浆状样品放入800mLKD浓缩器中。为了加强样品的回收量,在一个50g对照果(未用2-AB处理的果)样品中加入1.0mL浓度为100μg/mL的2-AB标准样,这等于加入100μg2-AB(相当于200mg/kg)。转动KD浓缩器并使标准样与样品混合。在加试剂前静置2~3min,然后在瓶中依次加入75mL1mol/LCaCl2溶液,50mL水,5~10滴消泡剂和由10g氧化镁加50mL水制成的浆状物,最后用50mL水冲洗瓶壁。将瓶连在KD蒸馏装置或其他蒸馏装置上,然后进行有效的蒸馏。在一个装有10mL0.3mol/L(1/2H2SO4)的量筒内接收约80mL馏出液。如果需要,这个酸化了的馏出液可在密闭容器中放置几天而不影响测定结果。
4.2 二硝基苯基化 用0.3mol/LNaOH溶液将蒸馏液调至pH7(用pH计),然后用无离子水冲稀至100mL,取10mL此中性溶液放入一个小漏斗中。另用10.0mL10μg/mL2-AB标准溶液作为直接标准,用10.0mL无离子水作空白对照。每次用15mLCCl4洗涤,共洗3次,然后分别放入50mL的锥形瓶中。分别加5mL缓冲液和5mLDNFB试剂。将锥形瓶放在60℃水浴中加热20min,加2mL2mol/LNaOH,再加热30min。冷却后,将黄色溶液转移到125mL漏斗中,用10mL纯制过的环己烷萃取,弃去水层,每次用0.05mol/LNa2CO3溶液15mL洗涤环己烷层,共洗3次。最后将环己烷放入20mL锥形瓶中,加2g无水Na2SO4干燥。如果不需薄层层析,这溶液可直接进行色谱分析。
4.3 薄层层析 如果薄层层析是必要,将5mL环己烷溶液放入一梨形瓶或锥形离心试管中,小心地用气流蒸发溶剂,最后加0.5mL苯到容器中,并加转动以使样品溶解。迅速将100μL这个溶液点在TLC板上。另外也点100μL二硝基苯基直接标物在板上,以帮助确定所要斑点的位置,使用通常的薄层层析板,用己烷-乙醚(70∶30)为展开剂,不制饱和室。在板上标出DNP-2-AB斑点的区域。用少量玻璃棉堵在Pasteur毛细吸量管的收缩部分,用10mL氯仿轻洗吸量管的顶部并吸干,然后弄松板上所需部分的吸附剂并吸入吸量管,用约5mL氯仿在吸量管中洗提吸附剂,洗提液收集在一个瓶中,然后小心地用气流蒸发溶剂,才将残留物溶于1mL苯作气谱分析。
4.4 气谱分析。
气谱分析条件 6ft×0.25in硼硅酸盐玻璃柱;柱温188℃;填充剂:2%(质量分数)丁二酸二乙二醇酯(DEGS)气谱Q80~100目;
注射器温度250℃,电子捕获器温度210℃,氮气80mL/min,检测器电压26V。
用上面气谱条件进行,DNP-2-AB的滞留时间约为8min,分别测量试剂空白、对照样品(未用2-AB处理过的果实),加了标准样的对照样品、直接标准样和样品的相应峰高。试剂空白在二硝基苯基化物的滞留时间点应没有峰。计算回收率%用式(10-24),计算2-AB在样品中的残留量(μg/g)用式(10-25)。

式中 h——加了标准样的对照样品的峰高
hc—对照样品的峰高
hst——DNP-2-AB 直接标准样的峰高

式中 hsa——样品的峰高
5.说明
在用CCl4洗涤前,要求严格调整溶液的pH,如果pH大于8,则一部分2-AB就会被萃取出来,使回收率降低。用CCl4洗涤这一步对于某些品种的作物不是必需的。然而这一处理确能除去含于苹果、柑橘中的一些挥发性物质,这些物质可以产生复杂的气谱结果。因此为求得一致起见,对所有的样品均进行这一步处理。
薄层层析这一步是完成2-AB分析的唯一特殊要求。二甲胺是在气谱中唯一有干扰作用的低相对分子质量胺,它在某些水果中可能是内生的。但是,除非在测定的样品在DNP2-AB的滞留时间无峰或峰很小,则薄层层析这一步也可不作。另外,三种杀菌剂(福美铁、福美锌、福美双)在上述条件下可分解出二甲胺。如果确知在水果上已经使用过这三种杀菌剂,或是没有适当的样品作对照,就应该进行薄层层析这一步,以消除任何可能产生的假阳性。
本方法检出限量为0.1mg/kg。回收率在80%~100%。