澄清液冷却过程中的析盐规律
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第1582页(2474字)
澄清液中氯化镁和氯化钾的含量较高,氯化钠和硫酸镁的含量较少。氯化钠和硫酸镁在澄清液中是饱和的,光卤石是接近饱和的。为从澄清液中获得优质高产的光卤石,必须根据冷却过程中的盐类析出规律,确定出适宜的工艺条件。图6-2-14是Na+、K+、Mg2+//Cl-、SO42--H2O五元交互体系多温相图,可据以了解澄清液冷却过程中的析盐规律。
某澄清液的组成如下:
℃ ° Bé KCl NaCl MgCl2 MgSO4
100 36.8 42.52 22.09 440.65 16.3 (g/L)
换算成耶涅克指数为:
2K+ Mg2+ SO42- 2Na+ H2O
5.50 91.89 2.61 3.65 879.6

图6-2-14 Na+,K+,Mg2+//SO42-,C1--H2O体系光卤石结晶区多温图(25℃,50℃,75℃,100℃)
图中:1.干盐图上各大写字母的脚码表示温度,如Q100Z100表示100℃时NaCl、MgSO4·H2O、KC1·MgCl2·6H2O三盐共饱线.
2.干盐图上,KP为光卤石的固相点,S为MgSO4·H2O的固相点。
3.水图上各小写字母与干盐图上各大写字母为对应关系。
4.水图上KP为KCl·MgCl2·6H2O固相点,S′为MgSO4·H2O固相点。
5.Na盐图上,右上角有“,”的小写字母与干盐图上大写字母为对应关系。
将此澄清液的组成点标在图6-2-14上为P点。可以看出:在100℃和75℃两温度下,P点落在MgSO4·H2O的结晶区;在50℃和25℃两温度下,P点落在光卤石的结晶区。
(1)在100℃时:在水图上,P5点是在100℃时MgSO4·H2O开始饱和的界限点,而澄清液的体系点P0略在P5之上,说明此时MgSO4·H2O接近饱和,光卤石还没有饱和。
(2)在75℃时:在水图上,P3与P4之间为NaCl、MgSO4·H2O共饱阶段,P4与P3之间为NaCl、MgSO4·H2O和KCl·MgCl2·6H2O共饱阶段。P0是在P4与P3之间,说明澄清液冷却到75℃有上述三种盐析出。此时液相点应在N75Z75线段上(水图上为n75z75线段上)。应用相图作图法可确定液相点的位置为L75(在水图上为175)。
(3)在50℃时:P点落在光卤石的结晶区,在水图上P2P7线段为NaCl和KCl·MgCl2·6H2O二盐共饱阶段。而P0恰在P2P2线段上,说明澄清液冷却到50℃时,固相中只有NaCl和KCl·MgCl2·6H2O。此时对MgSO4·H2O并不饱和,故原来析出的MgSO4·H2O还要全部溶解在液相中。用作图法确定液相点为L50(在水图上为150)。
(4)在25℃时:P点落在光卤石结晶区,在水图上P1P6线段为NaCl和KCl·MgCl2·6H2O二盐共饱阶段,P0恰在P1P6线段上,澄清液冷却到25℃时只有NaCl和KCl·MgCl2·6H2O析出。用作图法确定液相点为L25(在水图上为l25)。
如果再继续降温,体系的液相点可能要达到C25,甚至达到Z25点。这时析出的固相不仅有NaCl,KCl·MgCl2·6H2O,还有MgCl2·6H2O,甚至有MgSO4·7H2O。
由以上分析可看出,澄清液在冷却过程中的析盐规律是:在开始降温阶段,只有NaCl和MgSO4·H2O析出;随后光卤石饱和析出;温度降至70℃以后,液相点离开NaCl,KCl·MgCl2·6H2O和MgSO4·H2O三盐共饱线进入光卤石结晶区,此时MgSO4·H2O已不饱和,原来析出的MgSO4·H2O全部又溶解于液相,以后的固相中只有NaCl和KCl·MgCl2·6H2O;再继续降温时,液相点逐渐靠近KCl·MgCl2·6H2O和MgCl2·6H2O两盐共饱线,温度低于25℃后,有析出MgCl2·6H2O或MgSO4·7H2O的可能性(至于这两种盐哪一种先析出,视P点的位置而定)。相图分析证明:冷却温度过高,不仅光卤石析出量少,而且还夹杂一部分MgSO4·H2O固相,降低了光卤石的质量;冷却温度过低,虽然光卤石析出较充分,但会有MgCl2·6H2O(或MgSO4·7H2O)析出,也影响光卤石的质量,同时消耗更多能量。在理论上,冷却温度控制在MgCl2·6H2O恰好饱和为最好。
澄清液冷却过程的试验数据,见表6-2-8。表中澄清液的成分、光卤石的成分及其与冷却温度的关系,与相图理论的分析结果基本相同。
表6-2-8 澄清液冷却至不同温度时,析出的光卤石及母液的成分
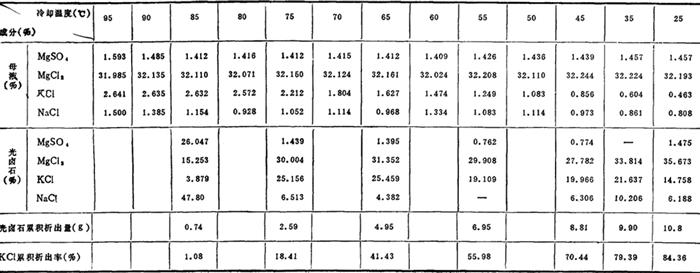
注:以95℃时100g澄清液为基准