大豆
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第416页(13735字)
胚发生细胞培养物是由胚性细胞所组成,问题在于了解为何某些细胞是胚胎发生的,或具有胚脂发生潜力的。当然,它们对适当刺激的反应,将能产生体细胞胚状体。典型是从培养基除去合成生长素2,4-D。实际应用上,并不要知道为什么如此,只要能识别出那类胚性细胞,和取得或产生大量那样的细胞或细胞团。由于我们虽然了解到“什么”和“如何”,但对“为什么”缺乏了解。虽已报道了多数种的体细胞胚胎发生,但并非所有栽培品种和任何生理状态或年龄的组织源都已知悉。材料预处理是取得成功的关键,曾有许多报道。但体细胞胚胎发生的一般学说也很重要,这就是增强学者的思维。本文叙述大豆具有形态建成能力的培养体的建成和行为,以及设计试验以揭示体细胞胚胎发生的一般学说。
(一)生理遗传学
近年来组织培养和植物生理学家评述了体细胞胚胎发生。涉及支配体细胞胚胎发生的实际因素:荷尔蒙、碳源、游离,pH等等。另一方面,遗传学家则涉及抽象因素,如控制体细胞胚胎发生的难捉摸的基因。尽管质量生化领域已知分子遗传学有巨大进展,分离和顺序化某些转录单位及其侧翼顺序区域仍迷茫无知。人们希望这些基因是用于合子胚胎发生过程的一个大的基因亚组。为什么在过去几百万年的选择,保留着人工培养下产生胚状体能力,如果这种能力不是由于基因对整株重要功能的多效性效应?人们期望着植物生理学家操作这些基因,引发合子胚胎发生的这个基因亚组。
这种基因作用的引发,可用形式遗传方法予以描述。Goldschmidt(1938)用通俗词讨论,Rendal(1967)采用数量方式表达。这个领域为之于“控制学说”,Riggs(1970)着书详加讨论。兹列例说明。
设想一个基因的活性,受“激活体”与特种“受体位置”相结合的控制。基因是否表达,为受体位置邻近的激活体浓度的支配(图19-1)。由于这种基因是受调整的,激括体的结合必须是易于回复的;激活体的结合常数,不可能是这种基因一经接触单个激活体分子就不可回复地激活了。在受体位置的“敏感”邻近区域的激活体浓度,随细胞而有不同,并随时间而有差异,任何一个细胞里是由于代谢变迁和随机分布,和随机混合。可是,这将以某种平均值而分布。
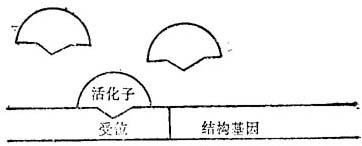
图19-1 正控制下的基因概略
为了结构基因转录,激活体分子必须与受体位置相结合。这种基因的活性,是其结合常休系的这种结合常数是不变值,这种基因活性是激活体分子局部浓度的直线函数。负控制下的基因,这种基因的失活是抑制者分子的局部浓度的直线函,实际基因受正和负效应子的复杂控制,
虽然由若干组分造成的人为变值分布,复杂调节系统也是如此。这种“激活体”使得基因激活,Rendal(1967)称之为“造成”那种理由。当然,将会遇到“造成”值过低,不是保持这种基因活化。这些值的最低上限是“造成”的上阈值,它把细胞分布分成二个亚群体:具有活化基因的细胞,和具有“钝化”细胞(图19-2)。
一个或一群细胞的“造成”平均值,能发生一定的改变。这可在外界条件影响下发生,或由于细胞内某种基因活化的结果。无论何种致因,最终结果相同:诸细胞与活化状态的特种细胞比率改变(图19-2b)。这是细胞分化的致因分子基础。最后分析中,这种少量代谢产物决定着基因活化与否。这些后生因素控制着诸基因的活与钝;基因产物“亚遗传的”因素实际参予着代谢。
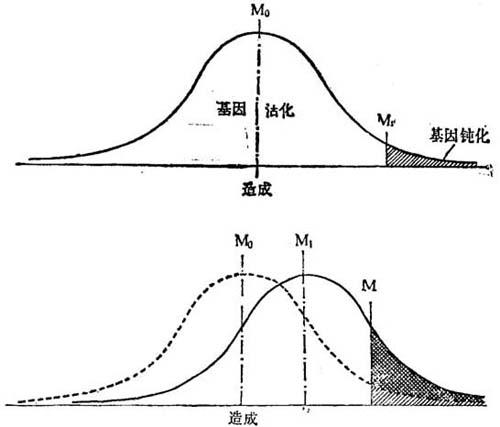
图19-2 基因活化分子的分布
(a)在个体细胞内,受体位点局部邻近的基因激活体的浓度,将因细胞而有异以及时间变化而改变。这种“造成”的分布,可用Gausian曲线表示,平均值为M0。将有“造成”的阀值Mt,把细胞分成二群,即具有活化和钝化基因的。
(b)细胞生理学变化,能使“造成”平均值从M0变迁到M′。围绕新平均数的分布,将保持Gausian曲线,结果是具有钝化(或活化)基因的细胞数增多(或减少)。这种图解指出一种小改变;一种大改变将发生相应的较大效应。
每个基因受若干因子组活化的若干基因的发育体系,不过是把这种“造成”的单向顺序,扩大成三向反应面。涉及的控制基因活化的全部参数,可分成3种结构变值,瓶内或组织内诸细胞内代谢状态的分布,以三向反应面代表之(图19-3)。Waddington(1977)描述了这类表象,叫“后生界面”,确属如此。它们是控制基因作用活一钝的细胞代谢状态(后生基因)的分布。

图19-3 一种后生遗传图象
3轴是控制植物代谢概念综合。反应面是植物细胞实际发生的值。发育或代谢变化可视为沿着这种面的移动.
这种3个轴描绘出一种体积,包含着全部代谢产物水平的无牵连的组合。这种体积的表面反应,表明着能实际发生的这类全部组合。这并不是说不会产生某种水平的氨基酸。而是说只有其它代谢产物存在某些水平组合下,能产生某种氨基酸水平。好比原子或分子轨道上有了电子的可得能量水平,才有复合体内代谢产物组诸水平的可能的“景象”,以调节行径。代谢产物浓度是分子方程体系的诸变值,如果有些是独立变值的话,其它一定变成依赖变值。一种代谢产物水平的改变,其它水平被迫变化。
当然,这种观念并非大多数植物生理学家的认识,但是这是动物发育生物学者所信任的传统。这也正是分类学家用于归纳大量调查(野外到试验小区)资料形成分类集团的方式。这种方法学及如何用于植物发育叙述于后。
这类反应面的构成和测验其性质,已产生了对植物代谢动力学的某些明确的和有用的认识。例如,它们阐明了某些后生遗传事项的性质。刻画出合理代谢途径的全部反应的化学平衡方程式,产生一种诸同类方程式系统。这些代谢产物浓度是变值,和速率常数是已知量。这些方程式描绘出全水平的中间和终点产物的生物学可能的组合。这些方程式组的解清可用三向反应面表示,已知具有Eigen值、最大值和最小值。某些最小值是“潜井”。其邻近面是如此陡削,邻近细胞“淹落”到底部,束缚在特定代谢状态。这是组织培养体充分认识的生物合成的自身永存状态,并从植物代谢的数学方式预测取得的。
依据反应面可阐明高等植物细胞全能性性质,以及在相同高等植物细胞定型和决定的共存性。毫无疑问高等植物存在着竞存和决定状态,是否在个体细胞水平也有存在,尚不完全明了。竞存性和决定性是发育状态,以对外界刺激的细胞或组织反应鉴定和表示之。竞存细胞有对一种诱导因素发生反应能力,成为被诱导的;在此条件下,能从一种状态转变成另一种状态。由此必将改变细胞竞存性。如果用相同诱变因素第二次处理,结果使状态2细胞变成状态2细胞,无有可见变化,不能判断这些细胞变成具有竞存性。可是,如果相同诱变剂第二次处理或用另一种诱变剂处理,导致细胞变成状态3,那末它们的竞存性可加以鉴别,由于2→3诱导。
一系列诱导的最后结果,是细胞决定在一种特定发育命运。这类细胞及其有丝分裂衍生物是预定的,能通过形态生长和分化过程,发育成为特定类型的特种细胞、组织或器官。所需要的是“表达它们的细胞表型”的引发。动物发育遗传学家称之为“许可一诱导”,前者是“定向诱导”,诱导竞存性细胞的直线连结。这是能以做到的重别识别。
Waddington(1977)认为决定性常发生于形态改变之前;分子生物学的进展,设想蛋白质和mRNA分子作为某些结构,并证实其存在于导致决定状态过程中。决定性是定向诱导结果,发生于结构改变之前,这是分子改变的直接结果。形态表达和生长是容许诱导结果,引起细胞表达其现实发育命运。二者的区别示之如图19-4。
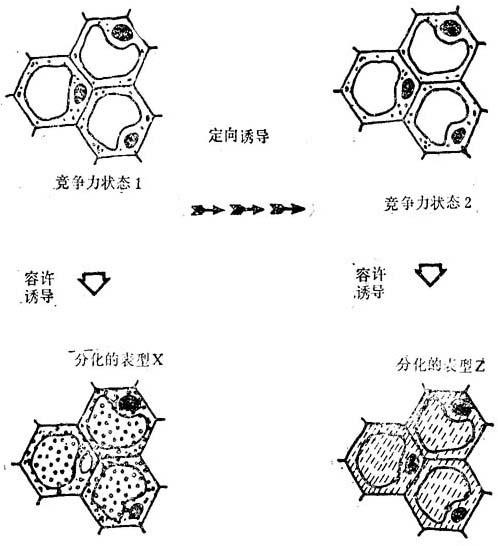
图19-4 定向和容许诱导
在定向诱导下,竞存性细胞将从状态1变成状态2。这是与竞存力改变相伴发生的,但细胞结构并无任何变化。容许诱导容许竞存性细胞表达一种分化的表型。细胞竞存力的现实状态决定着特种表型。这种分化的表型的形态表达,必须包含细胞结均变化.
那末全能性是什么?任何细胞的许可的全套生化或生理状态,可汇综成简单三向反应面,一种Waddington后生遗传图景。定向诱导沿着这种面移动。Waddington很适当地描写成沿着这种面移动的球。发育过程中顺序诱导步骤的全部连结刻画为从A点到点B的途径。这些途径有许多或可能是无限数的;有些是直线,有些是曲折的。
这类图象或是“表型固定化”现象的最好物理隐喻,发育过程对抗外力干扰的趋势。A到B的可能途径或途径片段,经过许多脊、鞍、或广阔平面,或“上坡”,将有一种高速下落。这些途径尚未很好沟通。随着时间的进展,自然选择将能保持沿着很好沟通通道的分路细胞的那些基因,而摈弃其它。
每个细胞——活体或人工培养的,是否分化,未分化或脱分化的,每任何已知时刻,具有特定的生化组分的景象;这就规定着它在反应面上的位置。外界因素如规定的化学培养基、生化变化和以某种启动推动力,使细胞走过反应表面。有些生理状态将使细胞集合;这些是反应表面上的低斑。有些生理状态使细胞陷落;这是潜井,反应表面的削壁孔,控制着自身永存、后生遗传、细胞的、生化的表型。
所有这种学说直接演变成细胞和组织培养体的实际操作。已报道了涉及培养基处方和预处理程序。细胞在反应面上启动动力的强弱和方向,是培养基成分的函数;细胞的起始点,是植株生理状态的函数。在个体细胞和由于外在培养基改变对细胞的格力推力的生化的随机变化影响下,细胞在反应面上全方位移动是可能的,除局部削壁穴或脊外,无论是空竭或置换。温度变化能在许多方式上改变反应面形状。沿着反应面自由移动是细胞全能性。
接受容许诱导信号,细胞将表达它们的现实发育潜势。这是细胞决定性。可猜想为地形图或在平面上投影的三方表面(图19-5)。某些类型细胞将决定胚胎发生,其它根发生;许多细胞的潜在发育将仅仅是“未分化”细胞的继续生长。作用于同一细胞样本的不同容许诱导信号,能实现很不同的形态改变;猜想是在前一平面上取直角的面上的三向面投影(图19-5)。这种容许诱导可能引起某些细胞变为假导管,其它成为高度液泡化的,还有其它如茎尖,这是“未分化”细胞继续生长以外的细胞变化。
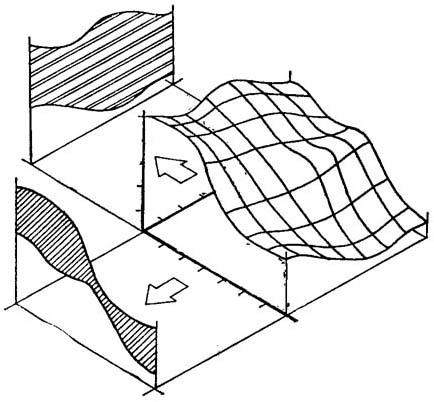
图19-5 容许诱导产生后生遗传图景的地形投影图
容许诱导对一组细胞生理的影响,可视作在平面上的二向反应面。从一个角度投影一个形,当沿着不同轴投影时,产生另一个形。这与植物细胞培养的2种不同容许诱导的不同后果相符:一种类型的紫苜蓿培养体转移结果产生胚状体,另一类型转移结果是根。
容许诱导性质是被动的;它使或容许对特种容许诱导剂发生反应的那些细胞发育状态的表达。定向诱导不是被动的;它使竞存性细胞从状态1转变成状态2。
(二)大豆胚性培养
由已知种产生体细胞胚状体的一系列操作方法的建立,尔后视细胞竞存性对容许诱导刺激的反应,产生体细胞胚状体,这种胚性培养与前述方法并无差别。但可分别启动培养状态和分别操作。
许多情况下,人工培养愈伤组织发育成不同表型。这些表型如“湿”、“粗糙”、“硬”、“紧密”和“玻璃质”,能继代在相同培养基上。它们能反映出不同发育潜势。例如,Tom Orton(1979)从大麦未成熟胚珠培养体产生的五种不同愈伤组织表型,观察到其中之一具有显着再生植株潜力。肉眼选择和培养这种表型变异体愈伤组织产生的培养体,用常规程序取得高效植株再生。
尽管各种豆科植物从外植体、愈伤组织或悬浮培养体已取得茎叶或再生植株成功,大豆细胞培养属已有报道,仅限于从下胚轴片段产生茎叶,复子叶芽和不完全体细胞胚胎发生。Phillips等(1981)和Gamborg等(1983)报道大豆培养体已能形成具有规律发育的体细胞胚状体,直到鱼雷形后期。最近Jack Widholm等(1983)从G.canesceus愈伤组织培养体形成茎叶。Christianson等报道是唯一的从G.max再生植株成功之例。从G.max cv、Mitchell2.5-3.0cm大豆荚取幼胚启动愈伤组织,除去子叶,将胚轴切成1-2mm片段,培养在MS+5mg/l2,4-D。诱导产生愈伤组织。几周后,取松脆部分转入新鲜培养基,仍加5mg/12,4-D。1个月后,继代在MS+2mg/1 IAA和0.2mg/l2ip,培养在低光强下约3个月。观察到许多愈伤组织表型,从白色松脆型到光滑、绿色、玻璃质型。后者象高度不正常胚轴1叫“新效形”(newmorphs)。将萱草新效形培养在加和不加2,4-D培养基一次循环,发育成高度形态建成的萱草培养体。当然这是Steward(1964)用野生胡萝卜培养体的研究:从第一次循环取胚,切成薄片,重复这种过程。采用相似轮回选择方案取得了大麦高度生根系和棉花形态建成培养体。大豆轮回选择的培养体,对不加2,4-D的反应,重现了新效体。培养3年后,细胞系继续形成胚状体,根和茎叶生长平衡。并无发育成真正的胚。并取得了具有形态建成竞存性的培养体,但其启动,容许诱导剂不怎样确切。扩大已用的物理性隐喻,好像三向反应面并非在平面上投影,但在斜面上投影的,在形虽在,轮廓已非。
Wernicke等(1982)把高粱或还有其它种的胚性培养体增殖体保持在小集团抑制原基状态。认为高水平2,4-D抑制分化或形态表达在竞存性状态。但是,已有足够论据,指出可从其它途径产生形态竞存性的抑制,相反,可由几方面启动。竞存性培养体产生体细胞胚。除去2,4-D可以完成,改变氮水平和改变细胞密度也能启动胡萝卜培养体的体细胞胚胎发生。这些启动途径,即使在显着量2,4-D下,将能产生胚状体。
紫苜蓿培养体体细胞胚胎发生需要高水平2,4-D,和转入不加2,4-D表达培养基启动之。Stuart等报道了NH4+和还原氮对紫苜蓿体细胞胚胎发生的促进效应。指出即使在适于发根的荷尔蒙范围内,高水平NH4+促进体细胞胚发育。Christianson等研究另一属的茎叶器官建成,有力地指出氮源对人工培养形态建成控制有关键作用。如果用柠檬酸铵,可全用NH4+,保持培养基的pH值。用20mM二碱基柠檬酸铵代替MS的40mM NH4+和20mM NO3-,诱导盖满许多小胚状体的半片组织。将这半片移入MS+5μg/l IBA和200μg/1 BAP发育成完整的体细胞胚,产生带有几个伸长节间的再生植株。放在柠檬铵2,4-D培养基进一步增殖,产生颗粒状悬浮培养体,并经系列继代而保持之。当将这种培养体从含2,4-D的“增殖培养基”移入无2,4-D的标准MS盐类表达培养基时,保留了形成胚状体能力。同样培养体仍能产生体细胞胚。用加和不加2,4-D再次循环培养,肉眼选择发育完整幼胚状体,切片,再培养在“增殖培养基,结果产生一种培养体,将能产生具有叶柄的子叶的体细胞胚,几乎确切地模拟着合子胚的子叶。由此产生根和茎叶平衡生长的再生植株。虽已成为常规操作,但效率仍不高。目前采用表达培养基:40g/l蔗糖,不加荷尔蒙。ABA或GA3、脯氨酸并无需要和助益。
(三)容许诱导
Christianson等把大豆培养物培养在不加2,4-D和以40mM NH4+代替MS的NH4+和NO3-,产生体细胞胚胎发生。指出单纯除去2,4-D,不足以启动大豆培养体的体细胞胚胎发生:把柠檬酸铵2,4-D培养体中的形态建成悬浮体转入柠檬酸铵无2,4-D培养基,结果并未产生胚状体和发育。
改变氮源是重要的。2,4-D+标准MS盐类,取得了形态建成悬浮体的亚系。转入表达培养基1周后产生少数反常胚状体。在标准MS盐类上4周后,转入表达培养基,产生透滑的绿色结构,但全无胚状体。最近研究晚期形态建成培养体,每周选择蜡质,黄-绿色、“胚原片”,除去快速生长的松脆白色愈伤组织,后者是培养在MS标准盐类上产生的,能延长胚性竞存性培养体。
含有40mM硝酸钾和柠檬酸铵增殖培养基,以及MS盐类加20mM柠檬酸铵,都有不利效应。反之,表达培养基中加20mM柠檬酸钾,并不能停止产生体细胞胚。有效转移是从40mM柠檬酸铵转入20mM NH4+加40mM NO3-。
但是,单纯改变氮源是不够的。“表达培养基”加5mg/12,4-D,并不能产生体细胞胚。生长素水平和氮源协调变化,是启动大豆竞存性培养物完整体细胞胚胎发生的关键(表19-1)。
表19-1 不同容许诱导剂对大豆竞争性培养物的效应用不同方式操作大豆的形态建成竞争性培养物,经直接观察胚状体发育的质量和范围,检测体细胞胚胎发生容许诱导剂的效果
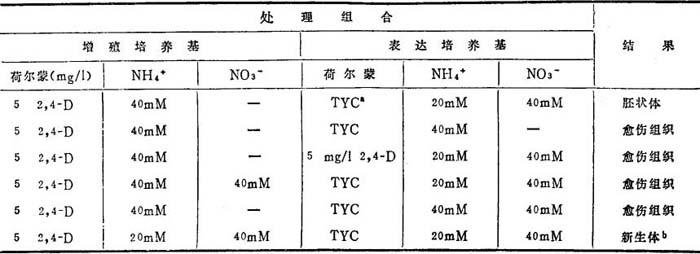
a.TYC=5μg/lIBA+200mg/1BAP。
b.新生体=反常胚状体类结构。
胡萝卜培养体,任何一种改变,可用作容许诱导剂,导致体细胞胚发生。玉米和紫苜蓿,单纯不加2,4-D,可满足容许诱导之需。但是,还原氮的特定类型和组合,能强烈地加强启动作用。大豆必须不加2,4-D和改变氮源。
易培养的起始材料如未成熟胚,结合选择非松散的、类胚结构,以及在加与不加2,4-D上轮回选择,能用以产生具有胚性竞存性的大豆培养体。由此产生的体细胞胚,在氮源与2,4-D水平协调改变下,有发芽和长成植株的能力。这显然是普遍现象:用同样方法处理豌豆培养物,偶有体细胞胚产生。采用更多次循环,是这种极端慢生长的培养体转变成可靠胚产生者所必需。
Sung(1981)采用不同单独启动剂,取得胡萝卜体细胞胚胎发生,以描绘出一组蛋白质与愈伤组织增殖和胚状体发育有密切联系。Christianson等设想双重启动大豆培养体体细胚胎发生,能以增进分子控制胚发育的了解。但这项研究着眼于容许诱导和联系到形态分化和生长。容许诱导剂作用必需的预处理是什么?是一种具有形态建成竞存性的培养体吗?如何研究“竞存性”和“抑制分化状态”的分化性质呢?
(四)研究竞争性方法
绘制三向反应面是研究“胚胎发生竞存性”的一种方法。此法简易,有益于鉴别细胞生化观点,这是胚胎发生竞存性的主要作用子。
绘制三向反应面需要做二件事:能测定少量植物组织的生化状态的显着部分,和能将每个样本的大量资料归纳成单点规定X,Y,Z坐标。运用分析生化和色谱能从很小样本的组织,测得每种氨基酸、糖类和有机酸的含量。这种大量复杂资料像手工收集的资料,能储存于计算机文库里,并发明了从中排列和抽取信息的途径。一种技术叫“多变值分析”,特别是“原则组分分析”。基本上是收集全部资料,算出全部互变量,从这些测定参数提炼出3种构成变值,这种“原则组分”。
事实上,这些“构成变值”,是原有变值的直线组合。首先,着眼于大多数变量,第二,着重于大多数遗漏信息,第三,注意大多数仍有遗漏的。剩余是“误差”。“误差”可以这种面的厚度表示。这种代谢资料的汇综点,能用作植物分类者曾采用的“Wagner树”。
设想一种平凡的胚性培养体,亚克隆成小培养体,各个地检测全部小量代谢产物谱,并对胚性竞存性作出数量评价(即计数每种继代培养物的胚性)。例如,John Cross等(1983),采用边缘胚原胡萝卜培养物,使之次无性系,检测每个次无性系的酚类化合物的量和种类,和胚性反应。可惜这组资料是次生植物代谢所得的,不是初生的。
分析Christianson的仍属猜想试验的相似资料,将能制成植物细胞生化的容许状态图。可将每个次无性系的胚性反应加在这种反应面上,并汇集相似水平,好比地球上的气压图(图19-6)。其最后结果,将是这些细胞内状态的很精确的描绘,与容许诱导反应中胚发育最为符合。
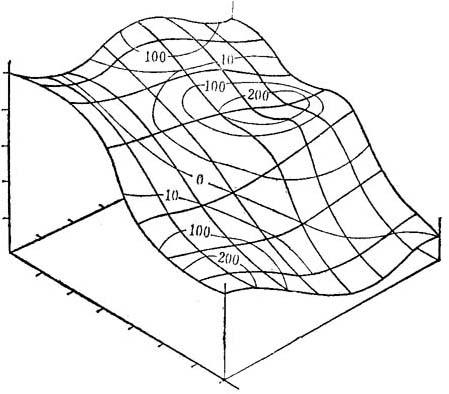
图19-6 细胞生理学的同源胚性图
广泛不同的胚原潜势的小继代体,能以检测经容许诱导后产生的实际胚数,和它们的小代谢产物的特定点象。这组资料经原则组分分析归纳成的3向面,是这类培养体可能的代谢状态的图象。加上继代体产生的实际胚数,能在这种面上构成同源(等)胚性等高线,很像气压加在地球图上。
设想有一个种的栽培品种虽能再生植株,则应可绘成图景。如果移动非再生栽培品种的细胞状态沿图线前进,能否达到整个种都可有效再生?果然如此,则这些小代谢产物的点象,是分子水平上的“决定”,以及基因作用不过是用于取得细胞从代谢状态A变成代谢状态Z。广大范围的种或科的基因的竞存性是小代谢产物的点象相似吗?把它们的细胞内代谢状态配合这类图象,能从所有种的任何年龄或生理状态再生植株吗?这可能是很正确的。甚至可能回答James Bonner(1965)的问题:“一个合子怎样能知道它是合子?”这种方法的突出优点,是可用于直接试验证实之。
【参考文献】:
〔1〕Boulter,D.and O.J.Crocomo 1979 Plant cel lculture implications::Legumes.In∶Plant Cell and Tissue Culture:Principles and Applications(W.R.Sharp,.VO.Larsen,E.F.Paddock,V.Raghavan,eds.)pp.615-631,Ohio State Univ.Press Columbus.
〔2〕Evans,A.M.and H.E.Gridley 1979 Prospects for the improvement of protein and yield in food legumes.Current Adv.Plant Cci.32∶1-17.
〔3〕Purseglove,J.W.1969 Tropical crops dicotyledon 1.Longmans,New York.
〔4〕Zaumeyer,W.J.and H.R.Thomas 1957 A monographic study of bean diseases and methods for their control.Technical Balletin 868,U.S.Dept.Agric.
〔5〕Cheng,T.Y.,H.Saka and T.H.Voqui-Dinh 1980 Plant regene ration from soybean cotyledoary node segments in culture.Plant Sei.lett.19∶91-99.
〔6〕Christianson,M.L.and D.A.Warnick 1983 Competence and dete rmination in the process of in vitro shoot organogenesis.Dev.Biol.95∶288-293.
〔7〕Christianson,M.L.and D.A.Warnick 1984 Phenocritical times in the process of in vitro shoot organogenesis.Dev.Boil.10∶382-390.
〔8〕CroSS,J.W.and W.R.Adams 1983 Phenvlic levels and embrgogenic potential in carrot cultures.Plant Physiol.72∶546.
〔9〕Kratochwil,K.1983 Embryonic induction.In∶Cellular Interactions and Development∶Molecular Mechanisms.K.M.Yamada.ed.Wiley,New York,pp.99-122.
〔10〕Ratner,V.A.and R.N.Tetthuteav 1978 Simplest genetic systems controlling ontogenesis∶Organization principles and models of their function.Pcog.Theor.Biol.5:81-127.
〔11〕Rendel,J.M.1967 Canalization and gene confrol Logos Press,Ltd.London.
〔12〕Riggs,D.S.1970 Cont rol Theory and Physiological Feedback Mechanisms.Williams and Wilkins Co.,Baltimore.
〔13〕Sneath,P.H.A.and R.R.Sokal 1973 Numerical Taxonomy:The Principles and Practice of Numerical Classifications.W.H.Freeman,San Francisco.
〔14〕Tyson,J.J.and H.G.Othmer 1978 The dynamics of feedback control circuits in biochemical pathways.Progress in Theor.Biol.5:1-62.
〔15〕Yusufov,A.G.1982 Origin and evolution of the phenomenan of regeneration in plant(problem of evolution ontogenesis).Usp.Soyrem.Biol.93∶89-104.
〔16〕Bajaj,Y.P.S.,A.K.Ram,K.S.Labana and H.Singh.1981 Regeneration of genetically variable plants from anther-derived callus of Arachis hypogaea and A.villosa.Plant Sci.Lett.23∶35-39.
〔17〕Bajaj,Y.P.S.,P.Kumar,M.M.Singh and K.S.Labana 1982 Interspecific hybr-idazation in the genus Arachis through embryo culture,Euphytica 31∶365-370.
〔18〕Smartt,J.and W.C.Gregory 1967 Interspecific cross compatibility between the cultivated peanut,Arachis hypogaea L.and other members of the genus Arachis.Oleagineux 22∶455-459.
〔19〕Spielman,I.V.,A.P.Burge and J.P.Moss 1979 Chromosome loss and meiotic behaviour in interspecific hybrids in the genus Arachis L.and their implications in breeding for disease resistance.Z.Pflanzenzuecht.83∶236-250.
〔20〕Wilson,C.T.1973 Peanut∶ Culture and Uses.American Peanut Research Education Association Stillwater,Oklahoma.
〔21〕Kartha,K.K.1981 Meristem culture and cryopreservation-Methods and applications.In∶Plant Tissue Culture(T.A.Thorpe,ed.)pp:181-211,Academic Press,New York.
〔22〕——1982 Cryopreservation of germplasm using meristem and tissue culture。 In:Application of Plant Cell and Tissue Culture to Agriculture and Industry。(D.T.Tomes,B.E.Ellis,P.M.Harney, K.J.Kartha,and R.L.Peterson,eds.)pp.139-161,Univ.of Gulph,Ontario.
〔23〕Mroginski,L.A.and K.K.Kartha 1984 Tissue culture of legumes for crop improvement.In:Plant Bteeding Reviews,vol.2(J.Janicked.)pp.215-264.AVI Pllblishing,Westport,Corn.
〔24〕Wetter,L.R.and F.Constabel(eds.)1982 Plant Tissue Culture Methods.Nationai Resea rch Council of Canada,Saskatoon.