电极电位的测定
出处:按学科分类—自然科学总论 山东人民出版社《方法大辞典》第164页(850字)
每个化学电池都是由两个电极组成的,在电池反应过程中,在一个电极里进行失去电子的反应,即氧化,称为负极;另一个电极里进行获得电子的反应,即还原,称为正极。
电池的电动势是两个电极电位的代数和。电极电位的大小决定于电极的性质和溶液中有关离子的活度,它服从能斯脱(Nernst)公式:

式中φ°为标准电极电位,即离子活度均为1时的电极电位;n是氧化态和还原态间得失电子的数目;是法拉弟常数;R是气体常数;T是绝对温度。
由于实验上不能测定单个电极的电位,只能测定由两个电极组成的电池的电动势。
即不能测定单个电极电位的绝对值,只能测定对于标准电极的相对值。
现在国际上采用的标准电极是标准氢电极,其结构如图所示,即将镀铂黑的铂片插入含有氢离子的溶液中,并且不断地用氢气冲击铂片,氢气在气相中的分压为1大气压,溶液中氢离子的活度等于1,这样的氢电极就作为标准氢电极,其电极电位规定为零。
对于任意给定的电极,使其与标准氢电极组成电池(设已消除液体接界电位),根据测得的电动势,就可以计算出待测电极的电位了。
因为电池的电动势等于正极的电位减去负极的电位,所以若待测电极为正极,则其电位值就等于测得的电动势值;若为负极,则等于测得电动势的负值。
在实际工作中,由于氢电极要求条件比较苛刻,使用起来并不简便。为此,常使用一种易于制备、使用方便、电位稳定的电极作为二级标准,称为参比电极。使用时只要将参比电极与待测电极组成电池,测量其电动势,就可以计算出待测电极的电位。常用的参比电极有甘汞电极、银-氯化银电极等。
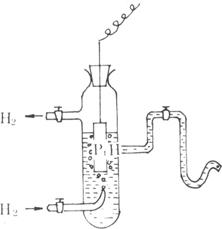
图 标、准氢电极