麻风杆菌抗原的淋巴细胞转化试验
出处:按学科分类—医药、卫生 科学普及出版社《麻风病实验室工作手册》第169页(1866字)
以ML为抗原的淋巴细胞转化试验(淋转)是检测麻风病特异性细胞介导免疫反应的试管内方法。试验阳性的先决条件是被检者的外周血中存在已被ML致敏的T细胞。在某些病原微生物于细胞内寄生的传染病中,患者对特异性抗原的淋转阳性反应出现在抗体阳性之前,因此淋转可以作为诊断早期感染的免疫学方法。Godal于70年代初应用ML淋转观察了从非麻风流行区进入流行区(阿的斯亚贝巴)的人员,起初试验都是阴性,但数月到一年后,一部分人转变成阳性,首次从实验室证实了ML亚临床感染的存在。麻风患者对ML的淋转反应与麻风菌素试验相平行,即从TT向LL由高向低分布。但是在各型中,特别是BT患者,个体值的差异很大。淋转的这种现象与皮损的活跃程度相关。皮肤红肿、炎症显着者,淋转反应强。在Ⅰ型麻风反应时,淋转反应很强,随着麻风反应消退而显着减弱,所以淋转反应的强弱不仅反映了宿主的保护性免疫力,也与DTH反应密切相关,显示了保护性免疫和DTH反应的分离状态。
淋转的免疫反应过程很复杂,除了在周围血中有被抗原致敏的淋巴细胞是先决条件外,还牵涉到巨噬细胞对抗原的呈递、白细胞介素-Ⅱ(IL-Ⅱ)、血清因素、不同T细胞亚群针对不同抗原决定簇的反应等多种因素。因而淋转成为研究众多免疫因子,包括病原微生物的不同抗原成份对细胞免疫反应影响的一种基础实验。淋转对实验室的技术和条件要求很高,些微改变都可能影响结果,异批实验之间的差异很难控制。所以,淋转虽然对麻风病的基础免疫理论和临床研究都是一个很重要的实验室方法,但对受检者来说,一次淋转试验阳性或阴性的报告,并不足以解释临床上有何种意义。
应用于淋转试验的抗原有完整ML、超声粉碎ML、菌壁、糖抗原等。用不同形式的抗原所做的淋转试验的结果可以不同,例如在有逆向反应的病人中,反应如以皮肤损害为主,淋转阳性主要见以完整ML为抗原的实验;反应如以周围神经损害为主,淋转阳性以超声粉碎ML抗原为主。ML与其它分枝菌在抗原成份上有广泛的交叉反应,如能纯化ML抗原的不同成份作淋转实验,对了解宿主与病菌的免疫反应定有重要帮助。
实验方法如下:
1.抗原制备 ML可取自感染犰狳所提供的菌,也可取自未经治疗的LL-BL型患者皮损,经无菌操作切取后,去除脂肪和刮去表皮,于平皿内将组织剪碎。以1克组织加等渗盐水10毫升在冰浴内制成匀浆,离心130×G10分钟,将沉淀再匀浆,再次离心去沉渣。合并两次所得悬液离心9000×G20分钟,4℃。弃上清,沉淀用少量培养液混悬计菌,按所需浓度调节,常先配成109条菌/毫升。如果用超声粉碎菌作抗原,将洗涤过的菌以RPMI 1640培养液或Hanks缓冲盐液将菌混悬,冰浴中粉碎处理15分钟,使菌悬液呈半透明胶状液,用量按含菌当量计算。
血中单个核白细胞分离 取静脉血脱纤维或肝素化(20~50微米/毫升)后,用两倍Hanks缓冲液稀释,轻轻加在约一倍量的白细胞分离液(Ficoll)上,离心400×G,30分钟。取界面液,将所得单个核细胞洗涤后用培养液调节浓度。
2.培养 常用培养基为RPMI1640,加混合人AB型血清至10%浓度,加2mM麸氨酸,青霉素100单位/毫升和链霉素100微克/毫升。将细胞浓度调整为1×106/毫升,于96孔培养板上,每孔加0.1毫升(1×105)细胞悬液。抗原用量的大小与淋转结果关系很大,需用2~3种浓度,一般每孔加入0.05毫升培养液调整的含菌0.5×106~0.5×107条.对照孔加等量培养液.。于5%CO2,37℃,100%湿度,使pH维持在7.2~7.3,培养5天,然后加入1微居里(μci)的氚--胸腺嘧啶。18小时后将混悬的细胞培养液回收于玻璃纤维滤膜上,继以蒸馏水洗,干燥,置闪烁液于液闪烁仪读数。每个数据得自3个重复孔的cpm(每分钟计数)匀值。计算方法以淋转净值(△cpm)法为宜,即将抗原孔的cpm减去对照孔的cpm。△cpm≥5000可考虑定为阳性阈值。考虑到ML抗原与其它分枝菌的交叉反应性,Closs等的实验采用以PPD1.0微克/毫升作为对照孔的抗原。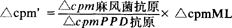 抗原,此法能提高ML淋转的特异性。
抗原,此法能提高ML淋转的特异性。