食品中铁化合物的测定方法
出处:按学科分类—工业技术 中国轻工业出版社《食品添加剂分析检验手册》第178页(14123字)
一、乳酸亚铁
化学名:乳酸亚铁(Ferrous Lactate)
分子式:C6H10FeO6·3H2O
结构式
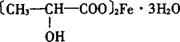
相对分子质量:288.04(无水物)
1.乳酸亚铁的鉴别
1.1 试剂和溶液。
1.1.1 铁氯化钾试液:1g铁氰化钾[K3Fe(CN)6]溶于10mL水。本试液用时现配
1.1.2 盐酸稀试液:本试液含氯化氢(HCl)10%(W/V)。取盐酸(36%)226mL,用水稀释并定容至1000mL。
1.1.3 氢氧化钠试液:取氢氧化钠(NaOH)4.3g,溶于水,定容至100mL。本试液约为1mol/L。
1.1.4 高锰酸钾试液:采用0.1mol/L高锰酸钾标准液(每1000mL含高锰酸钾3.161g)。
1.1.5 溴试液:系溴的饱和溶液。在一玻塞瓶中盛100mL冷水,加溴(Br2)2~3mL,摇震。塞子用石蜡密封。贮于阴冷暗处。
1.1.6 硫酸稀试液:本试液含H2SO410%(W/V)。取硫酸(95%~98%)或硫酸试液57mL.细心地加入约100mL水中,冷却至室温,用水稀释至1000mL.本试液约2mol/L。
1.1.7 氨的浓试液:本试液系指氨的饱和水溶液(浓氨水), 含量28%~30%之间,相当于15mol/L。
含量28%~30%之间,相当于15mol/L。
1.2 测定方法。
1.2.1 亚铁盐:在亚铁盐溶液中加铁氰化钾试液,即发生蓝色沉淀。该沉淀不溶于稀盐酸,但可被氢氧化钠试液分解。亚铁盐溶液遇氢氧化钠试液即产生青白色沉淀,摇动后呈色迅速变为青色,进而变为棕色。
1.2.2 乳酸盐:乳配盐溶液用硫酸酸化后,加高锰酸钾试液,混合后加热,即有特殊气味的乙醛挥发出来。
取相当于含乳酸5mg的乳酸盐溶液5mL,放于一试管中,加溴试液1mL和稀硫酸试液0.5mL,于水浴上加热,并用玻璃棒小心搅拌至褪色后,加硫酸铵4g,混匀,沿管壁逐滴加入10%亚硝基铁氰化钠的稀硫酸溶液0.2mL和浓氨试液1mL,放置30min后,分成两层,在两液层的界面处有一暗色环出现。
2.总铁含量测定
2.1 试剂和溶液。
2.1.1 硝酸:分析纯。
2.1.2 盐酸:分析纯。
2.1.3 碘化钾:分析纯。
2.1.4 硫代硫酸钠(GB637):分析纯。0.1mol/LNa2S2O3标准溶液,称取26g硫代硫酸钠及0.2g碳酸钠,加入适量新煮沸过的冷水使之溶解,并稀释至1000mL,混匀,放置1个月后过滤备用。
2.1.5 标定:试剂和溶液。
2.1.5.1 0.5%淀粉指示液:称取0.5g可溶性淀粉,加入约5mL水,搅匀后缓缓倾入100mL沸水中,随加随搅拌,煮沸2min,放冷,备用。此指示液应临用时新制。
2.1.5.2 量取4mol/L(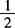 H2SO4)10mL,慢慢倒入80mL水中。
H2SO4)10mL,慢慢倒入80mL水中。
2.1.6 标定步骤:
2.1.6.1 精密称取约0.15g在120℃干燥至恒量的基准重铬酸钾,置于500mL碘瓶中,加入50mL水使之溶解。加入2g碘化钾,轻轻振摇使之溶解。再加入20mL4mol/L(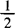 H2SO4),密塞,摇匀,放置暗处10min后用250mL水稀释。用硫代硫酸钠标准溶液滴至溶液呈浅黄绿色,再加入3mL0.5%淀粉指示液,继续滴至蓝色消失而呈亮绿色。反应液及稀释用水的温度不应高于20℃。
H2SO4),密塞,摇匀,放置暗处10min后用250mL水稀释。用硫代硫酸钠标准溶液滴至溶液呈浅黄绿色,再加入3mL0.5%淀粉指示液,继续滴至蓝色消失而呈亮绿色。反应液及稀释用水的温度不应高于20℃。
2.1.6.2 同时做试剂空白试验。
2.1.6.3 计算:硫代硫酸钠标准溶液的浓度按式(9-1)计算:

式中 c——硫代硫酸钠标准溶液的浓度,mol/L
m——基准重铬酸钾的质量,g
V1——硫代硫酸钠标准溶液用量,mL
V2——试剂空白试验中硫代硫酸钠标准溶液用量,mL
0.04903——每毫摩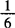 K2Cr2O7的质量,g/mmol
K2Cr2O7的质量,g/mmol
2.1.7 可溶性淀粉(HGB3095):1%溶液。溶解1g可溶性淀粉于100mL水中,煮沸。
2.2 测定方法。
精确称取本品约2g于瓷皿中,缓缓加热炭化,加硝酸2mL,蒸发干燥后(注意:不使液体溅出),再在550~600℃直到炭化完全(约3h)。残留物中加盐酸10mL,然后煮沸至不溶物几乎成白色,加水至30mL,过滤,用水洗不溶物,洗液和滤液合并,再加水定容至100mL,吸取25mL至碘量瓶中,加碘化钾4g,塞上瓶塞子,于暗处放置15min,加水100mL,用0.1mol/LNa2S2O3溶液滴定,滴至淡黄色时加1%淀粉液1mL,继续滴定至终点(淡黄色刚好消失)。同时做空白试验。
2.3 分析结果的表述 总铁含量按式(9-2)计算:
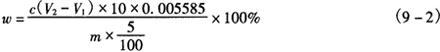
式中 V1——滴定空白消耗0.1mol/LNa2S2O3溶液钠体积,mL
V2——滴定样品消耗0.1mol/LNa2S2O3溶液体积,mL
c——Na2S2O3溶液浓度,mol/L
m——样品质量,g
0.005585——每毫摩铁离子的质量,g/mmol
3.亚铁含量测定
3.1 试剂和溶液。
3.1.1 高锰酸钾(GB643):分析纯,0.1mol/L(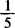 KMnO4)标准溶液。称取约3.3g高锰酸钾,加100mL水,煮沸15min,加塞静置2天以上,用垂融漏斗过滤,置于具玻璃塞的棕色瓶中密塞保存。
KMnO4)标准溶液。称取约3.3g高锰酸钾,加100mL水,煮沸15min,加塞静置2天以上,用垂融漏斗过滤,置于具玻璃塞的棕色瓶中密塞保存。
3.1.2 标定:精密称取约0.2g在110℃干燥至恒量的基准草酸钠。加入250mL新煮沸过的冷水、10mL硫酸,搅拌使之溶解。迅速加入约25mL高锰酸钾溶液,待褪色后,加热至65℃,继续用高锰酸钾溶液滴定至溶液呈微红色,保持30s不褪色。在滴定终了时,溶液温度应不低于55℃。同时做空白试验。
高锰酸钾标准溶液的浓度按式(9-3)计算:

式中 x——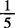 KMnO4标准溶液的浓度,mol/L
KMnO4标准溶液的浓度,mol/L
m——基准草酸钠的质量,g
V1——高锰酸钾标准溶液用量,mL
V2——试剂空白试验中高锰酸钾标准溶液用量,mL
0.0670——每毫摩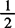 NaC2O4质量,g/mmol
NaC2O4质量,g/mmol
3.1.3 磷酸(GB1282):分析纯。
3.1.4 硫酸(GB625):分析纯。
3.2 测定方法 精确称取样品0.5g于三角瓶中,加入蒸馏水100mL,磷酸5mL,摇匀,再加浓硫酸5mL,摇匀,加2~3滴二苯胺指示剂,用0.1mol/L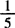 KMnO4标准溶液滴定至淡红色30s不褪为止。
KMnO4标准溶液滴定至淡红色30s不褪为止。
3.3 分析结果的表述 亚铁含量(w)按式(9-4)计算:
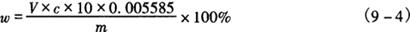
式中 V——滴定消耗高锰酸钾体积,mL
c——高锰酸钾标准溶液浓度,mol/L
m——样品质量,g
0.005585——每毫摩亚铁质量,g/mmol
二、柠檬酸铁铵
化学名:柠檬酸铁铵(Ferric Ammonium Citrate)
分子式:Fe(NH4)2H(C6H5O7)2
相对分子质量:488.16
1.柠檬酸铁铵的鉴别
1.1 试剂和溶液。
1.1.1 盐酸:分析纯。
1.1.2 高锰酸钾:0.3%溶液。
1.1.3 氢氧化钠:4%溶液。
1.1.4 硫酸汞试液。
1.1.5 0.3%高锰酸钾溶液。
1.1.6 柠檬酸铁铵。
1.2 操作步骤。
1.2.1 灼烧本品0.5g,残渣溶于稀盐酸(1+3),应呈铁盐反应。
1.2.2 10%本品溶液5mL,加0.3mL0.3%高锰酸钾溶液及4mL硫酸汞试液后,加热煮沸,应产生白色沉淀。
1.2.3 取本品0.5g,溶于5mL水中,加4%氢氧化钠试液5mL,应生成红棕色沉淀。将此混合物加热,则放出氨气。
2.柠檬酸铁铵的含量测定
2.1 试剂和溶液。
2.1.1 柠檬酸铁铵。
2.1.2 硫酸:分析纯。
2.1.3 高锰酸钾:分析纯。
2.1.4 盐酸:分析纯。
2.1.5 碘化钾:分析纯。
2.1.6 0.1mol/LNa2S2O3溶液。
2.1.7 淀粉指示剂。
2.2 测定方法 取本品约0.5g,精密称定,置具塞锥形瓶中,加水15mL溶解后,加硫酸1mL,加热至溶液由暗棕色变成淡黄色,放冷至约15℃,滴加高锰酸钾试液至溶液显粉红色并持续5s,加盐酸15mL与碘化钾试液15mL,密塞,静置3min,加水50mL稀释后,用0.1mol/LNa2S2O3溶液滴定至近终点时,加淀粉指示液2mL,继续滴定至蓝色消失,并将滴定的结果用空白试验校正。每毫升的0.1mol/LNa2S2O3滴定液相当于5.585mg铁。
三、柠檬酸铁
化学名:柠檬酸铁(Ferric Citrate)
结构式
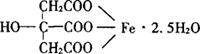
分子式:FeC6H5O7·2.5H2O
相对分子质量:244.95
1.柠檬酸铁的鉴别
1.1 试剂和溶液。
1.1.1 盐酸:分析纯。
1.1.2 硝酸:分析纯。
1.1.3 亚铁氰化钾:分析纯。
1.1.4 柠檬酸铁。
2.操作步骤
本品呈柠檬酸盐和铁盐反应。
2.1 柠檬酸盐反应 见柠檬酸。
2.2 铁盐反应 本品水溶液加入10%新配制的亚铁氰化钾溶液,产生蓝色沉淀。再加稀盐酸(1+3)或稀硝酸(1+9),沉淀不溶。
四、富马酸亚铁
化学名:富马酸亚铁(Ferrous Fumarate)
别名:富血铁
结构式
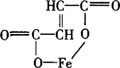
分子式:C4H2FeO4
相对分子质量:169.91
(一)富马酸亚铁的鉴别
1.试剂和溶液
1.1 富马酸亚铁
1.2 盐酸:分析纯。
1.3 碳酸钠:分析纯。
1.4 0.02mol/L(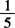 KMnO4)高锰酸钾溶液。
KMnO4)高锰酸钾溶液。
1.5 硫酸:分析纯。
1.6 间苯二酚:分析纯。
1.7 氢氧化钠:分析纯。
1.8 10%铁氰化钾溶液。
1.9 1%邻二氮菲乙醇溶液。
2.操作步骤。
2.1 取本品2g,加盐酸溶液(1+8)100mL,加热使之溶解,冷却、过滤,沉淀以盐酸溶液(1+100)洗涤3次,每次5mL,再用水洗至滤液无色。在105℃干燥后,取出适量,加水制成每毫升含5μg的溶液。将溶液在分光光度计测定,在波长206±1nm处有最大吸收。
2.2 取2.1中沉淀0.1g,加碳酸钠试液(10+100)2mL,溶解后,加0.02mol/L(1/5KMnO4)试液数滴,即呈褐色。
2.3 取本品50mg,加间苯二酚100mg,置瓷蒸发皿中混匀,加硫酸3~5滴,缓缓加热至成暗红色半固体状,置冷,加水25mL,过滤。取滤液1mL,加水10mL,摇匀,溶液呈橙红色,并有绿色荧光。再加4.3%氢氧化钠试液数滴使呈碱性,溶液即呈红色,并有荧光。
2.4 取2.1中溶液,加10%铁氰化钾试液,即产生深蓝色沉淀,分离,沉淀在稀盐酸(23.4+100)中不溶,但加氢氧化钠试液,即分解成棕色沉淀。
2.5 取2.1中溶液,加1%邻二氮菲的乙醇溶液,即呈沉红色。
(二)富马酸亚铁的含量测定
1.试剂和溶液
1.1 富马酸亚铁。
1.2 硫酸:分析纯。
1.3 邻二氮菲指示液。
1.4 硫酸铈。
2.测定方法
取本品约0.3g,精密称定,加稀硫酸15mL,加热溶解后,放冷,加新沸过的冷水50mL与邻二氮菲指示液2滴,立即用0.1mol/L硫酸铈滴定液滴定,并将滴定结果用空白试验校正。每毫升0.1mol/L硫酸铈滴定液相当于16.99mgC4H2FeO4。
五、葡萄糖酸亚铁
化学名:葡萄糖酸亚铁(Ferrous Gluconate)
结构式:
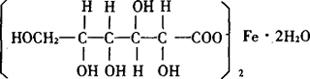
分子式:C12H22O14Fe·2H2O
相对分子质量:482.18(二水物),446.15(无水物)
(一)葡萄糖酸亚铁的鉴别
1.试剂和溶液
1.1 葡萄糖酸亚铁。
1.2 冰乙酸。
1.3 苯肼。
2.操作步骤
2.1 在5mL温热的10%本品溶液中加冰乙酸0.65mL和新蒸馏的苯肼1mL,在蒸汽浴上加热30min,冷却后用玻璃棒刮擦容器内壁,应生成葡萄糖酸苯肼结晶。
2.2 5%本品溶液呈亚铁盐反应 见硫酸亚铁鉴别方法。
(二)葡萄糖酸亚铁的含量测定
1.试剂和溶液
1.1 葡萄糖酸亚铁。
1.2 1mol/L(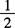 H2SO4)溶液。
H2SO4)溶液。
1.3 锌粉。
1.4 邻二氮菲指示液。
1.5 0.1mol/L硫酸铈溶液。
2.测定方法
精密称取本品约1.5g,置具塞锥形瓶中,加水75mL与1mol/L(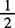 H2SO4)溶液15mL,溶解后,加锌粉0.75g,密塞,放置约20min,直至溶液脱色。用铺有锌粉的4号垂熔漏斗过滤,除去沉淀,滤器用新沸过的冷水20mL洗涤,洗液与滤液合并,加邻二氮菲指示液0.2mL,用0.1mol硫酸铈滴定液滴定,至溶液由橘黄色转变为绿色,并将滴定结果用空白试验校正。每毫升硫酸铈滴定液(0.1mol/L)相当于44.61mgC12H22FeO14。
H2SO4)溶液15mL,溶解后,加锌粉0.75g,密塞,放置约20min,直至溶液脱色。用铺有锌粉的4号垂熔漏斗过滤,除去沉淀,滤器用新沸过的冷水20mL洗涤,洗液与滤液合并,加邻二氮菲指示液0.2mL,用0.1mol硫酸铈滴定液滴定,至溶液由橘黄色转变为绿色,并将滴定结果用空白试验校正。每毫升硫酸铈滴定液(0.1mol/L)相当于44.61mgC12H22FeO14。
六、硫酸亚铁
化学名:硫酸亚铁(Ferrous Sulfate)
分子式:FeSO4·7H2O
相对分子质量;151.91(无水物),278.02(七水物)
(一)硫酸亚铁的鉴别
本品呈现亚铁盐反应和硫酸盐反应。
1.试剂和溶液
1.1 10%铁氰化钾溶液。
1.2 盐酸。
1.3 4%氢氧化钠溶液。
1.4 硝酸。
1.5 10%氯化钡溶液。
2.鉴别方法
2.1 亚铁盐反应 本品水溶液加新配制的铁氰化钾溶液(10%),即产生深蓝色沉淀。沉淀不溶于稀盐酸(1+3),但可被4%氢氧化钠溶液分解。
2.2 硫酸盐反应 本品水溶液加氯化钡试液(10%)即产生白色沉淀,沉淀不溶于盐酸或硝酸。
(二)硫酸亚铁的含量测定
1.试剂和溶液
1.1 硫酸亚铁。
1.2 硫酸。
1.3 0.02mol/L(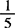 KMnO4)溶液。
KMnO4)溶液。
2.测定方法
取本品约0.5g,精密称定,加稀硫酸与新沸过的冷水各15mL溶解后,立即用0.02mol/L(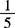 KMnO4)滴定液滴定,至溶液显持续的粉红色。每毫升的0.02mol/L(
KMnO4)滴定液滴定,至溶液显持续的粉红色。每毫升的0.02mol/L(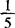 KMnO4)滴定液相当于27.80mgFeSO4·7H2O。
KMnO4)滴定液相当于27.80mgFeSO4·7H2O。
七、食物中铁、镁、锰的测定方法
(一)原子吸收分光光度法
1.原理
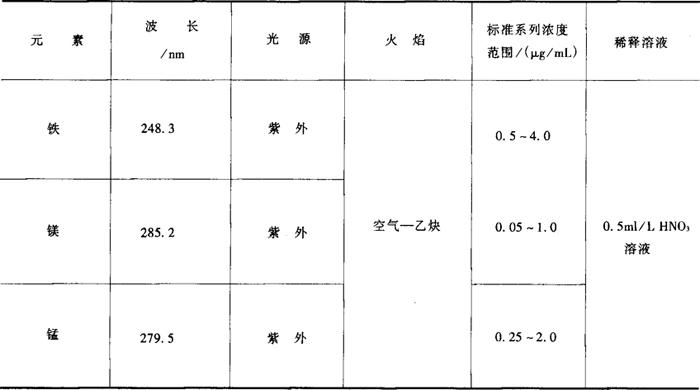
样品经湿消化后,导入原子吸收分光光度计中,经火焰原子化后,铁、镁、锰分别吸收248.3nm、285.2nm、279.5nm的共振线,其吸收量与它们的含量成正比,与标准系列比较定量。
2.试剂和溶液
要求使用去离子水,优级纯试剂。
2.1 盐酸(GB622)。
2.2 硝酸(GB626)。
2.3 高氯酸(GB623)。
2.4 混合酸消化液 硝酸与高氯酸比为4∶1(体积比)。
2.5 0.5mol/L HNO3溶液 量取45mL硝酸,加去离子水并稀释至1000mL。
2.6 标准溶液 精确称取金属铁、金属镁、金属锰(纯度大于99.99%)各1.0000g,或含1.0000g纯金属相对应的氧化物。分别加硝酸溶解,移入3只1000mL容量瓶中,加0.5mol/LHNO3溶液,并稀释至刻度。贮存于聚乙烯瓶内,4℃保存。此三种溶液每毫升分别相当于1mg铁、镁、锰。
2.7 标准应用液 标准使用液的配制如表9-1所示。
表9-1 标准使用液配制
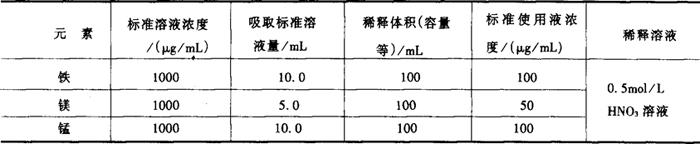
标准使用液配制后,贮存于聚乙烯瓶内,4℃保存。
3.仪器
所用玻璃仪器均以硫酸-重铬酸钾洗液浸泡数小时,再以洗衣粉充分洗刷,后用水反复冲洗,最后用去离子水冲洗晒干或烘干,方可使用。
3.1 实验室常用设备。
3.2 原子吸收分光光度计。
4.测定方法
4.1 样品处理。
4.1.1 样品制备:微量元素分析的样品制备过程中应特别注意防止各种污染。所用设备如电磨、绞肉机、匀浆器、打碎机等必须是不锈钢制品。所用容器必须使用玻璃或聚乙烯制品。
湿样(如蔬菜、水果、鲜鱼、鲜肉等)用水冲洗干净后,要用去离子水充分洗净。干粉类样品(如面粉、奶粉等)取样后立即装容器密封保存,防止空气中的灰尘和水分污染。
4.1.2 样品消化:精确称取均匀样品干样0.5~1.5g(湿样2.0~4.0g,饮料等液体样品5.0~10.0g)于250mL高型烧杯中,加混合酸消化液20~30mL,上盖表皿。置于电热板或电沙浴上加热消化。如未消化好而酸液过少时,再补加几毫升混合酸消化液,继续加热消化,直至无色透明为止。加几毫升去离子水,加热以除去多余的硝酸。待烧杯中的液体接近2~3mL时,取下冷却。用去离子水洗并转移于10mL刻度试管中,加去离子水定容至刻度。
取与消化样品相同量的混合酸消化液,按上述操作做空白试验测定。
4.2 测定 将铁标准使用液配制不同浓度系列的标准稀释液方法如表9-2所示,测定操作参数如表9-3所示。
表9-2 不同浓度系列标准稀释液的配制方法
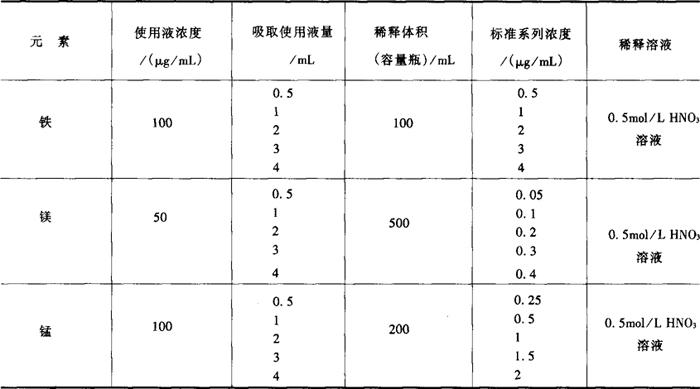
表9-3 测定操作参数
测定用样品液及试剂空白液由标准曲线查出浓度值(ρ及ρ0),再按式(9-5)计算。

式中 x——样品中元素的含量,mg/100g
ρ——测定用样品中元素的浓度(由标准曲线查出),μg/mL
ρ0——试剂空白液中元素的浓度(由标准曲线查出),μg/mL
V——样品定容体积,mL
f——稀释倍数
m——样品质量,g
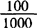 ——折算成每百克样品中元素的含量,mg
——折算成每百克样品中元素的含量,mg
4.3 回归方程法 由各元素标准稀释液浓度与对应的吸光度计算出回归方程也可输入计算器得出回归方程)。计算接式(9-6)进行:
ρ=ay+b (9-6)
式中 ρ——测定用样品中元素的浓度(可由计算器直接得出),μg/mL
a——曲线斜率
y——元素的吸收度
b——曲线的截距
由回归方程或计算器得出测定样液及试剂空白液的浓度后,再由式(9-7)计算。
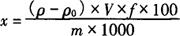
式中各符号的含义同曲线法说明。
4.4结果的重复性 同实验室平行测定或连续两次测定结果的重现性小
最低检测限:0.2μg/mL。
(二)硫氰酸钾法
1.原理
样品经灰化处理后,铁的氧化物用盐酸溶解,三价铁与硫氰酸钾生成红色的硫氰酸盐。其呈色深浅与含铁的浓度成正比。利用此红色进行比色测定。
2.试剂和溶液
2.1 20%硫氰酸钾 称取20g硫氰酸钾(分析纯),溶于100mL蒸馏水。
2.2 2%过二硫酸钾(K2S2O7) 称取2g过二硫酸钾溶解于100mL蒸馏水。
2.3 铁标准溶液 精确称取0.0498g硫酸亚铁(FeSO4·7H2O)溶于100mL蒸馏水中,加上5mL浓硫酸,微加热。随即滴加2%高锰酸钾至最后一滴颜色不变为止。然后,以蒸馏水稀释到1000mL,此溶液每毫升相当于含铁10μg。
3.仪器
分光光度计。
4.测定方法
4.1 样品处理 精确称取1~2g样品,移入干净的瓷坩埚中,在电炉上微火炭化,再移入灰化炉中,慢慢升温到500℃灰化至白色灰烬。如果有黑色炭粒,则加少量蒸馏水,将灰分溶解,在水浴上蒸干,再加0.5~1.0mL过氧化氢,亦须在水浴上蒸干,继续灰化至白色。将样品的灰分加入5mL1∶4盐酸,在水浴上蒸干。再加5mL于电热板加热溶解残渣,随即移入25mL容量瓶中,再用热蒸馏水洗涤坩埚3~4次,洗液移入容量瓶中,冷却稀至刻度,备用。
精确吸取铁标准溶液:0.0、0.2mL,0.4mL、0.6mL、0.8mL、1.0mL(相当于铁的含量0,2μg、4μg、6μg、8μg、10μg)置25mL比色管中,加0.5mL浓硫酸,以蒸馏水稀释,使最终体积为5mL(可先加蒸馏水后加硫酸),冷却后,依次加入0.2mL2%过硫酸钾、2mL20%硫氰酸钾,以蒸馏水稀释至10mL。用1cm比色皿,于波长485nm处在分光光度计上比色测定。以消光度为纵坐标,铁的含量为横坐标绘制标准曲线。
4.2 样品测定 精确吸取样品液1~5mL,置于25mL比色管中,其余操作步骤与上述标准曲线相同,同样作试剂空白。
其他实验条件:仪器狭缝、空气及乙炔的流量、灯头高度、元素灯电流等均按使用的仪器说明调至最佳状态。
将消化好的样液、试剂空白液和元素的标准浓度系列分别导入火焰进行测定。
4.3 标准曲线法 以各浓度系列标准溶液与对应的吸光度绘制标准曲线。铁、镁、锰的标准曲线如图9-1、图9-2和图9-3所示。它们的线性相关系数分别为0.9996,0.9998,0.9991。
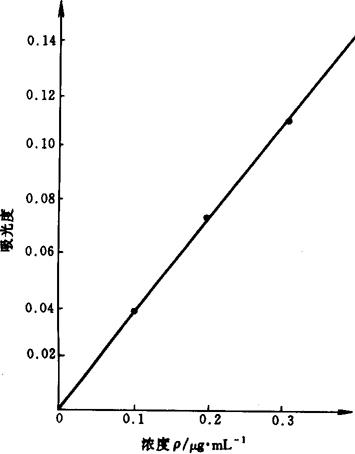
图9-1 铁的标准曲线
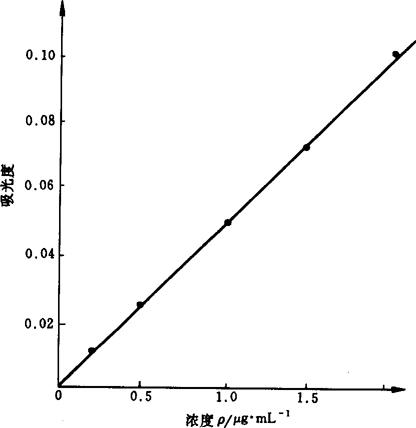
图9-2 镁的标准曲线
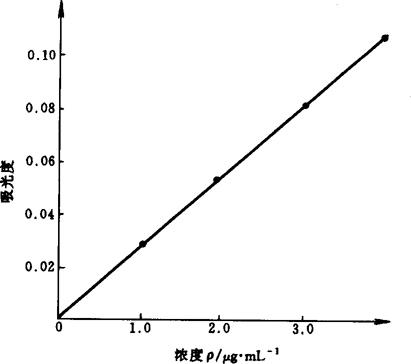
图9-3 锰的标准曲线
5.分析结果的表述

式中 x——铁的含量,mg/100g
m1——从标准曲线上查得样品中铁的质量,μg
m2——从标准曲线上查得空白试剂中铁的质量,μg
m——样品量,g
V——测定时吸取样液的体积,mL