转化法
出处:按学科分类—工业技术 中国轻工业出版社《制盐工业手册》第1658页(3839字)
转化法是以生产KCl的副产品高温盐为原料,在控制一定的加水量和反应温度的条件下,进行分段转化,最后制得无水硝产品。
高温盐一般的组成为:
NaCl MgSO4 MgCl2 KCl H2O
25~40 30~40 6~10 0.7~1.5 20左右 (%)
其中NaCl、MgSO4和MgCl2,在水溶液中,可发生下列的复分解反应:
2NaCl+MgSO4=Na2SO4+MgCl2
因此,在一定的工艺条件下,有可能将高温盐转化成无水硝。转化过程可用Na+,Mg2+//Cl-,SO42--H2O体系多温相图进行分析。图6-4-18是这一体系中25℃,55℃,75℃和100℃的4个平衡图。
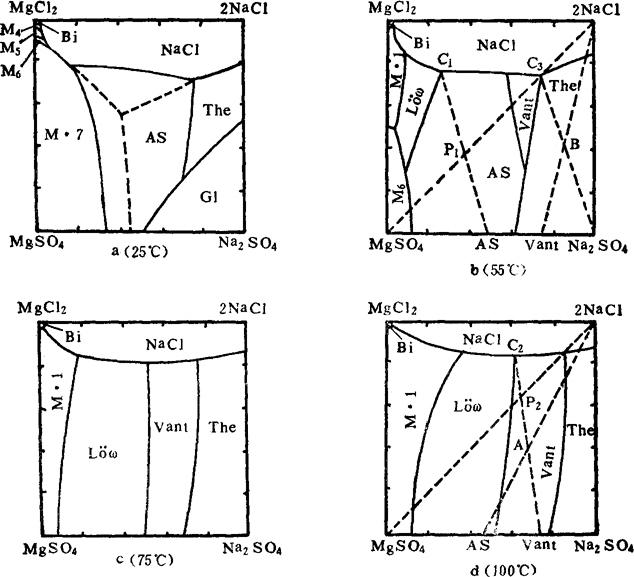
图6-4-18 Na+,Mg2+//C1-,SO42--H2O体系平衡图
M·1-MgSO4·H2O M·4-MgSO4·4H2O M·5-MgSO4·5H2O
M·6-MgSO4·6H2O M·7-MgSO4·7H2O The-Na2SO4
G1-Na2SO4·10H2O AS-Na2SO4·MgSO4·4H2O
Vant-3Na2SO4·MgSO4 LÖw-Na2SO4·MgSO4·2.5H2O
高温盐的主成分是NaCl和MgSO4,两盐的克分子比约为1∶1,故其组成点应位于干盐图中NaCl-MgSO4对角线的中点附近。在这4个温度条件下,体系点均没有落入Na2SO4的结晶区,因此不能用高温盐直接转化成Na2SO4。复盐3Na2SO4·MgSO4是一种不相称复盐,加入适量水后便分解,可得到一定量的Na2SO4固相,故复盐3Na2SO4·MgSO4可以是转化过程中的中间产品。得到3Na2SO4·MgSO4复盐的方法有两种途径:
1.两段转化法 转化过程如下:

第一段是获得复盐3Na2SO4·MgSO4。由图6-4-184个温度的相图比较看出,3Na2SO4·MgSO4复盐的结晶相区随温度的升高而扩大,故第一段转化温度以控制在100℃左右为好,具体配料过程如图6-4-18d所示,在高温盐中加入适量的水和盐,使体系点调至P2,转化平衡后得母液C2和固相复盐3NaSO4·MgSO4。
第二段是将复盐转化为产品Na2SO4。比较图6-4-18 4个温度的相图可以看出,在55℃时Na2SO4的结晶相区最大,故转化温度应控制在55℃左右。具体配料过程如图6-4-18b所示,在分离出的复盐中加入适量的水和盐,使体系点调至B点。转化平衡后得到母液C3和固相产品Na2SO4。
2.三段转化法 转化过程如下:

第一段:在55℃条件下,将高温盐与适量的盐和水配料,使体系点调至P1(见图6-4-18b),转化平衡后得到母液C1和固相复盐Na2SO4·MgSO4.4H2O。
第二段:在100℃温度条件下,将复盐Na2SO4·MgSO4·4H2O与盐和水配料,使体系点调至A点,转化平衡后得到母液C2和3Na2SO4·MgSO4复盐。
第三段转化:在55℃温度条件下,用复盐3Na2SO4·MgSO4与盐和水配料,使体系点调至B点,转化平衡后得到母液C3和固相产品Na2SO4。
两段转化法的母液C3可参与配料循环使用,最后排出体系之外的物料为母液C2。三段转化法的母液C2,C3均可参与配料循环使用,最后排出体系之外的物料为C1。比较母液C1和C2两点的位置可以看出,C1点更靠近MgCl2的固相点,即液相中MgCl2的浓度高,说明三段转化比两段转化可使复分解反应(2NaCl+MgSO4=Na2SO4+MgCl2)更有利于向生成Na2SO4的方向进行。因此宜采用三段转化法制无水硝。
生产上将母液C2和C3参与配料的三段转化法的实际过程如图6-4-19所示。实线所标绘的是55℃的平衡图,虚线所标绘的是100℃的平衡图。水图上各小写字与干盐图上各大写字母一一对应。
某一高温盐组成如下:
MgSO4 NaCl MgCl2 H2O
36.08 36.36 6.89 20.67 (%)
换算成耶涅克指数为:
2Na+:45.6%
 :43.9%
:43.9%
H2O:168mol/100mol干盐
标在图6-4-19中,体系点为A。
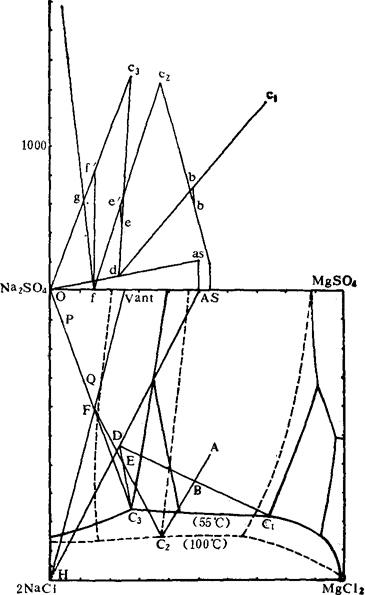
图6-4-19 三段转化法工艺过程相图分析
第一段转化(55℃):用高温盐与二段转化母液C2配料,配料后的体系点为B,高温盐中NaCl与MgSO4的重量比最好接近1∶1,若NaCl不足,可适当加入。由于高温盐中含有约1.5%的Mg(OH)2,在母液中成胶体状态,影响固液分离,需加入适量H2SO4,控制pH=4~5,将Mg(OH)2溶解掉。
转化后的理想状态是得母液C1和固相D。由水图中看出,与d和c1相对应的体系含水应为b′点,说明原配料中水量不足,应加适量的水,使原体系点b升至b′。转化平衡后固液分离,得母液C1和固相D(NaCl和Na2SO4·MgSO4·4H2O混合盐)。
第二段转化(100℃):用一段转化后的固相D与三段转化的母液C3配料,体系点为E。转化后的理想状态是得母液C2和固相F。由水图中看出,与f和C2相对应的体系含水点为e′,e低于e′,说明水量不足,应加入适量的水,使e升至e′。转化平衡后固液分离,得到母液C2和固相F(为NaCl和3Na2SO4·MgSO4的混合盐)。
第三段转化(55℃):将二段转化出的固相F加水,至体系含水为f′点时为最佳,此时母液点为C3,固相点为O点(纯Na2SO4点)。转化平衡后固液分离,得母液C3和产品无水硝。
采用三段转化法,SO42-的转化率理论上可达60%左右,每产1t无水硝约用4t高温盐。工艺设备流程见图6-4-20。

图6-4-20 三段转化法工艺设备流程图
1-一段转化槽 2-预热器 3-盐浆沉降器 4-二段转化槽 5-盐浆沉降器 6-预热器 7-三段转化槽 8-盐浆沉降器 9-离心机
目前对三段转化法的改进意见是:在第三段转化槽内不加淡水,而加入全溶蒸发法生产无水硝的清硝液。如图6-4-19中所示,P点为清硝液组成点(水图上为p点),与固相F点配料后,体系点为Q(水图上为q点),转化后相应的母液点仍为C3,固相点为O点。加入的清硝液正好充抵了第三段的加水量。改进后SO42-的回收率可提高到68%左右。清硝液不用蒸发大量的水分就可得到无水硝。这样改进是把三段转化法、盐析法和全溶蒸发法有机地结合起来,值得进一步研究。
转化法制取无水硝的特点:(1)利用生产氯化钾过程中的副产品高温盐直接转化制得含纯达95%的无水硝,提高了苦卤资源综合利用的程度。(2)生产设备及工艺流程简单,连续化程度高。不足方面是:(1)产品色泽不佳,杂质含量偏高。(2)SO42-的转化率较低,理论上仅达60%,主要原因是原料组成波动性较大,配料很难准确掌握,转化时间及固液分离还存在问题等。(3)需耗用硫酸,对设备腐蚀较严重。