实验动物注射法
出处:按学科分类—农业科学 中国农业出版社《兽医微生物实验诊断手册》第43页(3414字)
注射材料一般必须无杂菌污染,若为含病毒的材料可能已被细菌污染,则应加入抗生素(青霉素1000u/ml,链霉素1000μg/m1)置40℃1h后,再行注射。供病原分离的组织悬液,应以2000~3000r/min离心沉淀10min,取上清液注射。
一、实验动物被毛除去法
1.剪毛法用剪毛弯头剪紧贴动物皮肤先粗略剪,然后再细剪,为了避免被毛乱飞,事先可用纱布蘸生理盐水将剪毛部位予以湿润。
2.脱毛法适用于家兔、小白鼠等小动物的脱毛剂配方:硫化钠8g、淀粉7g、糖4g、甘油5g、硼砂1g、水75g,共100g,调成稀糊状。
用法:先将被毛剪短(小自鼠不需剪),用棉球蘸脱毛剂在脱毛部位涂成薄层,经2~3min后,用温水即可洗去脱下的被毛。
对大动物脱毛可使用硫化碱(染土布用)10g、生石灰15g、加水至100ml溶解。也可使用硫化钠8g、淀粉7g、糖4g、甘油5g、硼砂1g、水75m1共100g调成稀糊状,用纱布蘸上此种脱毛剂涂在需脱毛的部位,使被毛湿透,经2~3min,用水将脱下的被毛冲洗掉。脱毛部位事先一定不要用水洗,以免脱毛剂渗透入皮毛根里,刺激皮肤,造成皮肤炎症等变化。
二、使用注射器注意事项
1.检查注射器是否漏气。可用左手握注射器管,其食指将注射器的口堵住。右手轻拉注射器栓,若注射器栓能回复原位,则无漏气现象。拉注射器栓的手不可放开,以免注射器栓自然弹回将针管打破。
2.先计算需用剂量,再吸取注射液。吸入注射液后,需用无名指或中指轻扶注射器栓(图3-9),以防注射器栓自然滑动,因而吸入空气或使注射液溢出。

图3-9 持注射器法
3.吸入注射液后,应用酒精棉球盖裹针头,以防注射液溢出污染环境。
4.注射前应排出气泡,调整注射液至准确的用量,使调整出的注射液渗入酒精棉球中。
5.注射器一般应平拿,不可针头向上,以防刺伤保定动物的人员。
6.用过的注射器、针头、镊子、酒精棉球及污染物应置消毒盒内及时消毒处理。
三、皮下注射法
选择皮下组织疏松、便于注射和易于吸收的部位。家兔和豚鼠选用腹部或腹股沟部,小白鼠用背部或腹侧。羊、猪可在前、后肢内侧。大动物注颈部皮下。给小白鼠皮下注射,可由一人将小白鼠固定(背部向上),术者左手用镊子将背部已消毒部位皮肤稍提起,即可在镊子下部注入(图3-10)。也可由术者自己用左手抓小白鼠,右手持注射器进行注射(图3-11)。给家兔和豚鼠皮下注入量一般为0.5~1ml;小白鼠为0.2~0.5ml。
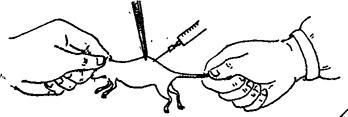
图3-10 小白鼠背部皮下注射法
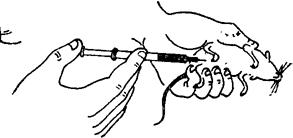
图3-11 小白鼠腹部皮下注射法
四、肌肉注射法
选择肌肉丰满,无大血管通过处。禽类注射部位为胸肌,其他动物为臀部。
五、皮内注射法
将注部剪毛,若需观察注部反应,则勿用碘酒消毒,可用酒精消毒。皮内注射部位的皮肤不可过于紧张。给小动物注腹部;羊在尾根皱褶处或股内侧;牛、马在颈部。术者用左手将注部皮肤夹起成一皱褶,再将针头刺入皮层,然后缓缓注入。如确注入皮内,则注射时感觉有阻力,注部形成突起的小包。皮内注射量一般为0.1~0.2ml。
六、腹腔内注射法
禽类注射部位在胸骨脊的后缘两侧。注射小动物时,可将其固定倒提使肠管前移,以免刺伤肠管。注射家兔及豚鼠时先将针头在腹股沟处刺入皮下,前进少许,再刺入腹腔而注射,注射量可达5ml。给小白鼠腹腔注射,先用右手提鼠尾,将小白鼠放于铁丝网上,然后用左手食指和拇指捏住鼠的两耳和头部皮肤,再将鼠尾夹于左手的无名指和手掌之间,则鼠的腹部向上,并使其头向下(图3-12),右手持注射器,将针头先平行刺入皮下,然后向下斜行通过腹部肌肉而入腹腔。注射量为0.5~1ml。给各种动物腹腔内注射时,若无把握针头是否位于腹腔内或误刺入肠管及其他管道,则可将注射器先抽吸一下,若无肠内容物或其他液体吸入注射器中,且抽吸时觉有负压,则表明针头确在腹腔中而非在肠道或其它管道中,此时即可注射。

图3-12 小白鼠腹腔注射法
七、静脉内注射
静脉注射的材料中不得含有气泡或颗粒,否则会引起脑血管栓塞,使动物立即死亡。注射速度应缓慢,大剂量静脉注射,注射液的温度应同体温一致。
家兔:注射部位采取耳缘静脉。若需在同一静脉作多次注射,应从静脉管的远心端开始,逐次向近心端注射,以免血管注射受伤发生阻塞,妨碍以后注射。注射前用酒精棉按摩耳部,然后用手指轻弹耳壳,使其血管舒张,则易注射。必要时用二甲苯擦抹耳壳,则血管明显扩张,但于注射前必须将耳壳擦干,以便于止血。注射时用左手提耳端尖部,食指垫于注射部的耳背面,并于耳壳和食指间垫以酒精棉(图3-13),以防刺穿耳壳使术者受伤。右手持注射器使针头对准耳静脉血管平行方向刺入。注射开始时,应先轻轻推动注射器栓,以观察针头是否确在静脉内,若未注入静脉,则注部皮下形成隆起,若针头进入血管,则血管中的血液被注射液逐去。注射速度必须缓慢,注射完毕,以酒精棉压迫创口止血。家兔静脉注射可达5m1。

图3-13 家兔耳部静脉注射方法
豚鼠:豚鼠静脉注射比较困难。一般于后肢外侧静脉注射。该静脉上部比较明显,但很活动不易注入。在接近趾部处不太明显,但比较固定,故较易注入。也可将皮肤切开,使静脉露出后注射。或采用心脏内注射(见心脏采血法)。豚鼠静脉注射量不超过2ml。
小白鼠:于尾部静脉注射。用15~20g的小白鼠较易注射。20g以上的小白鼠不易观察静脉,可将尾部浸入50℃温水中泡1min,则血管扩张便于注射。注射时可将小白鼠放入铁丝筐内,将鼠尾从筐孔中拉出,也可用烧杯将小白鼠盖住,将鼠尾从杯口拉出,拉直,从靠近尾的尖端处平行刺入,再向下刺入静脉,注入量不超过1ml。
八、颅腔内注射法
家兔和豚鼠:注射部位在两眼外眦的连接线上,离颅骨正中线约2mm处,注入量约为0.05ml。注射时由助手握紧两耳,将动物按在桌上,并用手指将注部皮肤拉往旁侧按紧,用锥子钻穿颅骨及注射(图3-14),这样可使皮肤的伤口不在注射点之上,而在注射点的旁边,使注部的钻孔不暴露在伤口中,而被掩盖在皮肤下,以减少污染的可能。注射速度一定要慢,避免引起颅内压急骤升高,注射后用碘酒消毒,并用火棉胶将伤口封闭。

图3-14 家兔颅腔内注射法
小白鼠:给小白鼠颅腔内注射应使用0.25ml注射器,注射量为0.02ml,将注射针头直接刺穿颅骨注射(图3-15)。颅内注射刺入针头不可过深,以免损伤脑组织。注射速度要慢,避免引起颅内压急骤升高。

图3-15 小白鼠颅内注射法
九、鼻内接种法
根据接种病原微生物的种毒,必要时动物需先用乙醚麻醉。大动物用麻醉口罩进行麻醉,小动物可放于有盖的玻璃缸内,缸内放浸有乙醚的脱脂棉,使动物达到麻醉。动物麻醉后,用滴管将接种材料慢慢滴入鼻内。如动物处于深麻状态,则能将接种材料吸入肺内。深麻醉的动物易发生肺水肿,大部分在接种后一天内死亡。还需注意,轻度麻醉的动物企图将接种材料喷出。因此进行此项接种时,术者应戴口罩并隔保护玻璃操作、鼠内接种量不可过大,小鼠接种量为0.03~0.05ml,家兔可达2ml。