基本原理
出处:按学科分类—农业科学 农业出版社《土壤农化分析手册》第103页(1740字)
离子选择性电极,根据1975年国际纯粹化学和应用化学会(简写为IUPAC)推荐是指一类通过电极电位的可逆变化来反应某种离子活度变化的电化学传感器,它能把溶液中某种离子的活度转变为电讯号(电位),而且电极的电位与溶液中某种离子的活度对数呈线性关系,从而实现了对某种离子的定量测试。人们把电极的电位随着离子活度的变化而变化的特征称为响应,若这种响应变化服从于能斯特(Nernst)方程,则称为能斯特响应,电极的能斯特响应是选择性电极的基本特性。
各种类型的离子选择性电极的结构虽各有特点,但它们都具有一个称为离子选择性膜的敏感元件,离子选择性电极的利用决定于膜电位的测定,假如我们把离子选择性电极模拟成如下一种形式(图2-26)。

图2-26 膜电位
中间为离子选择性电极膜,薄膜右边的溶液(1)中含有离子i和j,其活度分别为 和
和 。薄膜左边的溶液(2)中含有离子i和j其活度分别为
。薄膜左边的溶液(2)中含有离子i和j其活度分别为 和
和 。
。
假定薄膜对离子i有选择性响应,离子i可以透过选择性膜,由活度高的溶液(2)向活度低的溶液(1)自由运动。而离子j(或其他任何离子)被阻挡不能透过选择性薄膜。这时在这两种溶液中的选择性薄膜两边将产生电荷的分离,形成一个双电层结构,从而产生一定的电位差,这就是选择性膜电位。因此在这个体系中,膜电位就是一个浓差电位,这就可能象在浓差电池中那样,使膜电位EM与离子的活度联系起来。

如果有一边的离子活度ai〃保持恒定,则此方程式可改变如下的形式,因此膜电位就成为离子i活度的对数函数了。
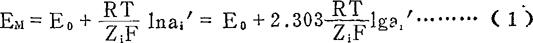
式中:2.303——自然对数转换为常用对数的系数;
R——普通气体常数8.314焦耳/克分子·度;
T——绝对温度;
F——法拉第常数,96500C/mol;
Zi——i离子电荷数(价数),(也有用n表示);
ai′——待测离子i的活度;
ai〃——已知溶液离子i的活度。
但是,膜电位是不能直接进行测量的,通常引入一支不随溶液中待测离子活度变化而改变其本身电位的参比电极,它和离子选择性电极组成完整的电化学电池,从测定电池的电动势中推算出膜电位来。电池的电动势是以下几个电位的代数和。

E电池=(E参1-E参2)+E膜+Ej……………………(2)
因E参1-E参2=E0(常数);Ej为液接电位,一般忽略不计。所以上式可简化为:

多数离子选择性电极在工作范围内符合Nernst公式,一个性能良好的离子选择性电极电池,当溶液中离子活度变化时,只有膜外表面电位是变数,其余均可归入Nernst公式常数项E0中去。因此离子选择性电极和参比电极的电位差可用Nernst公式表示(符号“+”对于阳离子,“-”对于阴离子):

必须指出,离子选择性电极测得的是离子活度而不是浓度。离子浓度与活度的关系如下:

a——活度;f——活度系数;C——浓度。
在低浓度(10-2以下)时,其活度系数接近1,可以把活度a视为浓度C,所以可把Nernst公式写成:

Ci——待测离子i的浓度。