重量法
出处:按学科分类—农业科学 农业出版社《土壤农化分析手册》第400页(3196字)
(一)方法要点 土样经碳酸钠熔融后,用盐酸溶解熔块,用重量法测定溶液中的硅,须先使亲水胶体二氧化硅脱水絮凝析出,然后过滤使与其他元素分离,沉淀经900-920℃灼烧,称重,即得二氧化硅含量。脱水方法介绍三种:
1.HCl脱水法 用浓HCl脱去SiO2·nH2O中的水,因盐酸是一种挥发酸,它夺取水分的力量很大,容易蒸发,且蒸发后不留任何残渣,且H+的作用,也有利于SiO2·nH2O胶体的絮凝作用。但蒸发须在水浴上进行。使温度不超过100℃,否则溶液中的Fe、Al、Mg等氯化物就会形成难溶性碱性氯化物,使SiO2的结果偏高。反应如下:

2.动物胶法 动物胶是一种蛋白质,在酸性介质中带正电,如下反应:

而硅酸是带负电荷的一种亲水性很强的胶体,当在适当的温度(70℃)下,这两种胶体就互相吸引,且正负电性中和,使二氧化硅迅速凝聚,沉淀下来。
动物胶凝聚硅酸进行脱硅的条件与盐酸浓度、溶液温度以及动物胶用量有关。有人建议盐酸浓度在8N以上,溶液温度控制在70℃左右为宜,如低于60℃或高于80℃时,均不能使硅酸凝聚完全。脱硅后溶液,测定FeAl时须煮沸破除动物胶。
3.HClO4脱水法 利用浓HCl和HClO4进行脱水,所得的二氧化硅,较用HCl脱水法所得的含杂质少。
(二)试剂配制
1.HCl比重1.19,分析纯。
2.1%HCl 取浓HCl 3ml稀释至100ml。
3.5%硫氰化钾溶液 称5gKSCN溶于水中稀释至100ml。
4.70%过氯酸,分析纯。
5.0.5NHCl 取浓HCl 42ml用水稀释至1L。
6.1%动物胶新鲜溶液:称1g动物胶(明胶)溶于70℃的100ml水中。
(三)测定步骤
1.盐酸脱水法 将Na2CO3熔融并用盐酸溶解后的溶液(本章第二节一、所得的待测液)在通气橱内沸水浴上蒸干,同时用水冲洗表面皿。用玻棒将残渣压碎,加入浓HCl 10ml溶解残渣,并用滴管滴加HCl浸湿蒸发皿器壁周围,再蒸干,压碎残渣,最后再加浓HCl 10ml,稍待片刻(2-3min)后,加热水50ml,在沸水浴上加热5min。
趁热以快速无灰滤纸用倾泻法过滤后,每次用10-15ml 1%的热HCl洗涤沉淀3-4次(每次尽量倾干),然后再将沉淀移在漏斗上,每次加洗液前必须等上次液滴不再下滴再加下一次,直至无Fe3+反应为止(在白瓷色板上接收几滴洗液,加KCNS溶液一滴,无红色出现即示洗净)。最后再用热水洗2-3次。
将滤液和洗液在蒸发皿中蒸干,再如上法脱硅一次,加15ml浓HCl脱硅过滤洗涤等。将两次沉淀合并灼烧。
将滤液与洗液承接于250ml容量瓶中,冷却后,定容到250ml,作为铁、铝、钛、锰、钙、镁、磷等元素的待测液。如果滤液中有絮状物表示脱硅不完全,应重新进行脱硅处理。一般进行两次脱硅即可完全。溶液的盐酸浓度约0.7N。
沉淀连同滤纸包好,放入已经恒重的铂坩埚中,使盖子留一小缝,在四孔电炉(图15-2)上低温进行碳化处理。等到冒烟,揭开盖子,使其充分氧化,但不得着火。等无黑烟冒出时增加炉温进行灰化,使滤纸的碳末全部变成白色或灰白色(SiO2粉末极轻极易被吹失,灼烧时要特别小心)。

图15-2 四孔小电炉结构
1.电炉底座用厚铁皮制成(四壁高4.5cm) 2.四面均用石棉板构成(6×8cm) 3.为一具有四孔的石棉板(20×20cm)盖在电炉上 4.放入孔内的坩埚(其底部距炉底0.5cm),炉内(18×18cm)装有1500W炉丝
将坩埚移入高温电炉中(加盖)经900-920℃灼烧半小时,取出,在干燥器中冷却20min,称重,再灼烧10min,冷却、称重,直至前后二次差0.3mg即为恒重。同时要做空白试验。
2.动物胶法 将用Na2CO3熔融并用HCl溶解后的溶液(本章第二节一、所得的待测液)在通风橱内水浴上,将杯的1/2-1/3浸入沸水面下蒸发至近干,此时盐分析出,但并未全干,仅成为稠糊状物。加浓HCl 20ml,搅拌后放置过夜,或者在水浴上80-90℃下保温20min(盖上表面皿)。
同时配制l%的新鲜动物胶于烧杯中,同样与待测液一起放入水浴中保温在70℃,然后沿皿嘴加入10ml动物胶,并搅动数次,在70℃下保持10min,使脱硅达到完全。
趁热以快速无灰滤纸用倾泻法过滤,再用热水或稀酸洗至无Fe3+反应为止(作法同上法)。滤液承接于250ml容量瓶中,冷却后用蒸馏水定容,作为系统分析之用。
将漏斗中的沉淀连同滤纸包好,放在已称至恒重的铂坩埚中,低温碳化,增温灰化,高温灼烧至恒重,灰分即为SiO2重量。有关过滤、灰化、灼烧等具体操作参用HCl脱水法进行。
3.高氯酸脱水法 将用Na2CO3熔融并用HCl溶解后的溶液(本章第二节一、所得的待测液)加10ml 70%HClO4,在蒸发皿上架一玻璃棒做的三角架,上盖以表面皿,将此蒸发皿放入通气橱中的电热板上加热蒸发,HClO4溶液要保持微沸并发烟约15-20min,使SiO2脱水。冷却后,加20-30ml热水稀释之,趁热用快速无灰滤纸过滤,用0.5N HCl洗涤沉淀10-12次至无其它盐类为止(用KCNS检查方法同HCl脱水法)。滤液与洗液定容于250ml容量瓶中,作系统分析之用。
沉淀按HCl脱水法中所述之步骤碳化、灰化、灼烧并称至恒重。
(四)结果计算
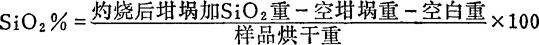
如果有必要的话(沉淀夹有杂质,或更精确测定),可以用滴管沿坩埚壁滴加1-2ml水以湿润SiO2沉淀,防止损失。再加1∶2H2SO44-5滴,然后小心地加5-7mlHF,在水浴上蒸发至仅残留少量H2SO4时,在电炉上蒸发至干,出现白烟时,再放入高温电炉灼烧10-15min,冷却、称重,所损失之重即SiO2之重,用此重量改算SiO2%,如果残留的残渣较重,超过3-4mg,应再用少量HF重复处理一次。在装有残渣已称过的坩埚中,加入1gK2S2O7(或Na2CO3),在喷灯氧化焰上熔融后,将坩埚连同熔块一并放入烧杯,加入25ml 1N HCl,微热使残渣溶解,然后将此溶解好的溶液与分离硅酸后的滤液一起合并定容。