器官发生的植物
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第3页(16930字)
在离体培养中已经有许多种植物可以再生植株,本文不包括胚胎发生再生植株的科。很明显,虽然许多种作物可以从细胞培养再生,某些更加重要的作物,值得注意的是禾谷类和豆类,在这种技术的开发方面是落后的。我们强调了在农业上有用的植物。
(一)茄科
在离体培养中已经把茄科植物当作模式系统。因为1965年Vasil等从烟草成熟植株的单细胞再生出植株,从而首次证明了全能性。1964年,Guha等在离体培养中从离体花药第一个得到单倍体植株的是蔓陀罗属。1971年Takebe等从分离的原生质体再生植株取得成功的首先是烟草。1972年Carlson等首次从两种烟草(粉蓝烟草和郎氏烟草)获得体细胞杂种。
1.烟草和其它烟草属植物栽培烟草品种离体培养容易增殖。生长素和细胞分裂素对于外植体和组织培养物的效应是相当专一的,而且重复性相当好。大多数植物的组织培养中常用的营养液(MS培养基)是根据烟草做的生长实验设计的。从烟草的叶和茎的外植体得到了愈伤组织和悬浮培养物,而且许多烟草属植物用MS培养基加4.5μM2,4-D和2g/l水解酪蛋白也可得到愈伤组织和悬浮培养物。在MS培养基上,用其它浓度的激素,如11.4μM IAA和2.3μM KIN也可得到愈伤组织,但总是需要生长素。在MS培养基上或这种培养基加2,4-D可以保持愈伤组织,水解酪蛋白并非必需。用MS或B5培养基加入2.3—4.5μM2,4-D很容易得到悬浮培养物。去掉2,4-D,加入细胞分裂素很容易从愈伤组织或悬浮培养物再生苗,如接种在MS加5μM 6BA的固体培养基上。对于烟草来讲,许多种激素组合已成功地用于再生苗。用生长素和细胞分裂素的组合,如11.4μM IAA和9.3μM KIN或22.8μM IAA和46.5—66.5μM KIN代替2,4-D也可诱导再生苗。已经报道从烟草属的19个种愈伤组织再生出苗(表1-1)。在大约三周内可以从烟草愈伤组织获得苗,可以在有5μM 6BA的MS培养基上用烟草培养物进行增殖。在不加激素的MS,Hoagland或White培养基上或 浓度的MS加25—75μM6-氨基吡啶上可以再生根,根出现很快,而且许多情况下看来根原基是早已存在的。
浓度的MS加25—75μM6-氨基吡啶上可以再生根,根出现很快,而且许多情况下看来根原基是早已存在的。
烟草属有些种间有性杂交后代可产生肿瘤,已经证明粉蓝烟草和郎氏烟草的肿瘤在离体培养时是激素自养的。激素自养不只限于肿瘤,如许多烟草细胞也是如此,包括迪勃纳氏烟草和匍匐烟草和奈特斯烟草。
2.马铃薯和有关的种 马铃薯的双单倍体无性系也易进行组织培养。块茎、茎尖、下胚轴、叶和茎的外殖体都曾用于发生有形态发生潜力的愈伤组织。在加有2.3μM IAA,1μM GA和3.7μM KIN的改良MS培养基上可以从块茎外植体发生愈伤组织,或在加有9.1μM的2,4-D的MS培养基上从苗或茎发生愈伤组织。茄属野生种发生愈伤组织需要高的生长素与细胞分裂素比例。通常用NAA和2,4-D,虽然用IAA和6BA也曾经取得成功(表1-2)。当用4.7-46.5μM的KIN代替2,4-D时,在茎和苗发生的愈伤组织曾观察到形成苗。当把幼小的苗转移至有2.2μM 6BA和0.3μM GA的MS培养基上或转移至不加激素的培养基上可形成根。
对于S.xanthocarpum,S.sisymbriifolium,千年不烂心,龙葵,S.khasianμm和叶绿素缺失的S.chacoense可遵照相似的程序。一种改良的MS培养基和White(1943)培养基加上2.3—27.1μM的2,4-D可以用来发生和保持每一种植物的愈伤组织。为了再生植株可去掉2,4-D,而对于S.xanthocarpum来说可把2,4-D的浓度从4.5μM降至0.5μM。大多数情况下可向苗再生培养基中加入细胞分裂素(表1-2)。对S.sisymbriifolium只要转移至加有7.4μM IAA的Nitsch培养基可以诱导出根。茄子下胚轴切段对于2,4-D没有反应;但用5μM NOA或43μM NAA可以发生愈伤组织。当把愈伤组织移至加有2.3μM ZEA或4.7μM KIN,或用1μM 6BA代替NAA的MS培养基上时,可以形成苗;转移至不加激素的MS培养基上可以诱导生根。
3.番茄和有关的种 番茄属植物,尤其是番茄的组织培养研究,常用MS培养基从大多数番茄的外植体可以诱导愈伤组织,但常用叶和下胚轴切段(表1-3)。常用生长素2,4-D,但在再生时不加生长素。IAA和NAA与KIN和6BA配合用于诱导愈伤组织增殖。在叶子和下胚轴切段的酚氧化作用,可把培养物放在暗中,直至形成愈伤组织或向培养基中加入500mg/l的聚乙烯毗咯烷酮的办法予以克服。在愈伤组织诱导培养基中也可形成苗,但频率低,在具有较高的细胞分裂素与生长素的比例或在只有细胞分裂素的培养基上效果较好,在加有10.7μM NAA或11.8μM IAA的MS培养基上可以得到根。Coloman和Greyson(1977)曾经指出,浓度为0.01—100μM GA3可促使形成根。两种野生的番茄属植物也用相近的技术得到了苗(表1-3)。番茄看来不象其它茄科植物那样容易用组织培养技术操作,因为在继代培养时愈伤组织会失去再生苗的能力。长期培养的悬浮培养物还不能再生植株。在经过四个月培养的番茄愈伤组织中有20%可以再生正常的植株,但在培养17个月后,只能得到异常的苗,不能形成根。用6BA和IAA曾从愈伤组织获得再生苗,但用KIN和NAA不能再生苗。细胞分裂素与生长素的比例在控制番茄苗形成上看来比用那种专门的激素更重要。
4.矮牵牛属和蔓陀罗属 矮牵牛离体培养容易操作。但是这些种的大部分知识是关于从原生质体再生植株的可能性。矮牵牛属中所有的种都在MS培养基中培养过(表1-4)。茎和叶的外植体都能再生植株,根培养用0-107.4μM NAA和0.4—35.2μM 6BA相结合,或只用2,4-D,也可用2,4-D与低浓度的6BA(0.9μM)配合。在所有的种中,用降低生长素浓度和提高细胞分裂素浓度的办法,都可成功地再生苗。在少数情况下,用较弱的生长素代替强的生长素,也能成功,如用22.8μM IAA代替22.6μM2,4-D。矮牵牛属中已研究过的四个种都可在离体培养中再生(表1-4)。
蔓陀罗属还未进行很微细的研究,虽然南洋金花是花药培养、植株再生和体细胞杂交研究的理想材料。在加1μM2,4-D的MS培养基上可以诱导和保持南洋金花的愈伤组织,用1μM6BA可从愈伤组织再生植株。在没有生长调节剂的MS培养基或加1μM IAA的Nitsch培养基上可得到根。在加有2.2μM6BA和8μM NAA的B5培养基中白花蔓陀罗和假白花蔓陀罗曾取得再生,而当除去NAA,并把6BA增加至4.4μM时可形成苗。在南洋金花从细胞悬浮培养体、茎切段和叶切片上得到苗。
5.其它茄科植物 经器官发生从其它8种茄科植物再生过植株(表1-5)。在每种情况下,生长素与细胞分裂素比例大于1可诱导愈伤组织,而生长素与细胞分裂素比例小于1可再生苗。可用White、MS基本培养基,在没有激素的或加有生长素(NAA或IAA)的培养基中可形成根。在这些茄科植物中几乎用了所有可以利用的外植体(表1-5)去诱导器官发生。除了表1-5所列的各种以外,曾从野甘草属三个种的花药再生成植株,在离体培养下未能再生植株。
总共有42种茄科植物在离体培养中再生。器官发生是本科植物植株再生的主要方式。在离体培养的42种植物中有39种使用MS培养基,虽然B5培养基可能同样有效。大多数种中用4.5μM2,4-D可以诱导愈伤组织,用5μM6BA在大多数种中足以诱导植株再生。在那些用这种处理不能奏效的种中,常配合使用生长素和细胞分裂素。在茄科植物中,如果生长素比细胞分裂素大于1,则促进愈伤组织形成;如果小于1,则形成苗。这种一般规律可以用于已试过的42种植物中的38种(表1-1至表1-5)。唯一的例外是千年不烂心,龙葵和Scopolia parviflora在这种情况下,可用IAA和低浓度的细胞分裂素相配合来诱导苗。IAA在离体培养中易破坏,而且不如2,4-D和NAA有效。
表1-1 MS培养基上烟属的各种培养外植体形成苗的情况

表1-2 茄属的植株再生
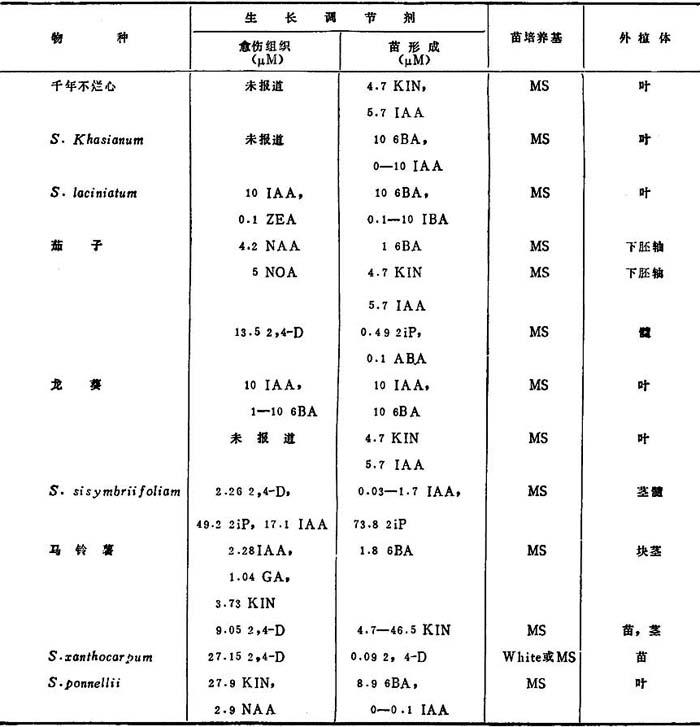
表1-3 番茄和有关植物的再生

表1-4 矮牵牛属和蔓陀罗属的植株再生

表1-5 其他茄科种的植株再生

(二)十字花科
十字花科包括许多重要作物,如硬花甘蓝、白菜、抱子甘蓝、油菜、羽衣甘蓝、芥蓝、花椰菜和辣根等,这些植物离体培养都已再生。除辣根外,其它植物都属于芸薹属。另一个十字花科植物拟南芥菜,容易培养和再生。对十字花科植物的研究重点放在用组织培养进行改良作物和营养繁殖。
从多种外植体可以诱导并保存愈伤组织。从愈伤组织可以诱导苗,通常用增加细胞分裂素和生长素的比例。十字花科愈伤组织的器官发生能力随着培养时间延长而迅速下降.尤其在培养了6—8个月以后。改变培养基可以提高拟南芥的器官发生潜力。
至少有8种十字花科植物在离体培养中再生(表1-6和表1-7)。花椰菜和拟南芥菜对培养基中激素的细胞学反应因品种和地方小种而异。十字花科植物再生中广泛使用MS培养基(表1-6和表1-7)。在决定培养物的器官发生反应中,用于诱导愈伤组织的外植体的来源是重要的。
1.芸薹属 农业上重要的芸薹属植物有:甘蓝(花椰菜、抱子甘蓝、油菜和羽衣甘蓝),芥菜和芥蓝(B.alboglabra)。甘蓝的愈伤组织通常在生长素和细胞分裂素同时存在的情况下发生(表1-6)。虽然最常用2.3μM KIN,但低至0.5μM和高达14μM KIN也曾取得成功。多种激素可以满足愈伤组织发生和维持时的生长素需要,如2,4-D,IAA和NAA,浓度从0.9μM2,4-D到11.4μM IAA(表1-6)。羽衣甘蓝和芥蓝的愈伤组织诱导可由10.7μM NAA和2.2μM6BA促进。芥菜是芸薹属中愈伤组织生长不需要细胞分裂素的唯一的一种,它可以在2.3—4.5μM2,4一D中成功地培养。花椰菜对于5μM6BA的生长反应因不同的遗传型而异。
芸薹属的愈伤组织培养物很容易再生植株。通常培养基中必需包含细胞分裂素,如2.3—93μM KIN(表1一6)。在再生培养基中生长素的浓度可有很大变化。有些不需要生长素,或需要高浓度不太活跃的生长素,如红甘蓝需5.7一11.4μMIAA与细胞分裂素相配合才能再生植株。对于芥蓝只有在5.4—21.4μM NAA和2.3—4.7μM KIN同时存在下才能再生苗。芥菜在有5μM 6BA存在时可以再生苗。与从多数愈伤组织培养物再生相反,对于植株再生需要0.1—2.8μM GA3。在没有GA3时可以诱导绿色的愈伤组织,但不能形成苗。
2.拟南芥菜 与芸薹属相似,培养基加细胞分裂素和生长素可促进拟南芥菜愈伤组织生长。在10μM2,4-D和0.25μM KIN的改良B5培养基上发生愈伤组织,加0.24μM KIN和5μM2,4-D的改良B5培养基上维持愈伤组织。在43μM NAA和0.25μM KIN中也曾发生愈伤组织。曾经有人指出外植体的来源会影响此后从愈伤组织再生植株。从花药再生的愈伤组织有很强的器官发生潜力,而且这种能力可保持18个月之久。从种子、茎和叶发生的愈伤组织这种能力只能保持6—8个月。
降低或除去培养基中的生长素浓度,同时增加细胞分裂素的浓度,可从拟南芥菜的愈伤组织再生苗。有时在再生培养基中保持低浓度的生长素,如1 μM KIN和0.1μM GA3。有时在苗再生培养基中加GA3,如10μM6BA和1μM GA3,尽管未证明生长需要GA3。
下列因素会影响拟南芥菜的形态发生:(1)选择具有高度再生能力的地理小种;(2)愈伤组织每4周继代一次,而不是8周;(3)愈伤组织在弱光下培养;(4)培养基用过滤灭菌;(5)用各氨酰胺代替 作为氮源;(6)每隔3—6天在4℃条件下处理培养物;(7)在转移至再生培养基前去掉培养基的生长素;(8)每20天把幼嫩培养物转至葡萄糖培养基,或把老的培养体转移至含6%葡萄糖的培养基中,因为高浓度葡萄糖抑制幼嫩培养物形态发生。随着愈伤组织年龄增加,苗再生能力逐渐降低。外植体的来源也影响愈伤组织保持再生能力的长短。随着愈伤组织老化逐渐失去再生能力,可能与染色体不稳定性有关,如在老的愈伤组织中观察到倍性增加。
作为氮源;(6)每隔3—6天在4℃条件下处理培养物;(7)在转移至再生培养基前去掉培养基的生长素;(8)每20天把幼嫩培养物转至葡萄糖培养基,或把老的培养体转移至含6%葡萄糖的培养基中,因为高浓度葡萄糖抑制幼嫩培养物形态发生。随着愈伤组织年龄增加,苗再生能力逐渐降低。外植体的来源也影响愈伤组织保持再生能力的长短。随着愈伤组织老化逐渐失去再生能力,可能与染色体不稳定性有关,如在老的愈伤组织中观察到倍性增加。
3.其他十字花科植物 有6种别的十字花科植物离体培养再生(表1-7)。除辣根外,一般在生长素与细胞分裂素比例大于1的MS培养基上发生和维持愈伤组织。在愈伤组织培养基中并非一定要加细胞分裂素。降低培养基中生长素的浓度,并提高细胞分裂素的浓度,可以诱导再生。辣根可以用5.4μM NAA和0.5—2.3μM KIN直接从叶碎片诱导再生苗。
虽然十字花科植物在离体培养中容易生长和再生,但是遗传型对愈伤组织的建立和植株再生有很大影响。因此对愈伤组织和苗的培养,激素浓度变化很显着。虽然在开始培养后的6个月内可能丧失从愈伤组织再生植株的能力,但是对培养技术的特殊改变可以延长再生的时间。离体培养系统尚未用于改进十字花科作物。
表1-6 芸薹属的植株再生

表1-7 十字花科植物的再生

(三)豆科
豆科植物植株再生相当困难。叶用豆类,如三寸草比籽用豆科植物更加容易在离体培养中再生。已有25种豆科植物可再生植株,但是频率低或限于一定的外植体来源。
至少有8种不同的培养基已成功地用于再生植株(表1-8)。MS培养基是豆类再生中最常用的。传统地用于其它科植株再生的培养基可能不太适合用于豆类。
与其它科的植物不同,少数再生的豆科植物可能是由于植物激素的作用。最常用于诱导愈伤组织的生长素是2,4一D,NAA,2,4,5-T和Pic1oram(表1-8)。除了寇阿相思树和胡芦巴属是用椰乳和Alhagi camelorum及牛角花只用2,4-D之外,其它种在诱导愈伤组织时都用细胞分裂素,6BA或KIN。在大多数豆类中,发生愈伤组织时生长素和细胞分裂素的比例是高的,但也有明显的例外(表1-8)。大多数豆类都需要比其它科植物高的细胞分裂素。
大多数用种子的豆科植物形成根的倾向大于形成苗。对于大多数种,不论生长素和细胞分裂素的浓度是多少,发生根的频率很高。在四棱豆、大豆和菜豆只发生了根未再生植株。对于Stylosanthes hamata先发生根,后出苗。叶用豆类也形成根,但其频率低于籽用豆类。在红车轴草和草香豌豆难以生根。
对于籽用豆类难以再生植株。一般讲,要降低生长素浓度或提高细胞分裂素浓度。成功地诱导种用豆类发生愈伤组织的激素浓度是相当高的(表1-8)。有时还要加入独特的附加物。菜豆再生需要蚕豆种子提取物,而木豆再生需4rad的γ射线照射。野大豆能再生,但栽培大豆至今还不能在离体培养中方便地再生,曾经从大豆下胚轴得到苗原基。
叶用豆类植物的激素需要是不太专一的,如苜蓿植株再生不需要激素,在红三叶草不同浓度的各种激素都可引起植株再生。虽然在豆类中曾经用分生组织再生植株,也能从许多种的非分生组织再生植株。从下胚轴、子房、子叶、分生组织、叶、胚根、种子、茎尖和细胞悬浮体得到的愈伤组织都再生植株(表1-8),但外植体的来源对植株再生频率影响很大。如红三叶草,子叶的植株再生率为1%,而分生组织的再生率为30%。
苜蓿下胚轴外植体的植株再生频率可达12%,但这是经过选择的。在一个遗传株系中经过二轮选择以后,植株再生率可以从12%提高到67%。用于再生实验的14个豌豆品系,只有6个经过二个月培养可以再生。经6个月培养,6个品系中只有2个可以再生。对5个红三叶草品种和9个苜蓿品种也有品种间植株再生能力的差别。关于这些品系间的明显的表型差别和通过选择比较容易提高再生频率这一事实表明,豆科的再生植株能力是遗传的。提出筛选大量的遗传品系可能对于达到再生植株是有用的。
从籽用豆类得到的苗很容易生根。几乎所有的情况下都是在有生长素的培养基中生根,1μM IBA(Acacia),0.6—26.9μM NAA(野百合属)和0.6μM IAA(Stylosanthes)都曾用过。大多数情况下,如果培养基中有细胞分裂素(KIN或6BA),那么生长素和细胞分裂的比例大于10,如5.7μM IAA比0.4μM6BA(亚历山大车轴草);0.5μM NAA比0.05μ.M KIN(四棱豆属);和10.7μM NAA比0.9μM6BA(木兰属)。在香豌豆属,苜蓿属,红车轴草和其它叶用豆类诱导生根比较困难。对于红三叶草,Phillups和Collins(1979)发展了一种有效的生根培养基,这种培养基降低了无机盐浓度,并加入3-氨基吡啶。
只有在少数豆类中确定迅速生长的细胞悬浮培养物有植株再生能力。苜蓿悬浮培养物可在加有9μM2,4-D和9.3μM KIN的Blaydes培养基中产生。悬浮培养3周以后,把细胞在基本培养基上植板,从96%的群落可以形成植株。培养3个月以后,再生能力下降至9%。亚历山大车轴草的悬浮培养物可在加有10.7μM NAA和0.95—1.0μM2ip的MS培养基上再生植株。悬液物的植板率为4%,得到的群体接种在诱导苗培养基上可以再生植株(表1-8)。
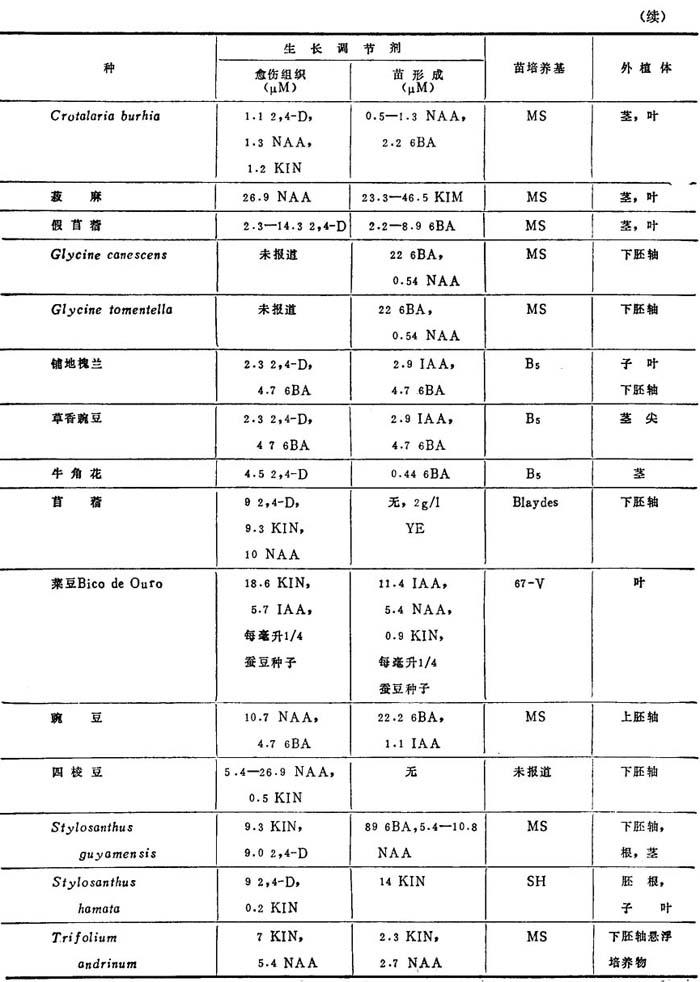
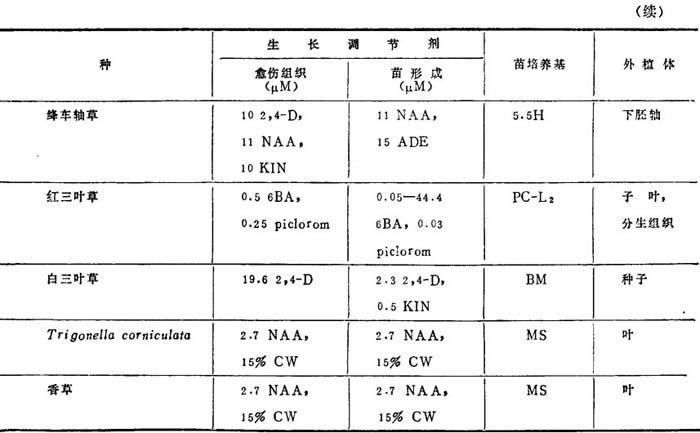
表1-8 豆类再生

(四)菊科
有几种菊科植物已从愈伤组织培养物再生植株。只有苣荬菜、 苣和Stevia rabaudiana是农业上有用的。
苣和Stevia rabaudiana是农业上有用的。
菊花的组织培养繁殖已进行了广泛的研究(表1-9)。Brachycome dichromosoma tica和Crepis capillaris由于染色体数目少,因此用于愈伤组织培养物的细胞学研究。
有12种菊科植物从离体培养的愈伤组织再生(表1-9)。通常在生长素和细胞分裂素比例大于1的培养基中发生和保持愈伤组织。常用0.5—53.7μM NAA,3—27μM2,4-D,22.8—28.5μM IAA和4.9μM IBA。在大多数场合中生长素是与0.57—4.7μM KIN结合使用的。只有在菊花中曾经报道发生和维持愈伤组织时生长素和细胞分裂素的比例小于1。也可只用10.7μM NAA培养愈伤组织。
降低生长素浓度或提高细胞分裂素浓度,可以诱导产生植株。0.19—19μM激动素在诱导培养基中最有效。只有在Stevia rabandiana用6BA,浓度为4.4—8.8μM。29μM GA3可以提高菊花愈伤组织的再生。菊科植物的愈伤组织培养物不容易失去再生能力。曾经报道从3—5年的Crepis copillaris愈伤组织和14个月的B.dichromosomatica愈伤组织中再生植株。
B.dichromosomatica的愈伤组织培养物曾保持14个月仍为二倍体。从这种愈伤组织再生的植株也是二倍体。Crepis capillaris的单倍体和二倍体愈伤组织培养物的染色体稳定性,连续检查过一年。开始为单倍体的培养物比双倍体的产生更多的多倍体。同样在多倍体中染色体重排和非整倍体也很普遍,但未报道从此类愈伤组织再生。
表1-9 菊科植物的再生

(五)其它双子叶植物
其它双子叶植物有27个科和45个种在离体培养中再生了植株(表1-10)。
曾报道玄参科的一些种再生了植株。对蓝猪耳曾进行了广泛的研究。用多种激素处理叶和节间外植体,都可发生苗。在蓝猪耳中用5种不同的细胞分裂素都能诱导成苗。在多数情况下用4.4μM6BA,4.6μM ZEA或7.3μM4-苯基脲都足以启动苗的形成,然而,细胞分裂素和生长素的各种组合也是成功的。如把节间切段培养在下述培养基上,可以诱导苗形成,即0.15μM NAA加3.25μM SI)8339(在烟草中曾用的细胞分裂素)或4.7μM KIN。加入氨基酸也可以调节Torenia的器官发生;具有谷氨酸和门冬氨酸的培养物曾形成苗。在毒鱼草、毛地黄、中国石龙尾和Mazus pumilus的培养物也有过器官发生,但在这些种中,只研究了少数激素浓度(表1-10)。
毛茛科有2个种发生了器官。从Consolida orientalis和日本黄连(表1-10)再生了植株。在Consolida,器官发生是在加有椰子汁和IAA的White培养基上进行的。在离体培养再生麝香翠雀和Clematic fouriana没有成功。
许多其它研究过的双子叶植物是经济上有重要价值的。在可再生植株的种中,常用MS培养基(24种),虽然White培养基也曾用于8个不同科的8种植物。为再生植株用了另外5种培养基。关于培养基的变化并未进行广泛的研究,也未证明有科的专有植株再生培养基。在旋花科和报春花科中各有一个种在White培养基中再生,而有另一个种在MS培养基中再生(表1-10)。
在许多种中通过器官发生的苗再生,是把培养物转移至细胞分裂素比生长素比例较高的培养基上后达到的。在有些种中细胞分裂素与生长素比例不变也能再生。有13种不同的外植体用于再生植株。对于草胡椒属和悬钩子属曾报道每个叶的外植体最多可得11—50个苗,而茎尖外植体可得20—40个苗。
少数经济上重要的被子植物树种用离体培养从细胞培养物再生。大多数场合是用幼嫩组织上切下的外植体,如胚、下胚轴、子叶、根萌条、茎段和花芽原基等。只有二例用了成熟组织。Wolter(1968)从二倍体的颤杨的形成层区发生愈伤组织,培养7年后仍能再生植株。Mehra和Mehra(1974)当用扁桃的茎和叶切片作外植体时,可从其再生二倍体植株。
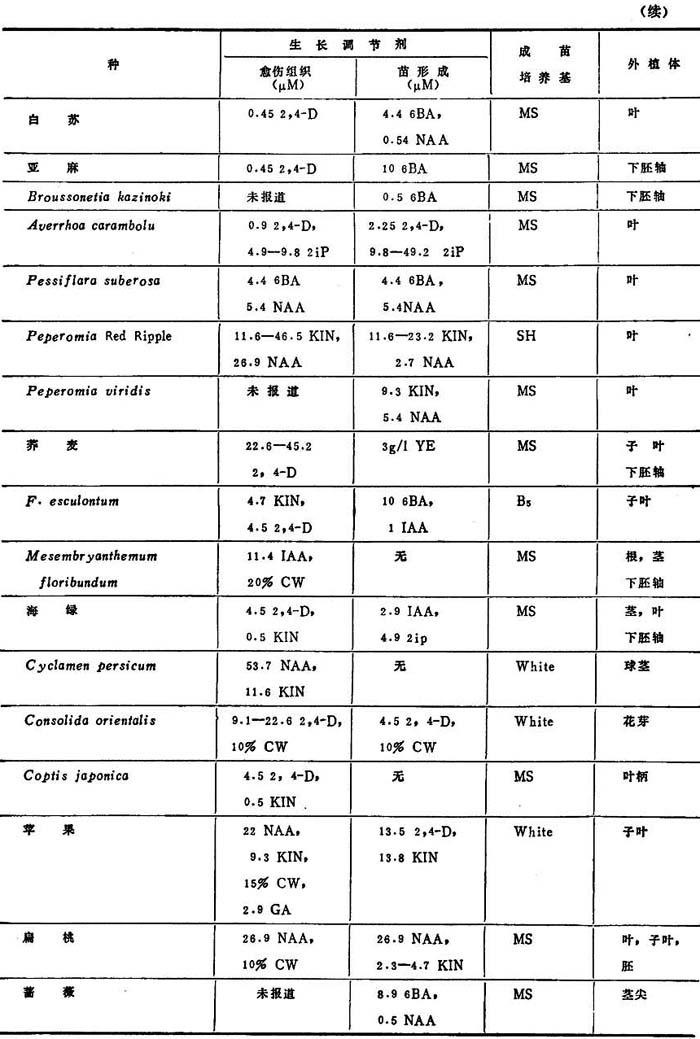
表1-10 其他双子叶植物的再生


(六)禾本科
许多双子叶植物科的种可以在离体培养中再生植株,而单子叶植物是比较难以捉摸的。禾谷类植物是一个重要的营养源,许多农业上重要的植物都属于本科。许多研究者往往只注重利用栽培作物来研究禾谷类植物的再生。因而不能比较栽培植物和相应的野生植物的再生能力。
禾草类和禾谷类这二个亚科中的种在组织培养中取得有限的成功。通常用分生组织发生愈伤组织培养物能再生植株。因此,有人推测再生的植株仅是从早就形成的结构产生的。然而有证据表明从组织培养再生植株对于玉米是有用的。
1.禾草类 禾草类用离体培养进行繁殖可能是最有利的。这些植物在自然界通常进行无性繁殖,而且可能是多倍体或是染色体数目可变化的。在甘蔗属中多倍性和染色体的不稳定性(2n=10x=80-120),使遗传型可以忍受染色体数目的变化。这种不稳定性可能有利于营养繁殖的禾草类发生遗传变异。在甘蔗和意大利黑麦草愈伤组织发生的植株都观察到染色体变化,而这种变异已成功地用于育种程序,用来选择对病害的抗性及其它农艺性状。
甘蔗无疑是已研究过的最容易进行离体培养的禾谷类植物。虽然未成熟的花序是最成功的外植体,但各种外植体都可用于再生植株,各顶端分生组织、幼叶和髓薄壁组织。经长期培养的甘蔗愈伤组织培养体也可再生植株,看来可以从完全无组织的组织再生植株。也有一些证据表明可从单细胞经体细胞胚胎发生产生植株。附加有2—13.6μM2,4-D的MS培养基用于诱导愈伤组织。甘蔗的某些再生培养基中有细胞分裂素(9.3μM KIN),但可能并非必需。在甘蔗中产生的苗难以生根;但如果把幼嫩的苗与愈伤组织分离,放在没有激素或加有IAA的培养基中,发根频率很高。
MS培养基用于培养除鸭茅以外的其它禾草类。鸭茅在SH培养基(单子叶植物专门的培养基)上生长比在MS或B5培养基上快。
外植体的来源可能限制愈伤组织的发生和增殖,在多数情况下,年幼的有序组织,如未成熟的花序、胚、种子、花序梗或叶肉曾用于产生愈伤组织。用高浓度2,4-D或2,4-D与KIN相配合,从这些复杂的外植体发生愈伤组织(表1-11)。在大多数禾草类中去掉或降低2,4-D浓度,即可形成苗(表1-11)。此外,可从一些种的培养一年以上的愈伤组织培养物得到植株(表1-11)。对大部分禾草植物而言,尚未报道植株再生频率,但在报道的种中植株再生率对苇茅属是3.1%;芦苇属是66%。黑麦草的每个培养体产生20—50小植株,假高粱的每个培养物产生5—20个小植株,每个茎外植体可以得到许多苗。在一些禾草类植物的组织培养中,从愈伤组织再生植株为白化苗,如甘蔗。这种表型变异可能反映了染色体数目的变化。
当把苗转移至新的不含激素的培养基或降低无机盐浓度或用高的生长素与细胞分裂素的比例可以发生根。
表1-11 禾草类植物的植株再生

2.禾谷类 禾谷类的植株再生的研究重点放在农业上重要的作物上(表1-12)。在大多数栽培的禾谷类作物都已报道可再生植株,但可能与已存在的分生组织中心有关,对玉米、水稻和小麦曾经进行了广泛的研究。在这些作物中无疑玉米是最难于控制的,因为只能从有序的外植体得到植株。
(1)玉米 玉米可从多种外植体诱发愈伤组织,但再生植株的能力是有限的。幼胚被最广泛地用于发生有植株再生能力的愈伤组织。MS培养基用得最广泛。2,4-D是诱发愈伤组织的唯一激素,浓度为2.3μM到67.8μM。4.5μM2,4-D再加21.5μM NAA和0.24μM2ip可促进愈伤组织的生长。当培养幼胚时,盾片必须保持朝上,如培养幼嫩种子时盾片要向下,这样形成的愈伤组织最多。除去2,4-D可以再生植株。King等认为,玉米和大多数禾谷类植物在诱导愈伤组织时苗原基被2,4-D抑制了,去掉2,4-D后,原先存在的苗原基被解除抑制而再生植株。然而从盾片发生的愈伤组织继代培养物再生能力维持了19—20个月,只有16个玉米品种在离体培养中测试了它的再生能力,结果各不相同。这16个遗传系中只有3个保持了稳定的再生能力,A188和A188×R-navajo和Pior品种。Green认为在玉米品种中再生是与遗传型有关。
(2)小麦 栽培小麦研究得比玉米详细。在6个不同的实验室中研究过的15种栽培品种中,只有在5个种中有过植株再生。在小麦属的野生和栽培的许多种中发生了愈伤组织。Gosch-Wackerle等(1979)从小麦属的7个种的花序梗、胚等发生了愈伤组织,这些种是二倍体的一粒小麦,高大小麦,拟斯卑尔脱小麦和节节麦(2n=14),四倍体(提莫菲维小麦和圆锥小麦,2n=28)和六倍体(普通小麦,2n=42)。用T培养基加4.5μM2,4-D从胚发生愈伤组织。节节麦在这种培养基上形成的愈伤组织最少。其他实验室的结果证明这7个种的形成愈伤组织的能力。此外,从高大小麦的一个非整倍体系也发生了愈伤组织。在7个系中只有一个系difelo-IA愈伤组织的生长速度比正常小麦小。从小麦属的三个种再生了植株(表1-12)。从胚发生的愈伤组织再生频率最大,可达45—68%,这种愈伤组织是在加9μM2,4-D的MS培养基上发生,然后在这种培养基上继代一、二代后,再接种在含有4.6μM ZEA和5.7μM IAA的培养基上。愈伤组织很快失去器官发生能力。
(3)水稻 水稻可能是离体培养中可以再生的最重要的植物。用MS培养基加9—45.2μM2,4-D可以从水稻的许多幼嫩外植体得到愈伤组织。从种子、幼胚及成熟胚、根尖、盾片、胚芽、茎和花序等发生的愈伤组织都能再生植株。在每种情况下都是从培养基中除去2,4-D后得到苗的。尽管形成苗并不是一定要细胞分裂素和生长素,但是加0.3—19.7μM 2ip或79.9μM和9.3μM KIN可增加形成苗。从幼根和叶外植体得到的愈伤组织,培养4个月植株再生率可达100%。水稻愈伤组织的年龄与成苗率成反比例。
(4)其它 燕麦、大麦和若干别的禾谷类也能再生(表1-12)。每一个种的愈伤组织增殖培养基中都有2,4-D,而再生培养基没有一种含有2,4-D的。用几乎总是包含组织化的苗端幼嫩组织发生愈伤组织。在燕麦中愈伤组织的再生能力可以保持12一18个月,在大多数种中再生能力只能保持少数几代(1—4个月)。燕麦中遗传型是植株再生能力的一个重要因素。在离体培养的24个遗传型中,只有9个可以再生植株,其它5种植株再生能力很低。在MS培养基中加22μM2,4-D或SH培养基中加9.1μM2,4-D和10.7μM CPA可从种子产生愈伤组织,在B5培养基加2.4—13.6μM2,4-D可从幼胚发生愈伤组织。在每种情况下再生植株必须去掉2,4-D。虽然没有激素的培养基足以从各种外植体再生植株,但Lorz等(1976)用三种激素的搭配也再生成植株(表1-12)。
从大麦茎尖、成熟胚和幼胚愈伤组织曾得到大麦植株。从7个大麦品种的胚胎发生的愈伤组织中,有4个种得到了植株。当把愈伤组织从有2,4-D的培养基上转移到无激素的培养基上时,在B5培养基上50%从幼胚得到的植株比例比在MS培养基上的19%高,从高粱幼苗地上部分、幼胚和成熟胚发生的愈伤组织能再生植株。尽管用的是有序的组织,可以得到许多苗。对高粱的植株再生,MS培养基比B5培养基好。可以用5—67.8μM2,4-D诱导愈伤组织(表1-12)。如果转移至再生培养基上,在1—2个月内可以再生植株。从幼胚发生的愈伤组织再生频率为20—50%。高粱再生植株是依赖于生长素。在有2,4-D存在时,只有同时加入高浓度细胞分裂素,如10-50μM ZEA才可能再生植株。把愈伤组织转入加有IAA,NAA或6BA、NAA和GA3的培养基中再生的苗和植株最多。
四种狗尾草的中胚轴组织在MS培养基上再生了植株。用4.5μM2,4-D也可再加10-15%椰乳诱导愈伤组织。去掉2,4-D(稷)或用IAA或NAA替代2,4-D就可再生苗。在愈伤组织发生后3—4个月中,所有4个种的再生频率为36—38%。
黑麦是在体外培养中尚未进行过试验的主要禾谷类植物,虽然黑麦的花药培养已再生植株。而且,小黑麦(AD-20)在离体培养中已经再生植株,其行为象小麦。
表1-12 禾谷类植株再生


(七)百合科
一些农业上重要的百合科植物已从愈伤组织培养物再生,如洋葱、大蒜和韭葱。还有一些园艺上重要的百合科植物也在离体培养下再生(表1-13)。
至少有21种百合科植物从愈伤组织再生(表1-13)。蛇尾兰属一些种已成功地应用其它植物的再生程序。发生和保持愈伤组织通常用MS和LS培养基。外植体的来源并不影响培养物的成功与否,如休眠组织鳞茎和活跃代谢的组织,如茎切段、叶、叶柄、花序切段都曾培养成功(表1-13)。百合科的愈伤组织诱导和培养时需高浓度的生长素,如11.4—45.6μM IAA,0.64—43μM NAA或0.54—9.1μM2,4-D。大多情况下,同时含有细胞分裂素,通常是1—10μM KIN。麝香百合可在没有植物激素的情况下诱导愈伤组织。
降低生长素浓度或提高细胞分裂素的浓度可以诱导百合科植物的愈伤组织再生植株(表1-13)。在暗培养中常常可以增加形成苗。百合科植物体外培养物的染色体是不稳定的,然而,如果直接从外植体再生植株就不会发生这种情况。大蒜、好望角虎眼万年青和洋葱的愈伤组织,培养时间延长,染色体数目增加。然而,Sheridan(1975)把麝香百合二倍体的愈伤组织培养了6年,其染色体和再生能力都无变化。从这种愈伤组织再生的植株是二倍体。
表1-13 百合科植物的再生


(八)其它单子叶植物
另有4种分属于4个科的单子叶植物在体外培养中再生(表1-14)。所有这4种植物在诱导愈伤组织增殖时都需要生长素,而在苗再生时要降低生长素浓度。只有三角叶薯蓣的愈伤组织培养基需要细胞分裂素,Anthurium andraeanum在诱导苗的培养基中要低浓度的生长素。在大多数植物中用了幼嫩的胚性组织,但也可以从成熟的叶外植体再生植株。这些单子叶植物在形成苗以前,其愈伤组织都已培养过相当长时间,Ddeltoidea的愈伤组织在至少继代培养12个月以后,仍然保持再生植株的能力。龙舌兰和Anthurium andraeanum无再生植株能力前也在离体培养下近一年。
表1-14 其他单子叶植物的再生

虽然各种植物都用MS培养基,但这些单子叶植物也可能需要特殊的营养物质。如果 和
和 的浓度从20.6降低至2.57mM,那么A.andraeanum的生长加快了,如果向MS培养基中加1.23mM NaH2PO4,菠萝的生长可以加快。这些变化说明,在双子叶植物中常用的培养基配方,对于单子叶植物可能是不够的。
的浓度从20.6降低至2.57mM,那么A.andraeanum的生长加快了,如果向MS培养基中加1.23mM NaH2PO4,菠萝的生长可以加快。这些变化说明,在双子叶植物中常用的培养基配方,对于单子叶植物可能是不够的。
(九)木本裸子植物
有14种木本裸子植物再生了植株。既有器官发生也有胚胎发生。大多数研究与森林树种的营养繁殖有关。木本裸子植物再生的主要限制因子是外植体的来源,而且在离体培养繁殖必须应用年幼的组织,如胚或幼苗(表1-15)。使用幼龄组织就不能选择性地繁殖生产上有用的树种。在Winton的评论中列出许多植物可以在离体培养再生,有人提出,在有些情况下,再生只表明早就存在的苗原基的脱抑制。
裸子植物再生与被子植物相似。有一些例子可从成熟的针叶再生,如黄杉、欧洲赤松、挪威云杉,也可以从侧根顶端和幼龄组织再生苗(表1-15)。许多例子只是直接从外植体再生,而不经过愈伤组织,如白云杉和南欧海松。
裸子植物的再生曾用各种培养基。黄杉的再生用各种培养基都能成功(表1-15),因此培养基的成份并不是关键。在培养基中有0.5—50μM6BA通常可以再生苗。在再生培养基中有低浓度的生长素。Cheng(1976)证明低浓度的生长素如0.5—5μM NAA可促进黄杉苗再生。当细胞分裂素与生长素比例小于1也可再生苗。黄杉可在加有4.5μM2,4-D或加有24.7μM NOA和0.4μM6BA的培养基上再生。Harvey和Grasham(1969)报道了14种针叶植物的愈伤组织培养物,但显然不能再生植株。
把离体培养再生的木本裸子植物种移栽至土中,常不能成功,有时是因为在苗和根之间没有可靠的维管束联系。离体的松柏类植物的苗很难生根。只有当能够从成年树的组织可以高频率地再生苗,而且苗能生根时,木本裸子植物在离体培养再生才有实用价值。
表1-15 松科植物(裸子植物)的再生


【参考文献】:
〔1〕Evans D.A.,Sharp W.R.and Flick,C.E.1981 Growth and behavior of Cell Cultures:Embryogenesis and Organogenesis.In:Plant Tissue Culture:Methods and Application in Agriculture(T A Thorpe,ed)pp.45—113,Acaoemic Press,New York.
〔2〕DAmato,F.1977 Cytogenetic of differentiation in tissue and cell cultures.In: Plant Cell Tissue,and Organ Culture(J Reinert and Y P S Bajaj,eds)pp.343—357,Springer-verlag,New York.
〔3〕Murashige,T.1974 Plant Propagation through tissue Cultures.Ann.Rev.Plant Physiol.25:135—166.
〔4〕Thorpe,T.A.1980 Organogenesis in Vitro:Structural,Physiological and biochemical aspects.Int.Rev.Cytol.Suppl.11A: 71一112.