原生质体培养程序
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第71页(9024字)
(一)培养基成分
培养植物细胞和原生质体的营养需要是极相似的,原生质体培养基通常多是用细胞培养基改良而来是不奇怪的。细胞培养基中最普遍用作原生质体培养基的基础是B5和MS培养基。为了原生质体的适宜生长更换了这些培养基和其他细胞培养基。
标准细胞培养基的铁、锌和氨的浓度对一些原生质体太高。发现特别是铵决定着原生质体生存,和为了许多植物如马铃薯、番茄和烟草而设计的培养基都无氨。另外,钙的浓度增加2—4倍,超过用于细胞培养的正常浓度。提高钙浓度能改善膜的稳定性。
虽然大多数原生质体选用葡萄糖作碳源,而有些植物如雀麦选用其他碳源包括蔗糖较好。Uchimiya和Murashige(1976)指出,烟草原生质体宜用蔗糖,纤维二糖或葡萄糖。大多数原生质体培养基含有多种碳源的混合物。用于番茄的培养基中蔗糖和葡萄糖以2∶1比例混合。有许多系统,加入次生碳水化合物是有益的。高和Michayluk(1975)发现加核糖有利。在某些情况下,适宜的碳源(葡萄糖)也是适宜的渗透剂。另外,在有些情况下,非代谢渗透剂是必要的。例如,豌豆原生质体只有甘露醇和山梨醇才能用作渗透剂。
原生质体培养基加有大量有机营养物。多数情况下,植物细胞和原生质体需要的维生素是相同的。Von Arnold和Eriksson(1977)指出,加叶酸促进豌豆叶肉原生质体培养物的细胞分裂。Kao和Michayluk(1974)建议向极低密度原生质体培养物加入几种维生素、有机酸、糖、糖醇和未确定营养物如酪朊水解物和CW。虽在多数情况下,其中许多因素对原生质体培养是不必要的。例如,CH或酪朊水解物加到许多不同原生质体培养物中,Uchimiya和Murashige(1976)认为应从最终培养基中除去它,因用它并不有利。
生长调节剂的类型和浓度是变动最频繁的的培养基成分。生长调节剂的敏锐变化显出在培养细胞上的戏剧性的影响。2,4-D是用于原生质体培养基的最普遍的生长调节剂,虽然,在某些情况下,也选用其他生长调节剂。Uchimiya和Murashige(1976)看到烟草原生质体培养物用NAA比2,4-D或IAA的细胞增殖速度高。还有,细胞分裂素对诱导烟草原生质体细胞分裂显然是不必要的。Von Arnold和Eriksson(1977)报道诱导豌豆叶肉原生质体的细胞分裂需要生长素(2,4-D)和细胞动素(2iP)两者。
(二)培养密度
已发表的程序表明,原生质体培养密度为每毫升5000—100000个细胞。然而,更有兴趣的是单个游离原生质体培养物的再生。游离原生质体培养物对基团饰变实验特别有用,象原生质体融合或诱变后的单细胞克隆的选择。高和Michayluk(1975)完成野豌豆类的培养细胞和原生质体在不同密度上营养要求的最广泛的研究。野豌豆细胞以每毫升2—5600个细胞的9种不同密度培养。相当简单的B5培养基能维持每毫升>250个细胞的生长。只有细胞培养基8P、含有2,4-D、ZEA、NAA和一些氨基酸并补加糖和未知生长附加物的B5培养基能维持每毫升<10个细胞的生长。类似地,用悬滴培养法培养原生质体,仅8P培养基能维持每毫升少于10个原生质体。
Kao(1977)改良这个培养技术用于原生质体融合后培养游离异核体。Gleba(1978)用微分离培养单个烟草原生质体。原生质体做成<2μl的极小微滴,使得有效原生质体浓度仍高。Gleba(1978)发现在微分离前3天高密度原生质体培养导致较高植板效率。
Raveh和Galun(1975)用辐射喂饲细胞作为辅助物来培养低密度烟草原生质体。利用一层喂饲细胞能成功地培养每毫升5—50个原生质体。因此,这种方法在原生质体衍生的克隆上是有价值的。
(三)培养技术
讨论的原生质体培养的几种方法,它包括小滴培养、琼脂培养、复合培养、喂饲层和悬滴培养。
小液滴方法是Kao等(1971)创立的。它包括在培养基中悬浮原生质体和吸取0.1—0.2ml小滴放入60×15mm塑料培养皿。每个平板培养5—7滴。把平板用石蜡膜密封后进行培养,这个方法用倒置显微镜进行观察极为方便。新鲜培养基易直接加入正在发育的悬浮体中,每5—7天加一次。然而,在多数情况下,培养的原生质体集积在悬滴的中央。
Koop等(1985)改进微滴原生质体培养技术,适用于个别原生质体的培养。其设计见图3-1和图3-2。把20—80nl培养基埋藏在1μl矿质油中,每张盖玻片(24×40mm)加50滴等距离成排列的培养基,加1nl烟草叶肉(cv·xanthi)原生质体悬浮体,其优点在于各个原生质体完全分隔开。游离原生质体培养后2天分裂,10天内90%原生质体再生成微愈伤组织,2—3个月产生再生植株。总再生率为50—60%。

图3-1 单细胞培养的植板装置

图3-2 制备微滴过程
琼脂培养法,无论是原生质体与0.6%琼脂混合前在液培时再生细胞壁,或是在原生质体游离后,立即放在琼脂培养基上。我们应用的方法是将原生质体同等体积的处在45℃的琼脂培养基混合,此法已成功地应用于烟草原生质体培养。然后把少量原生质体琼脂混合物制成平板。使用这个方法,原生质体处在固定位置,所以避免原生质体集积,可以追踪分开的克隆。
琼脂培养方法结合饲养原生质体的想法能提高某些难培养原生质体的植板效率。Raveh等(1973)把经x-辐射的无分裂能力的烟草原生质体,与低密度的正常而有活力的烟草原生质体混合,然后把有活力和无活力原生质体混合物制成0.6%琼脂平板。也可采用饲养层法,即把经x-辐射不能分裂的饲养细胞先与0.6%琼脂混合,然后植板,再将有活力原生质体与0.6%琼脂混合,把它成层植板在x-辐射饲养层细胞上面。
另一个原生质体培养技术是,已报道复合培养能改良某些植物的原生质体植板效率。将迅速生长的如烟草悬浮培养物的原生质体同十分难培养植物的原生质体以不同比例混合。这个迅速生长的原生质体可能给另一种原生质体提供生长因素和未知化学物质,它们有利于原生质体的细胞再生和细胞分裂。同样地,Menczel等(1978)用微量吸管技术分开原生质体衍生的单个细胞,并把它们转移到白化细胞的看护培养物上。根据克隆颜色,可以区分从单个原生质体产生的绿色克隆和白化细胞产生的白化克隆。Menczel等(1978)用这个方法发现了随原生质体融合后产生的分开杂种细胞。
悬滴方法能培养每个滴比常规小滴方法较少的原生质体。这个方法简化了小群原生质体分析,它可在倒置的液体0.25—0.50μl液滴中培养原生质体。培养单个原生质体更适宜方法有Kao(1977)和Gleba(1978)使用过的微分离方法。这个方法是机械地分开成单个原生质体,放在分开的培养池中,然后,能长期追踪这些单独原生质体。Cuching(1982)提出运用显微操作器人工选取单个原生质体进行分别培养,更适于追踪各个原生质体的发育状态和其再生植株或融合杂种细胞的遗传变异。
(四)原生质体活力试验
检测原生质体活力的最常用染色方法有酚藏花红和荧光增白剂,当在细胞膜中积累萤光素二乙酸(FDA)时,在5min内,活的完整原生质体发出黄绿色萤光。溶解在5.0mg/l丙酮中的FDA加到原生质体培养体,使最终浓度为0.01%。原生质体破裂散出的叶绿素发出红色萤光。因此,原生质体制剂中的活原生质体百分率容易统计。虽然,用FDA处理的原生质体必需在染色后5—15min之间进行检测,因15min后,FDA从膜中游离出来。
酚藏花红也是用0.01%最终浓度,它对死亡原生质体是专化的。把它与原生质体制剂混合后染色,无生活力原生质体立即染成红色。活原生质体仍未被酚藏红染色,即使染色30min后也仍不染色。
或许是最普遍应用于检查原生质体活力的染色,它能检测开始细胞壁再生。荧光增白剂(CFW)束缚新合成细胞壁中的葡萄糖苷的β-键。当0.1m1原生质体与0.5μl0.1%的CFW溶液混合实现适宜染色。用质膜周围萤光环观察细胞壁合成。也可用CFW染色细胞分裂板。
用于检定原生质体活力的其他方法有:观察胞质环流,排斥Evans蓝染料,随渗透改变的原生质体体积变化,氧吸收研究和光合作用活性。
原生质体活力试验是重要手段,特别是当为了生化研究的原生质体制备。虽然,原生质体的真正活力是原生质体能通过持续有丝分裂,再生成愈伤组织,并最终再生成植株。
(五)细胞壁形成和持续分裂
一般认为细胞壁再生是核和细胞分裂的先决条件。然而,至少有一个例子,无细胞壁再生时,也观察到核分裂。用电子显微镜研究了培养烟草原生质体的细胞壁再生过程,这些研究指出,新游离的原生质膜含有突出的微管,它在新合成纤维素微丝的方向上有作用。这些纤维素微纤丝是在烟草对数生长期2天后合成的。Asamizu等(1977)报道,纤维素微纤丝首先合成的比以后合成的短,其中新合成的一些纤维围绕微管的方向。这个偶然的纤维素基质终成加厚,纤维方位与质膜平行,导致形成连续细胞壁。
细胞壁再生的速率和调节,决定于植物种类和用于原生质体游离的受体细胞的分化状况。烟草属、矮牵牛属、蔓陀罗属和芸薹属的叶肉原生质体都很快形成新细胞壁。在24h内,在光学显微镜下观察到圆形原生质体变成卵圆形,并可用CFW染色检测到细胞壁。另外,有的报道,禾谷类和豆科植物叶肉原生质体不能形成细胞壁。
在一些种植物上观察到称为原生质体出芽的不完全细胞壁再合成。发生出芽被认为是由于果胶未进入新细胞壁,并且是出现在新合成细胞壁的薄弱区。
控制细胞壁合成,除了遗传因子之外,培养基成分对细胞壁再生也是重要的。例如,蔗糖浓度超过0.3M和山梨醇超过0.5M时,抑制细胞壁形成。在难培养成功的植物中,如燕麦,加入某些化学药品对细胞壁再合成和细胞分裂是重要的。证实某些种植物,细胞壁的再合成要求一定生长调节剂。然而,常用的生长调节剂如2,4-D和ZEA对细胞分裂的调节作用显然比细胞壁再生更重要。
第一次细胞分裂依赖于壁的形成,但在少数植物上,看到细胞分裂早于壁的形成。许多因子对开始细胞分裂是重要的,如受体植物的基因型、培养基、环境培养条件和用于原生质体游离的受体组织条件。例如,用迅速生长的常常通过第一次分裂的细胞的细胞培养体游离原生质体,比叶肉原生质体更快。影响受体组织条件的许多其他因素也影响培养原生质体通过细胞分裂的能力,它包括有黑暗前处理、植株年龄、施用肥料、使用到受体植物上的除莠剂。
多数情况下,培养的原生质体植板效率极低。能从原生质体再生植株的一些植物,已报道初始植板率小于1%。然而,证实研究者们未试图取得最佳植板效率,在文献中已有1—90%植板效率的报道。Banks和Evans(1976)报道林烟草叶肉原生质体的植板效率仅1%,而Nagy和Maliga(1976)改进培养程序,报道同一种植物的植板效率达60—90%。
合成的细胞壁不同于完整植株细胞壁。当第一次细胞分裂时,频繁地看到不完全胞质分裂导致自然融合和产生多核原生质体。多数情况下,这些多核原生质体不会连续生长。然而,从原生质体再生植株中常看到多倍体植株,似乎从核融合产生的若干多核原生质体能连续生长和分化。
有些情况下,在第一次分裂之前看到了对数期。报道过棉花原生质体的对数期长达到25天。虽然,多数情况下,健康原生质体培养后2—7天通常已发生第一次细胞分裂。随后更快地发生分裂导致多细胞团。原生质体迅速生长时,每1—2周加入新鲜培养基。明显的愈伤组织形成常发生在起始培养基上培养原生质体2—3周时,细胞开始迅速生长时,加入新培养基可慢慢降低渗透压。愈伤组织形成后,可用苗再生培养基代替原生质体培养基。通常,愈伤组织从液滴培养转变为固体培养,以便进行苗再生和随后幼小植株再生培养。
(六)植株再生
原生质体植株再生常被看作限于茄科植物的现象。确实的,38种茄科植物已从培养原生质体再生成植株(表3-7)。它们包括17种烟草植物,6种矮牵牛属植物和6种茄属植物,而多数是无经济价值的,若干经济上重要的作物(烟草、马铃薯、茄子和胡椒)和观赏植物(矮牵牛属,Sal piglossis,Browallia和烟草属)已从原生质体再生成植株。愦憾的是,即使茄科植物,原生质体植株再生已尽了最大努力,也只有个别重要作物的栽培种——番茄和马铃薯已从原生质体再生成植株。
从愈伤组织、细胞悬浮体、叶、苗尖和花瓣游离的原生质体都能再生成植株。原生质体再生的多数方法随植物种和受体组织间变化(表3-7)。企图将某种植物的再生方法一般化是困难的。大多数作者用于原生质体起始生长不是用MS(包括NT培养基)就是B5(包括8P、培养基)培养基(表3-7)。虽然激素浓度随品种和种而变化,生长素和细胞分裂素几乎常常用作起始培养基。几乎每种情况,在起始培养基中,生长素浓度都比细胞分裂素高。至少有18种植物,在无生长素而仅用激素(即ZEA,6BA或2iP)的培养基上再生成植株。
许多茄属植物原生质体培养在黑暗中短时期,再转到光下培养。多数情况下,原生质体培养在漫射光下,光强为400—1500lx。而植物原生质体多数在室温下培养,已建议某些种植物要提高温度到28—29℃。
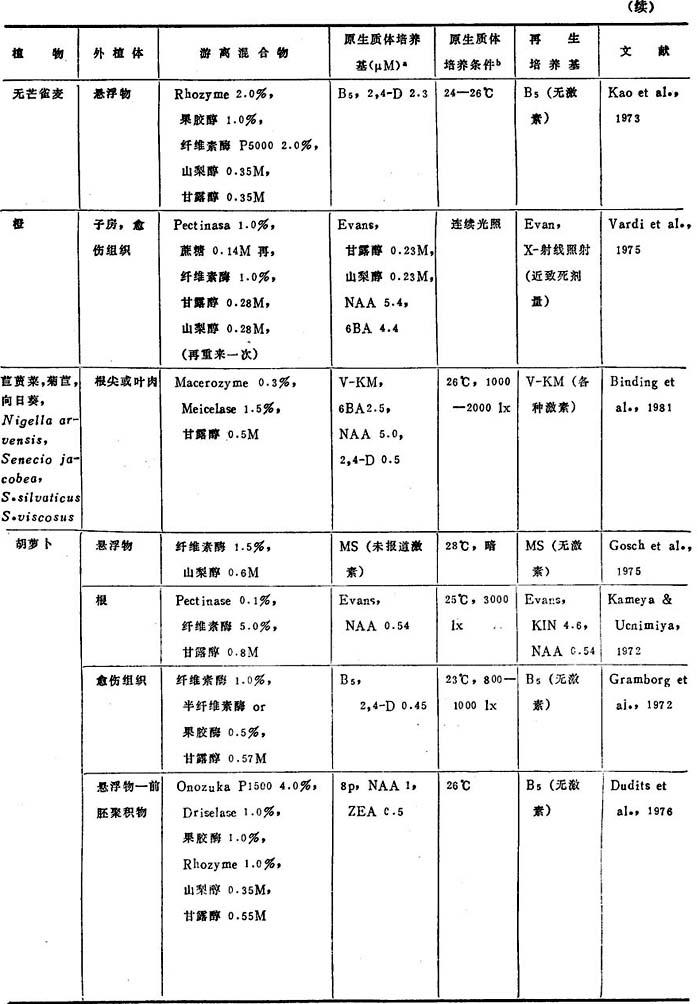
表3-7 茄科植物原生质体的植株再生过程






a.表7、8、9中的培养基:
BSH Schenk & Hildebrandt,1972
Kao, Kao,1977 Ohyama Ohyama & Nitsch,1971
Lam Lam,1975 8p,6p Kao & Michayluk,1975
B3 Sacristan & Melchers,1969
LS Linsmaier & Skoog,1965 To Bourgin et al.,1976
MS Murashige & Skoog,1962 Upadyha Upadyha,1975
B5 Gamborg et al.,1968 Nitsch Nitsch & Ohyama,1971 V-KM Binding & Nehls,1977
DPD Durand et al.,1973 Nitsch & Nitsch,J·P·&Nitsch, V47 Binding,1974
F5 Frearson et a1.,1973 Nitsch C·,1969 Z Zapataet al.,1977
Green Green,1977 NT Nagata & Takebe,1971
Kao3 Ka.o et al.,1974
b.培养条件:光—暗周期表示为光:暗(h),即,(15∶9)=i5h光和9h暗
近年来,非茄科植物能从原生质体再生植株的名录已坚定地扩大了(表3-8)。这个名录中包括了28种双子叶和单子叶植物。在这28种植物中,包括了若干经济上重要的作物,它们是胡萝卜、苦苣、木薯、苜蓿、珍珠粟、三叶草、油菜、无竺葵、甘蓝和柑桔。原生质体植株再生仍然有点限于一定植物族。例如,这个名录包括十字花科和伞形花科的许多种植物。然而,最近成功地报告豆科(苜蓿属)和禾谷类(狼尾草属水稻和黍属)锦葵科陆地棉(1986)的植株再生,这是鼓舞人心的,因为这些族通常都被考虑是不可能再生成植株。
植株再生的多数报告,不如培养基成分和环境条件的详尽实验那样完善。因此,不可能把这些植物再生植株的一般程序普遍化。在常用培养基取得有限的成功之后,极少数作者创立了他们自己的培养基。这点表明,培养基成分对原生质体培养比外植体培养更重要。在多数情况下,原生质体培养都用室温,说明温度不是关键。然而,不同植物种之间的适宜光强度有显着变化,可从完全黑暗到80,000lx。使用的植株再生培养基也随植物种而改变,例如,胡罗卜愈伤组织在无激素B5或MS培养基通过胚胎发生,而黍属细胞悬浮培养体在1—2μM2,4-D的MS培养基上再生植株。因此为了植株再生策划从原生质体恢复迅速生长的愈伤组织,并把愈伤组织转移到种的特殊再生培养基上。
表3-8 非茄科植物原生质体的植株再生程序

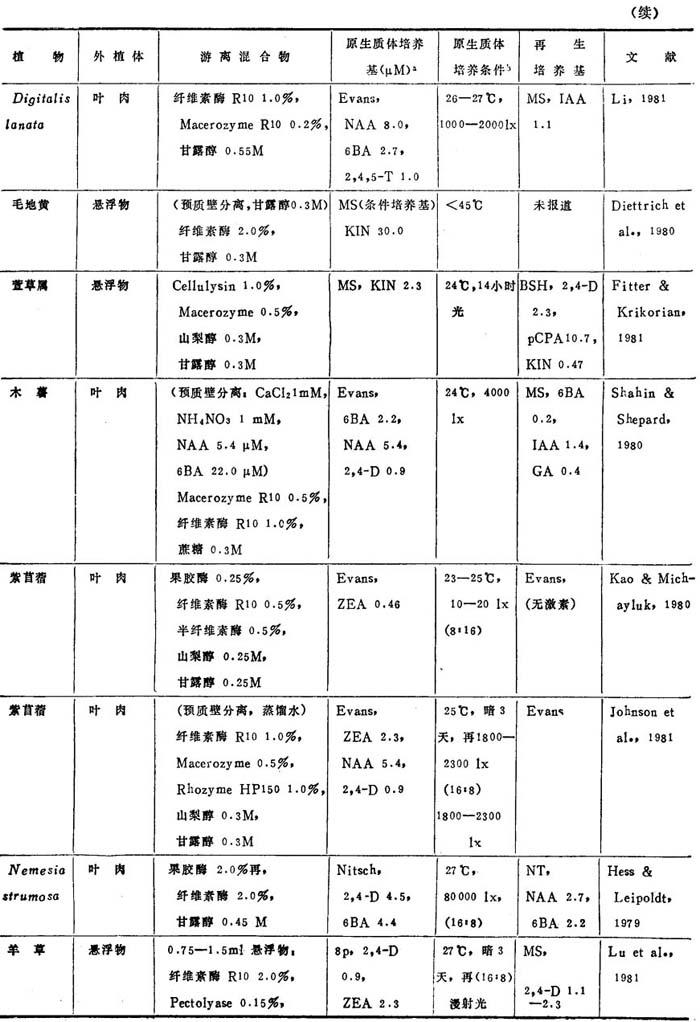

a.见表3-7脚注。
b.见表3-7脚注。
【参考文献】:
〔1〕Caboche M.1980 Nutritional requirements of protoplast-derived haploid tabacco cells grown at low cell densities in liquid medium.Planta 149:7-18。
〔2〕Erikason T.1977 Technical advances in protoplast isolation and cultivation.In: Plant Tissue Culture and Its Biotechnical Application(W.Barz,E.Reinhard,and M.H.Zenk,eds.)pp.313-322,Springer-verlag,Berlin.
〔3〕Gamborg,O.L.,Shyluk,J.P,and Shahin,E.A.,1981 Isolation,fusion,and culture,of plant protoplasts.In: Plant Tissue Culture: Methods and Applications in Agriculture(T.A.Thorpe ed.)pp.115—154,Academic Press,New York.
〔4〕Kao,K.N.and Michayluk,M.R.1975 Nutritional reguirements for growth of vicia bajastana cells and protoplasts at a very low population density in liquid media,Planta 126:105—110.