影响雄核发育的因素
出处:按学科分类—生物科学 农业出版社《植物细胞培养手册》第126页(4891字)
已指出,花药培养诱导单倍体可能受种的限制,在少数科的种,例如茄科和禾本科。可是,现已知道,尽管能诱导雄核发育的几个种都属于这两个科,但在很多其他种中,也获得了雄核发育,只是频率较低。的确,花药培养工作者面临的主要问题之一是雄核发育频率低。因此,现在注意力集中到影响提高雄核发育频率的因素上。下面将讨论雄核发育影响的某些因素,这些因素的控制有可能提高生产单倍体效率。
(一)基因型
植物基因型是影响离体诱导单倍体成功的最重要因素之一。在培养中,反复看到不同种和栽培品种存在不同的生长反应。Gresshoff和Doy(1972)用43个番茄栽培品种和18个拟南芥品系,都只有3个栽培品种或品系能诱导单倍体组织。水稻上也观察到相同的趋势。烟草属、茄属和黑麦的不同种单倍体的诱导百分率显着不同。同样,21个小麦栽培品种(表5-2),仅有10个的花药得到了单倍体组织。
表5-2 基因型对小麦花药培养的影响

(二)植株的生理状态和年龄
根据一般经验,植株年龄和生理状态对雄核发育的效率有相当大的影响。取相对年幼植株上开花始期的花比开花末期植株上的花更适当,也观察到如果每2周用Hoagland溶液浇灌,烟草花的生活力保持较长。而且,植株生长的温度是重要的,一直生长在24℃下的蔓陀罗属植株其雄核发育频率(45%)比生长在17℃(8%)下的高。可是,培养生长在较低温度的蔓菁植株的花药得到较好的结果。除去蔓陀罗属老花和小麦花序顶端部分,可导致其雄核发育频率增高。已观察到大田小麦植株的花比温室植株花健壮。由于光照和温度变化是季节变化的结果,因此,首要的是让植物在最适宜的条件下生长,定期地施肥灌水,并用年幼植株作材料。
(三)花粉发育时期
雄核发育不仅受体植株的年龄和生长环境条件的影响,而且所取的花粉时期也是最关键的。例如,已知烟草和番茄需用四分体时期的花粉诱导雄核发育,和某些裸子植物其花粉粒已有4—5个细胞。可是,表5-1的资料表明,花药培养要用含第一次有丝分裂前或期间的单核小孢子效果较好(表5—3),而离体花粉培养要用二核期的花粉粒效果较好。而且,花粉时期影响再生植株的倍数性水平。烟草、蔓陀罗属和天仙子属用单核期花粉进行培养所得到的植株是单倍体,而用更迟时期的花粉进行培养,所获得的植株表现出不同的倍数性水平。
表5-3 在不同蔗糖浓度中诱导的愈伤组织的植株再生

(四)高低温效应
已看到伴随某些损伤而自然和人为诱导产生单倍体。用温度操作能诱导卵细胞向孤性生殖发展。早在1922年,用低温处理受精的植株,Blakeslee等得到了蔓陀罗单倍体。Povolochko(1937)把烟草植株暴露在低温和高温下,也获得了单倍体。同样,Muentzing(1937)和Noerdenskiold(1939)用低温(3℃)处理得到黑麦单倍体。所有这些单倍体都来源于卵细胞。卵细胞和花粉易于遭受这种损伤。Stow(1930)和Sax(1935)观察到了热的冲击使植物改变小孢子核的分裂方式。进一步观察到冷处理使风信子花粉丧失雄性潜力,成为与8核胚囊相似,热或冷或冷热交替处理花芽和完整植株,对提高雄核发育是有益的。也报道矮牵牛植株放在低温中24—48h,导致核不正常发育,如出芽和融合。高低温对花药培养的刺激效应,已成功地应用于蔓陀罗、番茄、颠茄和烟草的花药培养。冷处理和离心,冷处理和活性炭的综合效应,分别如图5-6和表5-4所示。
表5-4 不同外源因素对花药雄核发育频率和每个花药再生植株数的影响
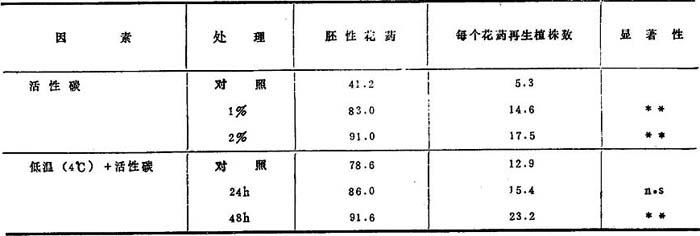
* *=在P<0.01时,n·s=不显着
已报道了冷处理和短暂高温能刺激花粉发生反复分裂。例如,在30℃下24h或40℃下1h刺激芸薹属花粉的雄核发育。高低温似乎引起微管的溶解和纺锤体解体,导致小孢子核的不正常分裂。
冷处理的作用是间接的,雄核发育频率提高主要地归结于低温(3—5℃)使花粉保持较长的生活力,延迟衰老和防止花粉败育,因此增加有效的存活花粉数,这些花粉可形成胚。
(五)化学处理
已知用各种化学药品诱导孤性生殖。Yasuda(1940)用化学药品Belvitan处理矮牵牛属的子房,观察到刺激卵细胞反复分裂。同样用秋水仙碱处理,Smith(1943)和Levan(1945)分别地得到了郎氏烟草和甜菜的单倍体植株。在甜玉米上,用50mg/l顺丁烯二酰肼使诱导单倍体的效率由2.7/1000增加到7/1000。也考虑到用不同的生长调节剂和激素喷施植株。在这方面,使用乙烯利(Ethrel)得到了一些有意义的结果。它对配子体发生作用,从而发生雄性不育。Bennet和Hughes(1972)证实在花粉母细胞正在减数分裂时,用乙烯利喷施中国春小麦,因发生额外有丝分裂,使多核花粉增多。在苜蓿属和紫露草属、矮牵牛属、烟草属和一些小麦栽培品种中观察到了诱导额外核分裂和核群的形成。
用1000—2000ppm乙烯利喷施烟草植株,在2天内花脱落,而用250—500ppm时,花受伤,如在1周之内,花转黄并脱落。用100ppm喷施花芽,营养核偶而发生分裂。从这种芽(喷后10天)上取花进行培养,其雄核发育提高了25%,可是,花药增殖而形成褐色的愈伤组织,但再生的苗有变黄的趋势。
和烟草相比,小麦植株相对地抗乙烯利。在高浓度(800ppm)时小麦植株损伤厉害,大多数的叶死亡,但后来长出新苗。花药枯萎并含有少数退化的花粉。在低浓度(500ppm)时未观察到有明显作用。用4000ppm乙烯利处理植株时,同对照比较,花药含有带较少淀粉粒的4—6个核的花粉。在培养时,乙烯利处理的花药偶然发生增殖。进一步看到不仅在有丝分裂前,也在花粉第一次有丝分裂(二核期)后,直接喷乙烯利,会出现4—8核的情况。在某些例子中,营养核和生殖核都发生反复分裂。在一个花粉中还看到有4个精子。
从乙烯利处理的花药分离多核花粉,经培养有可能形成胚,这种方法能增加单倍体诱导数量。
(六)培养基的成分
培养基成份是最重要因素之一,这不仅决定着花药培养的成功,还有发育方式。在简单的矿质一蔗糖培养基上能诱导烟草和天仙子属花粉的胚胎发生,然而,为了完成雄核发育,需添加某种生长调节剂。例如,禾谷类花药同时需要生长素和细胞分裂素,最适宜的生长反应依赖于这些内源生长调节剂的水平。可是,用低水平生长调节剂的简单培养基直接促进胚胎发生是可取的。含高浓度的生长素,如2,4-D的复合培养基促进遗传不稳定性的愈伤组织形成,应当避免。
基本培养基中的糖是不可缺少的,因为它们不仅是碳源,也含有渗透调节作用。高蔗糖浓度一般用0.058—0.12M,可是高浓度(0.17—0.29)的蔗糖,在小麦、大麦、马铃薯和水稻上获得较好结果。
另外,花药和马铃薯块茎的浸出液,分别刺激烟草和小麦的雄核发育。培养基中附加丝氨酸和谷酰胺也能改善离体花粉的培养。
(七)活性炭的作用
已报道了活性碳促进各种真菌、藓、蕨类植物和兰花的生长。Anagnostakis(1974)扩大用于烟草,观察到雄核发育的花药数由15%增加到最大为45%。Bajaj等(1977)作了进一步完善。用2%的活性碳附加到基本培养基中,烟草雄核发育的花药百分率由41增加到91%(表5-4)。另外,每个花药产生的植株数量增加,并加速了从花药再生植株。在银莲花属、黑麦和马铃薯中观察到活性碳对雄核发育的类似刺激效应。
活性碳提高了雄核发育频率,但对这种方法并不太了解,虽然提出了各种各样的推测。Fridborg和Eriksson(1975)观察到活性碳提高胡萝卜胚胎发生。同时在活性碳培养基上获得了洋葱根的形成,虽然这种培养体通常不产生根。另外,Weatherhead等认为烟草雄核发育的增高,是由于活性碳吸附了有害的5羟甲基糖醛。这是高压消毒时由蔗糖产生的。
在烟草上,似乎活性碳通常能吸附降低仰制花粉胚的物质数量。可是,更为可能是,调节了内源和外源生长物质水平。尽管没有这方面证明,仍然是可取的。至少已有某些种,还将延伸到其他的种,活性碳对提高单倍体植株的诱导作用是很有希望的。
【参考文献】:
〔1〕Bajaj Y.P.S.,Reinert,J.,and Heberle E.1977 Factors enhancing in vitro production of haploid plants in anthers and isolated mierospores.In:La Culture des Tissue et Cellules des Vegetaux(R.J.Gautheret,ed.)p.47—58.Mason Press,Paris,New York.
〔2〕Jensen,C.J.1977 Monoploid production by Chromosome elimination.In: Applied and Fundamental Aspects of Plant Cell,Tissue,and Organ Culture(J.Reinert and Y.P.S.Bajaj,eds.)pp.299—330,Springer-Verlage,Berlin,Heideberg;New York.
〔3〕Nitsch,C.1974 Pollen culture—A new technique for mass production of haploid and homozygous plants.In:Haploids in Higher Plants-Advances and Potential(K.J.Kasha,ed.)pp.123—135.Univ.Guelph Press,Guelph.
〔4〕Sunderland,N.and Dunwell,J.M.1977 Anther and pollen culture.In:Plant Tissue and Cell Culture(H.E.Street,ed.)pp.223-265,Blackwell.Oxford.